不同冲击性负荷运动对小鼠Wnt信号通路及骨合成代谢的影响
2021-08-09杨念恩王娜
杨念恩 王娜

摘 要:目的:尋求有利于骨量积累和提高峰值骨量的运动方式,并探讨不同冲击性负荷对骨合成代谢的影响及其分子生物学机制。方法:C57BL/6小鼠48只,分成下坡跑台(DT)组、平坡跑台(T)组、游泳(S)组和对照(C)组,每组12只。DT组、T组和S组小鼠每组8只,分别进行下坡跑台训练、平坡跑台训练和游泳训练,C组小鼠不训练。训练8周后,取左后肢用原子吸收分光光度法测胫骨骨矿含量,取右后肢用荧光定量PCR法测Wnt信号通路相关蛋白的mRNA表达;每组4只小鼠,取间充质干细胞培养后诱导分化,用于成骨细胞基因表达、ALP染色和Von Kossa染色。结果:(1)8周运动后,与C组相比,DT组(P<0.01)和T组(P<0.05)小鼠胫骨无机盐中钙含量均显著提高,DT组和T组胫骨无机盐中磷的含量均显著提高(P<005),而S组与C组相比,钙和磷含量均无差异(P>0.05)。在3个运动组比较中,DT组钙和磷含量提高最多。(2)8周运动后,不同方式运动对Wnt信号通路中Fz、DVL、β-catenin、Rock、JNK的mRNA表达产生显著影响(P<0.05);(3)4组小鼠原代间充质干细胞分化后ALP和OCN基因表达差异显著,ALP活性及矿化结节也明显不同。结论:高冲击性负荷运动显著提高生长期小鼠胫骨骨盐中钙和磷元素含量,提高骨强度。不同冲击性负荷运动调节骨合成代谢的途径不同,高冲击性负荷运动激活Wnt/PCP信号通路,下调通路中效应蛋白ROCK和JNK的基因表达,促进骨合成代谢;低冲击性负荷运动运动激活经典Wnt信号通路,调节骨合成代谢。高冲击性负荷运动对ALP和OCN基因表达影响更显著,通过ALP活性和骨矿化调节骨的理化特性。
关键词:下坡跑台运动;骨合成代谢;骨矿含量;标志基因; 骨矿化结节
中图分类号:G804.2 文献标识码:A 文章编号:1006-2076(2021)02-0088-07
Abstract:Objective:The purpose of this study is to find out the movement mode which is beneficial to bone mass accumulation and increase the peak bone mass, and to explore the influence of different impact loading on bone synthesis and metabolism and its molecular biological mechanism. Methods:48 C57BL/6 mice were divided into DT group, T group, S group and C group, 12 in each group. In DT group, T group and S group, 8 mice in each group were trained in downhill running platform, treadmill exercise and swimming, respectively. After 8 weeks of training, bone mineral content of tibial in mice was determined by atomic absorption method. The mRNA expression of wnt signaling pathway-related proteins was measured by fluorescence quantitative PCR, and the material was taken from the right hind limb. Four mice in each group were sacrificed, take mesenchymal stem cell culture and then induce differentiation, and which can be used to detect gene expression. It can also be used for ALP staining and Von kossa staining. Results:(1) The calcium content in DT group (P<0.01) and T group (P<0.05) was significantly increased after 8 weeks of exercise compared with the C group. The contents of phosphorus in tibial inorganic salt in DT and T groups were significantly increased (P<0.05). There was no difference in calcium and phosphorus content between the S group and the C group (P>0.05). Among the three exercise groups, the calcium and phosphorus contents of DT group increased most. (2) After 8 weeks of exercise, different modes of exercise had a significant effect on the mRNA expression of Fz, DVL、β-Catenin、Rock、JNK genes in Wnt signaling pathway (P<0.05); (3) It was significantly different that the expression of ALP and OCN genes after differentiation of primary mesenchymal stem cells in four groups of mice. Moreover, the activity of ALP and the mineralized nodules were also significantly different. Conclusion:High impact loading exercise significantly increased the content of calcium and phosphorus in tibial bone and increased bone strength. The pathways of regulating bone synthesis metabolism by different impact loading exercise are different. High impact loading activates Wnt/PCP signaling pathway and then down-regulates gene expression of effector protein ROCK and JNK, and promotes bone synthesis metabolism. Low impact loading exercise activates classical Wnt signaling pathway and regulates bone synthesis metabolism. The effect of high impact loading exercise on ALP and OCN gene expression was more significant, and the physicochemical properties of bone were regulated by ALP activity and bone mineralization.
Key words: downhill running; bone synthesis metabolism;bone mineral content; marker gene; osteomineralized nodules
不同方式的运动对骨代谢产生不同的影响,研究较多的运动方式是有氧运动和抗阻运动,并且认为抗阻运动对骨的影响要大于有氧运动 [1]。Schipilow [2]等人探讨肌肉力量与骨质之间的关系,发现高山滑雪运动员、足球运动员和游泳运动员之间的肌肉力量没有差异,而高山滑雪运动员和足球运动员的骨密度、皮质骨厚度、破坏载荷(failure load)都显著大于游泳运动员,认为冲击性负荷(impact loading)对骨质影响更为显著。像纵跳和下坡跑这种对骨垂直于地面作用力强的运动能够提高骨密度,增加骨形成。运动锻炼在骨量的积累和维持过程中起到至关重要的作用,能有效提升骨矿含量,提高幅度能够达到9 ~17 [3]。在可承受范围内,骨矿含量和骨所承受的压力强度升高的幅度跟运动强度之间具有量效关系。
在调节骨代谢的信号转导通路中,Wnt信号通路起到关键作用。Wnt 信号途径有三条胞内转导通路,分别是Wnt/β-catenin 通路、Wnt/Ca2+ 通路、Wnt / PCP 通路,其中Wnt/β-catenin 通路是经典的信号通路,作用于成骨细胞前体,促使它们分化为成熟的成骨细胞,并且在成熟的成骨细胞中调节RANKL/OPG的比率,抑制骨吸收[4]。其他两条非经典的Wnt信号转导通路通过抑制γ过氧化物酶体增生受体(PPARγ)的表达促进骨髓间充质干细胞向成骨细胞的分化,促进骨合成代谢[5],也能够通过RANKL诱导破骨细胞形成[6]。游泳时骨骼只受到剪切力,没有来自于地面冲击力;而下坡跑时骨骼受到的地面冲击力比较大,平坡跑时骨骼受到的地面冲击力介于下坡跑和游泳之间。针对骨骼受地面冲击力的不同,设计该运动方案,探讨不同的冲击性负荷是否影响生长期小鼠的骨合成代谢,具体观察不同冲击性负荷对小鼠骨矿含量产生怎样影响,分析不同冲击性负荷对Wnt信号通路和骨合成标志物基因表达的影响,研究不同冲击性负荷影响骨合成代谢的生理机制。
1 实验动物及方法
1.1 实验动物
5周龄雄性C57BL/6小鼠(清洁级),许可证号:使用许可SYXK(沪)2013-0062,体重(15.76±0.63)g,购回后于动物房分笼饲养,每笼8只。国家标准啮齿动物饲料喂养,自由饮食和饮水。每周更换垫料1~2次,环境温度为23℃±2℃,相对湿度为50 ,自然昼夜照明,遵循12 h/12 h明暗周期。
1.2 实验方案
(1)动物分组:C57BL/6小鼠48只,分为4组,下坡跑台组(DT组)、平坡跑台组(T组)、游泳组(S组)、安静对照组(C组),每组12只。其中DT组、T组和S组小鼠每组8只,分别进行下坡跑台训练、平坡跑台训练和游泳训练,C组小鼠不训练。训练8周后,用于检测胫骨骨矿含量和Wnt信号通路相关蛋白的mRNA表达;另有每组余下4只小鼠,用于检测成骨细胞基因表达、ALP染色和Von Kossa染色。
(2)训练方案:①下坡跑组(DT组):速度0.8 km/h,坡度-9°; ②平坡跑台组(T组),速度0.8 km/h,坡度为0°;③游泳组(S组):游泳训练池大小为50 cm×50 cm×60 cm,水深45 cm,水溫30℃±2℃;当小鼠漂浮不动时用毛刷搅动驱赶。以上三种方式训练持续时间为40 min, ④安静对照组(C组):与其他组小鼠一起饲养,无运动干预。适应性喂养1周后于晚6点对小鼠进行一次适应性训练,隔两天后,按上述运动方案训练,18:00-19:00训练,5天/周,共8周。
(3)取材:最后一次训练结束后静置24 h,断颈椎处死。取左后肢保留软组织,用于骨矿含量检测。取右后肢用于骨组织基因mRNA表达检测;取骨髓间充质干细胞( bone marrow-derived mesenchymal stem cells,MSCs) 进行细胞原代培养并诱导其向成骨细胞(osteoblast,OB)分化,分化后碱性磷酸酶(ALP)染色测成骨细胞活性, Von Kossa染色检测成骨细胞矿化结节能力。
1.3 指标检测
1.3.1 运动后小鼠骨矿含量检测
取出完整胫骨,去除附着肌肉组织,用三氯甲烷,甲醇混合液(2 ∶ 1)脱脂72 h,在环流热空气高热箱中120℃烘6 h,冷却后在万分之一天平上称取重量为干重(g);置马福炉内600℃下灰化6 h至成白色粉末状,干燥冷却后用天平称取重量为灰重(g)。干骨中无机盐含量比值=灰重/干重;灰化骨用浓硝酸消解,待测消解后样本溶液进入原子吸收分光光度计对钙、磷元素进行测量。
1.3.2 运动后小鼠骨组织相关基因mRNA表达检测
利用Trizol法提取总RNA,按照PrimeScriptTM RT Master Mix(Perfect Real Time)说明书进行逆转录,将反转录好的cDNA作为模板进行PCR扩增。PCR 扩增采用三步法扩增,扩增条件为95℃变性30 s,60℃退火30 s,72℃延伸45 s,45个循环。根据PCR 扩增仪中的各反应孔的数值,以β -actin 为内参,根据公式2-△△CT 计算最后目的基因的相对表达量。引物序列利用Primer premer软件进行设计,由上海生工生物工程有限公司合成(表1)。
1.3.3 MSCs成骨诱导分化后成骨标志mRNA检测、ALP染色和Von Kossa染色
8周运动后将小鼠断颈椎处死,75 酒精浸泡5 min,无菌条件下取股骨和胫骨,剔除附着肌肉;用缓冲液冲洗2次,剪掉两端关节,再用无菌 20 ml 注射器及 25 号针头,吸取配好的间充质干细胞培养基冲洗髓腔,收集细胞,取MSCs放入4个6 cm培养皿中,加3 ml培养基培养7天后,在间充质干细胞培养基添加诱导剂(osteogenic stimuli, OS),诱导剂配方:0.1 μM地塞米松+0.2 mM维生素c+10 mMβ-甘油磷酸钠。中间隔一天换一次液,成骨分化10天时分别提取各组成骨细胞总RNA,进行qRT-PCR检测,每组做3个平行检测。
将DT组、T组、S组和C组小鼠原代MSCs接入12孔板,每组3个复孔,每孔细胞数目为1×105个,干细胞培养基1 ml,待细胞长至85 汇合时,诱导分化,在诱导分化7天时进行染色。将12孔板中培养基甩掉,PBS洗一次,加入4 PFA固定15 min,加入刚配好的ALP染液(0.2M pH值9.4马来酸加0.01 Naphthol AS-TR phosphate disodium salt 和0.06 FastRed Vilot。),背光20 min后弃染液,每孔加入微量双蒸水,用相机拍照。
4组小鼠原代MSCs计数后接入6孔板,每孔细胞数目为2×105个,每组3个复孔,培养5~10天。细胞长至85 汇合时诱导分化,隔一天换一次培养基。当在显微镜下能看到许多细胞分泌的黑色小颗粒时,开始染色。培养板用PBS冲洗2次,4%多聚甲醛固定5分钟,双蒸水冲洗3次,加入2.5%硝酸银溶液1ml,将培养板开盖在紫外灯下照射1小时,倒出残留的硝酸银溶液,用蒸馏水冲洗3遍,入5%硫代硫酸钠溶液1 ml,中和残留的硝酸银溶液,吸出残液,将培养板室倒置放于吸水纸上,晾干后拍照。
1.4 统计方法
数据使用平均数±标准差(±SD)表示。以C组作为无运动干预的对照组,对S组、T组和DT组的训练效果进行分析。对骨矿含量和Wnt信号通路蛋白mRNA表达指标进行以训练方案作为主因子的单因素方差分析,用多重比较LSD法分析不同训练方案所产生的差异。统计软件为SPSS18.0,取P<0.05为具有显著性差异,P<0.01具有非常显著性差异。
2 实验结果
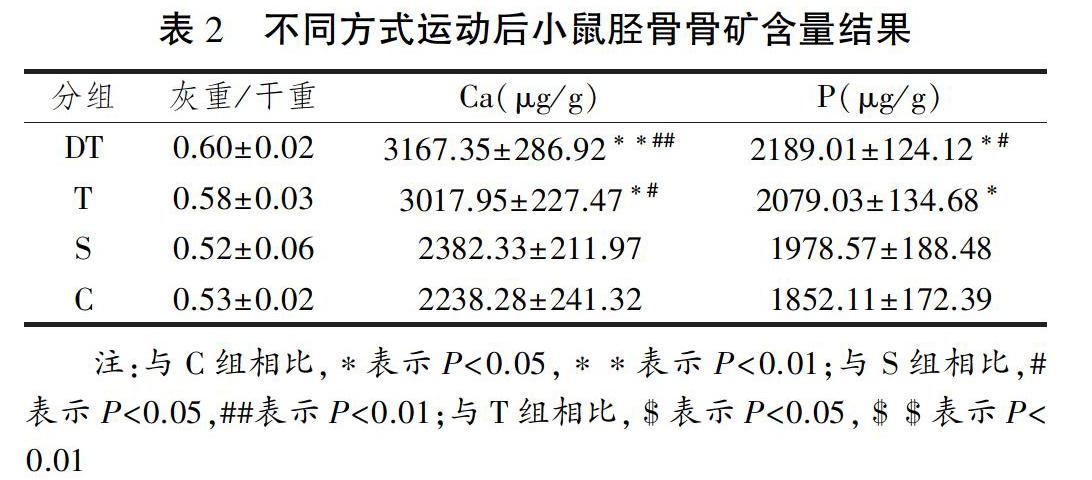
2.1 不同方式运动后小鼠骨矿含量
8周不同方式运动后小鼠胫骨骨矿含量通过灰化和原子吸收分光光度法检测,该法测定骨磷、钙含量,精密度和准确度都很高。将数据进行单因素方差分析,4组小鼠胫骨灰重/干重组间不存在显著性差异;但是与C组相比,DT组(P<0.01)和T组(P<0.05)胫骨无机盐中钙含量均显著提高,DT组和T组胫骨无机盐中磷的含量均显著提高(P<0.05),而S组与C组相比,钙和磷含量均无差异(P>0.05)。在3个运动组比较中,DT组钙和磷含量提高最多(见表2)。
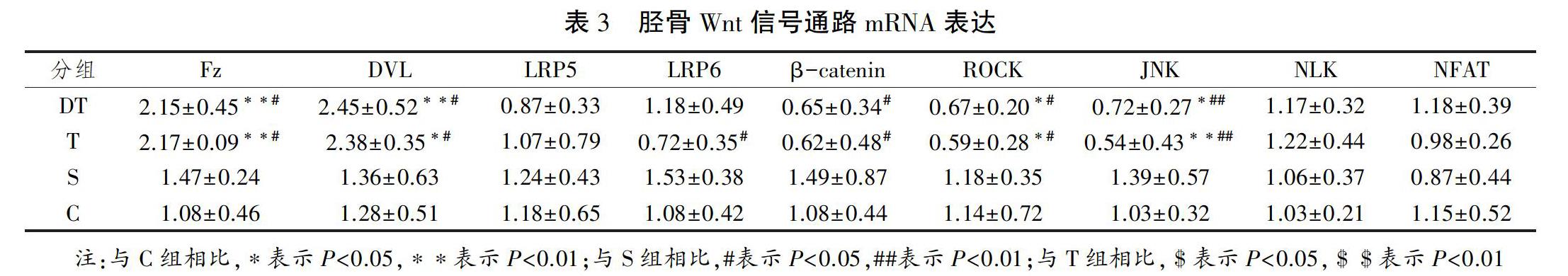
2.2 不同方式运动后小鼠胫骨Wnt信号通路mRNA表达
8周训练后取各组小鼠胫骨,抽提mRNA,通过qRT-PCR测基因表达,对胫骨中提取出Wnt信号通路蛋白的mRNA的表达进行相对定量,并对结果进行单因素方差分析和多重比较(如表3所示),结果显示:8周运动后,不同方式运动对Wnt信号通路中Fz、DVL、β-Catenin、Rock、JNK的mRNA表达产生显著影响(P<0.05)。
2.3 MSCs诱导分化后成骨活性及矿化结节染色结果
8周运动后小鼠原代MSCs诱导分化,检测成骨细胞基因表达,用单因素方差分析和多重比较对检测结果进行统计分析,不同组别小鼠成骨细胞特异性表达的基因ALP呈现显著性差异(P<0.05),OCN表达呈现非常显著性差异(P<0.01)(见表4)。ALP表达差异主要表现在DT组,DT组ALP基因表达显著下调;相对于C组,3个运动组OCN基因表达都显著下调(P<0.01)。
由图1可知DT组小鼠ALP活性要低于另外3組;由图2可知,DT组和T组的矿化结节情况要好于S组和C组。
3 分析与讨论
3.1 不同方式运动对胫骨骨矿含量的影响
骨钙、磷含量的测定是综合评价骨质疏松的重要指标之一,与骨密度的检测结果具有较高的一致性,并且反映出骨矿含量的具体变化,能够更细致地反映骨状况。胫骨是主要的承重骨,密度较大,故胫骨骨钙、磷含量的多少对骨强度的评价具有代表性意义。从骨无机盐含量(灰重/干重)看,DT组和T组略高于C组和S组,组间差异不显著。DT组和T组骨无机盐中钙、磷含量显著高于C组,DT组钙、磷含量也显著高于S组,表明平坡跑台和下坡跑台这两种有地面反作用力的冲击性运动能够显著提高骨矿中钙含量。究其原因,这与不同方式运动的运动强度不一致有关。有关运动强度与骨的研究发现,多数研究肯定运动强度与骨密度正相关[7-8],部分研究认为运动强度对骨密度没有显著影响[9-10]。也有研究表明高强度运动抑制骨吸收和骨形成,即降低骨转换;低强度运动抑制骨吸收,不影响骨形成,提高骨矿含量,增强骨强度,更有利于骨健康;另外,高冲击力运动对骨转换影响较显著[11]。这些研究结果的不一致可能和实验对象及其干预时间有关。
本研究表明,和游泳运动相比,跑台运动促进骨矿含量增加的效果更显著,这与所受地面冲击性负荷的大小有关。游泳时,骨骼肌牵拉骨骼产生剪切力的作用,但是类似于失重状态,没有地面冲击力负荷的作用,再者检测骨矿所选取的骨骼是承重的下肢骨。
3.2 不同方式运动对Wnt信号通路mRNA表达影响
Wnt信号通路骨重建过程中起到决定性作用。Wnt配体是一种分泌型糖蛋白,与细胞膜表面受体Fz、LRP5/6结合,激活Wnt信号通路。在经典Wnt信号通路中,Fz和LRP5/6组成Wnt共受体,在受到Wnt配体激活后,Fz受体募集DVL,LRP5/6募集Axin,致使GSK3β-Ck1-Axin-APC这一4聚体结构解聚,该4聚体能够促进β-catenin磷酸化,磷酸化的β-catenin会被进一步泛素化降解。因此经典Wnt信号通路的激活能够抑制β-catenin降解,导致胞浆内β-catenin增多,更多的β-catenin跨膜转运与Lef1/Tcf结合,活化Lef1/Tcf,激活Wnt靶基因转录[12]。
此外还有两条非经典的Wnt信号通路,Wnt/Ca2+和Wnt/PCP信号通路,在这两条信号通路中,Wnt配体只和Fz受体结合激活下游细胞因子。在Wnt/PCP信号通路中,依赖于DVL激活Rho和Rac这两种GTP 酶,随后通过JNK ( c-Jun NH2-terminal kinase )途径激活下游靶基因的转录。Wnt/PCP信号通路主要调节软骨细胞的生长增殖,调控骨的三维形状[13-14]。
DVL作为Fz受体的下游蛋白,在经典Wnt信号通路和Wnt/PCP信号通路中起到不同的作用。在经典Wnt信号通路中, DVL通过磷酸化LRP6,促进了Wnt-LRP6/5-Fz聚合体的行程,激活下游通路,最终通过β-catenin转运到核内促进靶基因的转录;在Wnt/PCP信号通路中, DVL通过和下游效应器结合,通过多条信号通路作用于肌动蛋白细胞骨架,调节骨的三维形状。DVL的下游细胞因子中,JNK和ROCK起到重要作用,被作为该信号通路下游标志性蛋白。利用ROCK抑制剂条件性阻断Wnt/PCP信号通路后,发现成骨细胞粘附性发生改变,成骨细胞分化能力和矿化能力增强,促进了骨合成代谢[15],这表明了ROCK对骨形成起到负调节作用。
NLK(Nemo-like kinase)在体内调节多条信号通路,主要有Mapk信号通路和Wnt/Ca2+信号通路[16-17] 。NLK基因敲除小鼠在妊娠末期死亡,在NLK缺乏的情况下,在骨髓间充质肝细胞中会缺失骨衬细胞[18]。最近的研究发现,Wnt配體Wnt1和Wnt5a通过MAPKKK TAK1活化NLK,NLK磷酸化一些特异性底物,其中包括TCF/Lef1,抑制了β-catenin和TCF/Lef1相结合,进而抑制Wnt信号通路靶蛋白的转录[19-20]。NLK过表达的成骨细胞ALP活性和矿化结节都变弱,NLK低表达的成骨细胞表现出相反的生理特性,这些证据表明,NLK对骨形成也是负向调节作用[21]。
NFAT(nuclear factor of activated T cells)表达下调的小鼠骨量和矿物沉积率都显著增加,小梁骨厚度显著变薄;这种小鼠骨髓间充质干细胞培养过程中发现,向成骨细胞分化明显减少,向B淋巴细胞分化明显增多[22]。也有研究发现NFAT也调节破骨细胞骨吸收代谢,注射NFAT抑制剂后,由手术引起的骨质溶解明显降低[23],该机制是通过调节TNF-α运行的[24]。可见,NFAT对骨形成的负向调节是通过骨形成和骨吸收两个方面发挥作用的。
本研究发现,和C组相比,8周运动后S组小鼠胫骨Fz、LRP5/6、DVL、β-catenin、JNK、ROCK、NLK和NFAT基因表达都没有显著变化;DT组和T组小鼠胫骨Fz、DVL、ROCK和JNK基因表达与C组和S组相比都有显著变化。8周跑台运动和游泳运动后,小鼠骨密度显著升高,不同方式运动对骨形成影响机制不同。跑台运动过程中,除肌肉牵拉产生的剪切力外,地面反作用力会给小鼠骨骼一个纵向的冲击力;游泳运动过程中,骨主要受到肌肉横向剪切力作用。从Wnt信号通路来看,跑台运动引起了Wnt 信号通路受体Fz和下游蛋白DVL基因表达的上调,Fz受体在经典Wnt信号通路、Wnt/PCP和Wnt/Ca2+信号通路这3条信号通路中都是作为Wnt配体的受体而发挥作用,DVL参与经典Wnt信号通路和Wnt/PCP信号通路,至于跑台运动具体激活的是哪一条信号通路,还要看Wnt信号通路下游效应蛋白的表达。8周跑台运动引起胫骨ROCK和JNK基因表达的显著下调,而β-catenin、NLK和NFAT基因表达没有显著变化,β-catenin是经典Wnt信号通路中标志性效应蛋白,ROCK和JNK是Wnt/PCP信号通路中效应蛋白,NLK和NFAT是Wnt/Ca2+信号通路中的效应蛋白,这些结果显示,8周跑台运动激活Wnt信号通路,诱导Wnt/PCP信号通路中ROCK和JNK基因表达下调,促进骨合成代谢。
相对于平坡跑台运动,游泳运动引起胫骨LRP6和β-catenin基因表达显著上调;相对于下坡跑台运动,游泳运动诱使胫骨β-catenin基因表达显著上调。LRP5是经典Wnt信号通路中的共受体,β-catenin是经典Wnt信号通路中的标志性效应蛋白,结果表明游泳运动激活经典Wnt信号通路,通过经典Wnt信号通路调节下游蛋白转录合成进而调节骨合成代谢。
3.3 不同方式运动对小鼠OB成骨活性和矿化结节的影响
ALP和OCN被认为是成骨细胞特异性表达的标志物,一般用ALP活性和OCN表达来评价成骨细胞的成骨能力。本实验研究结果显示,各组原代MSCs诱导分化后ALP活性不同,T组和S组ALP活性更强。Kaspar[25]等人的研究显示,机械负荷刺激能够促进成骨细胞前体的增殖及其羧基端胶原蛋白1的合成,而ALP活性及其OCN的表达显著降低。经典Wnt信号通路的激活并不一定和成骨细胞的分化直接关联,Boland[26]等人就报道了用Wnt3a激活经典Wnt信号通路促进MSCs的增殖,却抑制了成骨细胞的分化;Eijken[27]研究表明经典Wnt信号通路激活抑制了ALP的活性。
OCN作为成骨能力指示剂,在成骨分化过程中其基因表达都显著性下调。OCN在骨矿化峰期之后才出现积聚,是一种高度特异性的晚期成骨细胞标志物。OCN基因敲除小鼠出生时骨没有出现异常,6个月后,骨密度和骨厚度都比野生型小鼠要高,表明OCN对骨形成是负向调节作用[28]。 本实验基因检测在诱导分化10天左右,此时骨矿化结节还没有形成,此时OCN的表达量还较少,若在骨矿化峰期出现后,各组成骨细胞OCN基因表达量可能会有所改变。
骨矿化能力是成骨细胞成骨能力的主要标志,骨矿化决定了骨密度和骨强度。Von Kossa染色检测细胞外机制矿化情况,反映骨矿化能力,由图2可见,DT组和T组成骨细胞分化后矿化能力要优于S组和C组,C组矿化能力最弱。运动对体内骨矿化具有非常重要的作用,运动后原代MSCs成骨分化后还保留着像体内类似的矿化能力,成骨细胞的矿化能力和OCN的表达密切相关[29-30]。实验结果显示,3个运动组OCN基因表达都显著下调,而骨矿化能力都强于C组,提示分化中期OCN的低表达能够促进成骨细胞矿化能力。
4 结 论
高沖击性负荷运动显著提高生长期小鼠胫骨骨盐中钙和磷元素含量,提高骨强度。不同冲击性负荷运动调节骨合成代谢的途径不同,下坡和平坡跑台运动通过激活Wnt/PCP信号通路,下调通路中效应蛋白ROCK和JNK的基因表达,促进骨合成代谢;游泳运动通过激活经典Wnt信号通路,调节下游靶蛋白转录合成进而调节骨合成代谢。高冲击性负荷运动对ALP和OCN基因表达影响更显著,通过ALP活性和骨矿化调节骨的理化特性。
参考文献:
[1]Parhampour B, Torkaman G, Hoorfar H, et al. Effects of short-term resistance training and pulsed electromagnetic fields on bone metabolism and joint function in severe haemophilia A patients with osteoporosis:a randomized controlled trial[J]. Clin Rehabil,2014, 28(5):440-450.
[2]Schipilow J D, Macdonald H M, Liphardt A M, et al. Bone micro-architecture, estimated bone strength, and the muscle-bone interaction in elite athletes:an HR-pQCT study[J]. Bone,2013, 56(2):281-289.
[3]Baxter-Jones A D, Kontulainen S A, Faulkner R A, et al. A longitudinal study of the relationship of physical activity to bone mineral accrual from adolescence to young adulthood[J]. Bone,2008, 43(6):1101-1107.
[4]Kobayashi Y, Maeda K, Takahashi N. Roles of Wnt signaling in bone formation and resorption[J]. Japanese Dental Science Review,2008(44):76-82.
[5]Takada I, Mihara M, Suzawa M, et al. A histone lysine methyltransferase activated by non-canonical Wnt signalling suppresses PPAR-gamma transactivation[J]. Nat Cell Biol,2007, 9(11):1273-1285.
[6]Kobayashi Y. [Roles of Wnt signaling in bone metabolism][J]. Clin Calcium,2012, 22(11):1701-1706.
[7]Lauder T D, Dixit S, Pezzin L E, et al. The relation between stress fractures and bone mineral density:evidence from active-duty Army women[J]. Arch Phys Med Rehabil,2000, 81(1):73-79.
[8]Pruitt L A, Taaffe D R, Marcus R. Effects of a one-year high-intensity versus low-intensity resistance training program on bone mineral density in older women[J]. J Bone Miner Res,1995, 10(11):1788-1795.
[9]Humphries B, Newton R U, Bronks R, et al. Effect of exercise intensity on bone density, strength, and calcium turnover in older women[J]. Med Sci Sports Exerc,2000, 32(6):1043-1050.
[10]Inoue Y, Matsui A, Asai Y, et al. Response of biochemical markers of bone metabolism to exercise intensity in thoroughbred horses[J]. J Equine Sci,2008, 19(4):83-89.
[11]Rantalainen T, Heinonen A, Linnamo V, et al. Short-term bone biochemical response to a single bout of high-impact exercise[J]. J Sports Sci Med,2009, 8(4):553-559.
[12]Gao C, Chen Y G. Dishevelled:The hub of Wnt signaling[J]. Cell Signal,2010, 22(5):717-727.
[13]Li Y, Dudley A T. Noncanonical frizzled signaling regulates cell polarity of growth plate chondrocytes[J]. Development,2009, 136(7):1083-1092.
[14]Nasevicius A, Hyatt T, Kim H, et al. Evidence for a frizzled-mediated wnt pathway required for zebrafish dorsal mesoderm formation[J]. Development,1998, 125(21):4283-4292.
[15]Prowse P D, Elliott C G, Hutter J, et al. Inhibition of Rac and ROCK signalling influence osteoblast adhesion, differentiation and mineralization on titanium topographies[J]. PLoS One,2013, 8(3):e58898.
[16]Meneghini M D, Ishitani T, Carter J C, et al. MAP kinase and Wnt pathways converge to downregulate an HMG-domain repressor in Caenorhabditis elegans[J]. Nature,1999, 399(6738):793-797.
[17]Rocheleau C E, Yasuda J, Shin T H, et al. WRM-1 activates the LIT-1 protein kinase to transduce anterior/posterior polarity signals in C. elegans[J]. Cell,1999, 97(6):717-726.
[18]Kortenjann M, Nehls M, Smith A J, et al. Abnormal bone marrow stroma in mice deficient for nemo-like kinase, Nlk[J]. Eur J Immunol,2001, 31(12):3580-3587.
[19]Kanei-Ishii C, Ninomiya-Tsuji J, Tanikawa J, et al. Wnt-1 signal induces phosphorylation and degradation of c-Myb protein via TAK1, HIPK2, and NLK[J]. Genes Dev,2004, 18(7):816-829.
[20]Ishitani T, Ninomiya-Tsuji J, Matsumoto K. Regulation of lymphoid enhancer factor 1/T-cell factor by mitogen-activated protein kinase-related Nemo-like kinase-dependent phosphorylation in Wnt/beta-catenin signaling[J]. Mol Cell Biol,2003, 23(4):1379-1389.
[21]Nifuji A, Ideno H, Ohyama Y, et al. Nemo-like kinase (NLK) expression in osteoblastic cells and suppression of osteoblastic differentiation[J]. Exp Cell Res,2010, 316(7):1127-1136.
[22]Sesler C L, Zayzafoon M. NFAT signaling in osteoblasts regulates the hematopoietic niche in the bone microenvironment[J]. Clin Dev Immunol,2013(2013):107321.
[23]Yamanaka Y, Clohisy J C, Ito H, et al. Blockade of JNK and NFAT pathways attenuates orthopedic particle-stimulated osteoclastogenesis of human osteoclast precursors and murine calvarial osteolysis[J]. J Orthop Res,2013, 31(1):67-72.
[24]Liu F X, Wu C L, Zhu Z A, et al. Calcineurin/NFAT pathway mediates wear particle-induced TNF-alpha release and osteoclastogenesis from mice bone marrow macrophages in vitro[J]. Acta Pharmacol Sin,2013, 34(11):1457-1466.
[25]Kaspar D, Seidl W, Neidlinger-Wilke C, et al. Dynamic cell stretching increases human osteoblast proliferation and CICP synthesis but decreases osteocalcin synthesis and alkaline phosphatase activity[J]. J Biomech,2000, 33(1):45-51.
[26]Boland G M, Perkins G, Hall D J, et al. Wnt 3a promotes proliferation and suppresses osteogenic differentiation of adult human mesenchymal stem cells[J]. J Cell Biochem,2004, 93(6):1210-1230.
[27]Eijken M, Meijer I M, Westbroek I, et al. Wnt signaling acts and is regulated in a human osteoblast differentiation dependent manner[J]. J Cell Biochem,2008, 104(2):568-579.
[28]Wolf G. Function of the bone protein osteocalcin:definitive evidence[J]. Nutr Rev,1996, 54(10):332-333.
[29]Herberg S, Fulzele S, Yang N, et al. Stromal cell-derived factor-1beta potentiates bone morphogenetic protein-2-stimulated osteoinduction of genetically engineered bone marrow-derived mesenchymal stem cells in vitro[J]. Tissue Eng Part A,2013, 19(1/2):1-13.
[30]Liu C, Yu J, Yang Y, et al. Effect of 1 mT sinusoidal electromagnetic fields on proliferation and osteogenic differentiation of rat bone marrow mesenchymal stromal cells[J]. Bioelectromagnetics,2013, 34(6):453-464.
