一种烟草细菌性叶枯病病原鉴定及防治药剂筛选
2021-08-09王大会蒋承耿王忠宇龙友华樊荣莫飞旭石金巧
王大会 蒋承耿 王忠宇 龙友华 樊荣 莫飞旭 石金巧

摘 要:为明确在贵州省六盘水市烟区发生的一種烟草细菌性叶枯病的病原并筛选出防治药剂,本研究通过组织分离法分离病原菌,结合形态学鉴定、柯赫氏法则和分子生物学等方法鉴定病原菌,并初步研究该菌的生理生化特性,采用抑菌圈法测定15种杀菌剂对该病原菌的毒力。结果表明,该病害病原菌与成团泛菌(Pantoea agglomerans)同源性达100%,为革兰氏阴性菌,可利用D-阿拉伯糖、丙三醇和硝酸盐等碳氮源;室内防治药剂筛选试验表明,1.6%噻霉酮EW、3%中生菌素WP和80%乙蒜素EC对该菌有较好的抑菌效果,EC50值分别为0.004、0.0135和0.1176 mg/mL。试验表明,该烟草细菌性叶枯病致病菌为成团泛菌(Pantoea agglomerans),1.6%噻霉酮EW可作为防治该病害的有效药剂。
关键词:烟草;叶枯病;成团泛菌;病原鉴定;药剂筛选
Abstract: In order to identify the pathogen of bacterial leaf blight in Liupanshui City, Guizhou Province and screen for control agents, in this study pathogenic bacteria were isolated by tissue separation. In combination with morphological identification, Koch's rule and molecular biology approaches, physiological and biochemical characteristics of the bacteria were preliminarily studied. The toxicity of 15 fungicides to the pathogen was determined by the bacteriostasis method. The results showed that the pathogen has 100% homologous with Pantoea agglomerans, a gram-negative bacterium, which can use carbon and nitrogen sources such as D- arabinose, propanol and peptone. The screening test of indoor control agents showed that 1.6% Thiamphenone EW, 3% Zhongshengmycin WP and 80% Ethylicin EC had good antibacterial effects on the bacteria. The EC50 values were 0.004 mg/mL, 0.0135 mg/mL and 0.1176 mg/mL respectively. The tests showed that the bacterial leaf blight pathogen of tobacco was Pantoea agglomerans. 1.6% thiamethoxone EW can be used as an effective agent to control the disease.
Keywords: tobacco; leaf blight; pantoea agglomerans; pathogen identification; pesticide screening
烟草(Nicotiana tabacum L.)是我国重要的经济作物之一[1-2],烟草病害是制约烟草生产的重要因素。目前已报道的烟草侵染性病害有60余种[3],其中常见的叶部病害包括由毁灭炭疽菌(Colletotrichum destructivum)、链格孢菌[Alter aria alternata (Fries)]、二孢白粉菌(Erysiphe cichoracearum)]等真菌引起的烟叶炭疽病、赤星病、白粉病等[4-6],由烟草假单胞杆菌(Pseudomonas syringae pv. Tabaci)、丁香假单胞杆菌角斑专化型[Pseudomonas syringae pv.Angulata (Fromeetal) Holland]、青枯雷尔氏杆菌(Rastonia solanacearum)等细菌引起的野火病、角斑病及青枯病等[7-9],以及由TMV、CMV、PVY等引起的烟草病毒病[10]。与之前报道的所有病害均不相同,2011年在贵州省六盘水市保田镇烟区零星发生一种烟草叶部病害,可引起烟株中下部叶片腐烂,通过室内保温保湿培养可观察到病部产生菌脓,因此初步判断该病害为细菌性病害。2018年该病害发生面积达66.67 hm2,重病田块病株率达100%,发病区域造成的平均经济损失达23.1%,严重损害了烟草的经济效益。
为明确该病害的病原,探索防控措施,本研究从发病烟叶中分离病原菌,采用柯赫氏法则、生理生化特性、分子生物学明确病原菌种类,通过室内毒力测定筛选有效的防控药剂,以期为该病害的诊断与防治提供技术参考。
1 材料与方法
1.1 供试材料及药剂
1.1.1 病样采集 2018年8月在贵州省六盘水市保田烟区采集感病叶片,装入采样袋,做好标记后4 ℃冷藏备用。
1.1.2 供试药剂 15种供试药剂种类及生产厂家见表1。
1.2 试验方法
1.2.1 病原菌分离纯化 采用常规组织分离法分离病原菌[11]。取样本病健交界处5 mm×5 mm组织块在75%酒精浸泡5 s,无菌水漂洗3次后置于灭菌研钵中,加入两滴无菌水进行研磨,充分研磨后用接种针蘸取少量菌液在NA平板划线,封口后置于28 ℃恒温培养箱培养48 h;挑取典型单菌落进一步纯化,纯化2~3次;挑取纯化后的单菌落于NB培养基中,在25 ℃恒温振荡器培养24 h,用移液枪取1 mL菌悬液与1 mL 30%灭菌甘油,置于冷存管中于?80 ℃冰箱中保存备用。
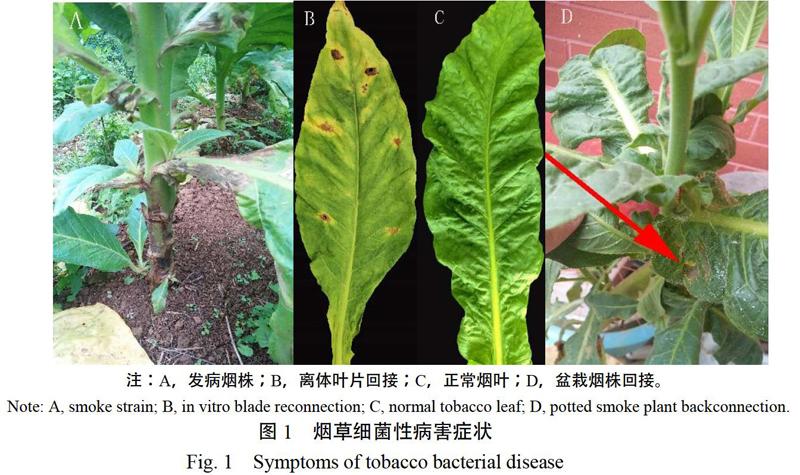
1.2.2 致病性测定 根据柯赫氏法则进行致病性测定。挑取单菌落混入NB培养液中,置于25 ℃恒温振荡箱培养24~48 h并将其稀释为1×106 cfu/g菌悬液备用。采用创伤接种法分别对离体烟叶和盆栽烟株进行接种,离体烟叶选取烟草中下部健康叶片,用70%酒精进行表面消毒,无菌水清洗3次晾干并刺伤,用菌悬液喷淋刺伤部位后装入自封袋内,置于人工气候箱(28 ℃,RH 75%)培养;盆栽烟株选取中下部叶片、叶柄基部进行接种,接种方式与离体烟叶相同。均以灭菌后的NB培养液作为空白对照,观察并记录发病情况,在发病后比对田间病害症状与回接产生的症状是否一致,并再次进行分离纯化,与接种菌株进行比对。
1.2.3 病原菌形态学鉴定 电镜观察菌体形态[12],并将病原菌接种在NA平板培养基上,置于28 ℃恒温培养箱内培养48 h完成病原菌的活化,观察记录菌落颜色、形态特征;挑取单菌落接入NB培养液置于28 ℃恒温振荡箱培养72 h,观察记录细菌悬液浑浊程度、是否沉淀、是否结膜、有无气泡;选取健康的薯块用1%次氯酸钠溶液浸泡24 h,采用刺伤接种法将菌悬液喷洒在薯块上,观察记录菌落生长形态以及薯块颜色变化情况。
1.2.4 病原菌分子生物学鉴定 首先活化病原菌,具体方法同1.2.3,待长出单菌落后将平板送至生工生物工程(上海)股份有限公司进行分子生物学鉴定,通用引物为细菌7F/1540R序列,PCR长度1500 bp左右。
1.2.5 病原菌生理生化特性试验 参照《伯杰细菌鉴定手册》[13]和《植物病原细菌鉴定实验指导》[14]进行病原菌生理生化特性测定。测定革兰氏反应、荧光检测、碳源利用(海藻糖、山梨醇、D-阿拉伯糖、丙三醇、丙二酸盐)、氮源利用(甘露醇、硝酸还原)、葡萄糖氧化发酵、淀粉水解、接触酶、氧化酶、M-R、V-P、七叶灵水解、明胶液化、吲哚的产生、YDC培养基上色素的产生等14项生理生化测定指标,3个重复,另设空白对照。
1.2.6 供试药剂的抑菌试验 采用滤纸片法测定病原菌对供试药剂的敏感性[15]。用接种针挑取培养24 h的病原菌置于NB培养基,恒温振荡培养24~48 h制成菌悬液备用;利用试管将药剂按推荐用量稀释成5个浓度梯度,以无菌水作为对照,将直径0.6 cm的灭菌滤纸片放于试管中浸泡1 h制成含药滤纸片;用移液枪量取500 μL菌悬液加入已冷却至45 ℃的NA培养基中,混匀后倒入培养皿,制成含菌平板,用镊子夹取含药滤纸片放于培养基中央封口,每个处理3个重复,做好标记后利用封口膜密封,置于28 ℃恒温培养箱内培养48 h,采用十字交叉法测量抑菌圈直径,计算相对抑制率和EC50。
2 结 果
2.1 病原菌的分离与致病性测定
从田间采集的发病样本中分离得到的微生物,经进一步纯化得到3个菌株,编号分别为PXH-1、PXH-2、PXH-3,对3个菌株进行致病性测定,结果显示编号为PXH-1菌株回接离体叶片与盆栽烟株均出现感病症状(图1B、D),发病初期叶片主要产生淡黄色椭圆形斑点,病斑初期产生褪绿小点,后期逐渐扩大为圆形褐色水渍斑,并伴有黄色晕圈。从回接发病叶片上均分离得到与PXH-1形态特征一致的菌株,故确定PXH-1菌株为引起该细菌性病害的病原菌。
2.2 病原菌的形态学观察与生理生化测定
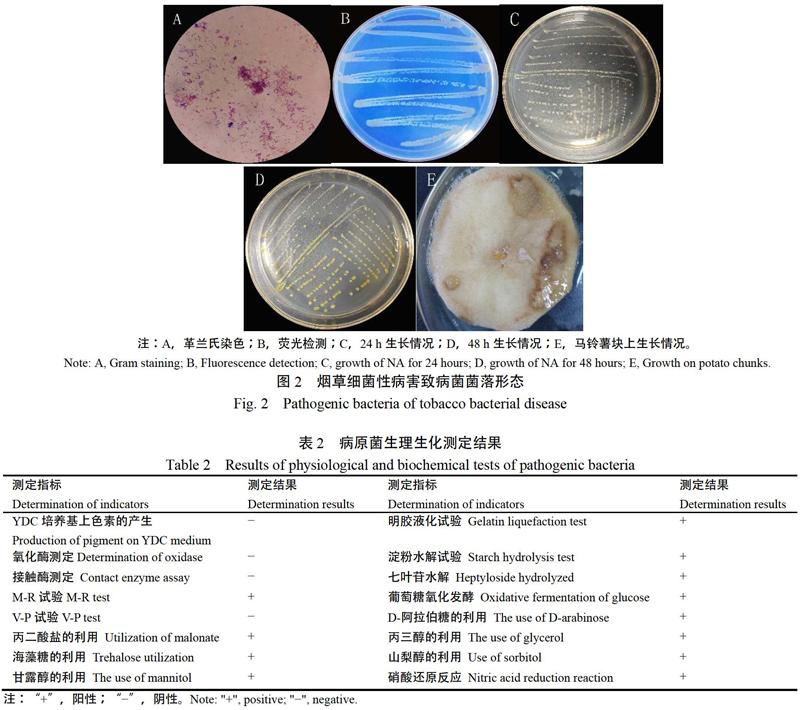
分离得到的PXH-1菌体呈直杆状,大小在(376~409)×(702~974) nm,为革兰氏阴性菌(图2A);菌体在紫外灯下不产生荧光反应(图2B);在NA培养基培养24 h出现乳白色圆形菌落(图2C);表面光滑无流动性,培养48 h产生黄色色素,呈现乳黄色圆形菌落并伴臭味(图2D);在NB培养基中生长良好,浑浊、有气泡且产生絮状沉淀;在马铃薯薯块上生长良好不易扩散,菌体呈乳黄色,薯块变褐色(图2E)。生理生化测定结果显示(表2),该致病菌在YDC培养基上不产生褐色素,淀粉水解、七叶灵水解、明胶水解结果呈阳性,接触酶、氧化酶测定结果为阴性,在有氧无氧条件下均可分解葡萄糖,可利用D-阿拉伯糖、丙二酸盐、丙三醇、海藻糖、山梨醇和甘露醇。根据以上形态学观察及相关生理生化测定结果,初步判定该菌与成团泛菌(P. agglomerans)相似[13]。
2.3 病原菌的分子生物学鉴定
用细菌通用引物7F/1540R扩增得到该细菌的16S rDNA序列,长1409 bp,在NCBI进行BLAST比对,结果与成团泛菌(P. agglomerans)同源性达100%。在GenBank数据库中下载近缘序列,以P. fluorescens为外群,通过软件MEGA 7.0,采用邻接法(Neighbor-Joining)构建系统发育树,PXH-1菌株与P. agglomerans在自举值98%水平聚类于同一分支(图3),最终确定烟草细菌性病害病原菌为泛菌属的成团泛菌(P. agglomerans)。
2.4 病原菌室内药剂筛选
通过室内药剂筛选发现(表3),37.0%苯醚甲环唑WP、1.6%噻霉酮EW、3.0%中生菌素WP、80.0%乙蒜素EC这4种杀菌剂对病原菌均有抑制作用,其他11种药剂均无抑菌效果。有抑菌作用的4种不同杀菌剂之间EC50相差较大,其中防治效果最好的是1.6%噻霉酮EW,EC50为0.004 mg/mL,其次为3.0%中生菌素WP、80.0%乙蒜素EC,EC50分别为0.013 5 mg/mL、0.117 6 mg/mL,37.0%苯醚甲環唑WP抑菌效果较差,EC50为27.160 0 mg/mL。
3 讨 论
本试验明确了发生于贵州省六盘水市的细菌性病害病原为成团泛菌(Pantoea agglomerans),属于肠杆菌目肠杆菌科泛菌属(Pantoea)[16]。成团泛菌是泛菌属(Pantoea)的模式菌,一般与植物相关,可腐生、内生或作为病原体,存在于植物、动物以及水、土壤中[17]。国内外报道P. agglomerans可侵染多种植物,如玉米(Zea mays)[18]、杨树(Populus L.)[19]、核桃(Juglans regia)[20]、棉花(Gossypium spp)[21]、大白菜(Brassica rapapekinensis)[22]、水稻(Oryza sativa L.)[23]等,可见P. agglomerans的寄主范围广泛,因此在P. agglomerans引起的烟草细菌性叶枯病发生田间不适宜与以上作物轮作。
在防治药剂筛选中,严婉荣等[24]对火龙果细菌性腐烂病菌(P. agglomerans)筛选出53.8%氢氧化铜WG、47%春雷·王酮WP、72%农用链霉素SP、2%春雷霉素AS4种防治药剂,并进行田间药效试验,53.8%氢氧化铜WG 1000倍液处理的防效能达到70%以上;郭安柱等[25]对核桃黑斑病菌(P. agglomerans)筛选出4种防治药剂并进行田间药效试验,防效均达到70%以上,表明中生菌素、噻霉酮、氟啶胺和春雷霉素等药剂对P. agglomerans引起的植物病害具有良好的防控效果。本试验中烟草细菌性叶枯病的田间防控即参考以上药剂。此外,试验通过测定15种杀菌剂对P. agglomerans的毒力,发现37%苯醚甲环唑WP、1.6%噻霉酮EW、3%中生菌素WP、80%乙蒜素EC对该菌均表现出抑制作用,但并未进行田间药效试验,需进一步验证。
试验组在前期的田间调查发现,该烟草细菌性叶枯病在六盘水烟区的发生时间集中在7月中旬至8月上旬,该时段多为高温,降水量较大的时期,表明高温高湿条件可能有利于该病害的发生。
4 结 论
本试验通过分离与鉴定,明确了引起六盘水市烟草细菌性叶枯病的病原为成团泛菌(Pantoea agglomerans),该病原菌引起烟草叶部病害系首次报道。室内毒力测定结果表明,1.6%噻霉酮EW、3.0%中生菌素WP和80.0%乙蒜素EC对该病原菌具有较好的抑菌作用。
参考文献
[1]陈丽鹃,周冀衡,李强,等. 镉对烟草的毒害及烟草抗镉机理研究进展[J]. 中国烟草科学,2014,35(6):93-97.
CHEN L J, ZHOU J H, LI Q, et al. Advance in cadmium toxicity to tobacco and its resistance mechanism[J]. Chinese Tobacco Science, 2014, 35(6): 93-97.
[2]任民,王志德,牟建民,等. 我国烟草种质资源的种类与分布概况[J]. 中国烟草科学,2009,30(S1):8-14.
REN M, WANG Z D, MOU J M, et al. Overview of species and distribution of tobacco germplasm resources in China[J]. Chinese Tobacco Science, 2009, 30(S1): 8-14.
[3]陈瑞泰,朱贤朝,王智发,等. 全国16个主产烟省(区)烟草侵染性病害调研报告[J]. 中国烟草科学,1997,l(4):1-7.
CHEN R T, ZHU X C, WANG Z F, et al. A survey report on tobacco Infection and venereal diseases in 16 major tobacco producing provinces (regions)[J]. Chinese Tobacco Science, 1997, 1(4): 1-7.
[4]田华,朱艳梅,董瑜,等. 毁灭炭疽菌Colletotrichum destructivum诱抗蛋白对烟草抗病性的诱导[J]. 植物保护学报,2017,44(1):67-74.
TIAN H, ZHU Y M, DONG Y, et al. Induced resistance of tobacco by the protein elicitor of colletotrichum destructivum[J]. Journal of Plant Protection, 2017, 44(1): 67-74.
[5]朱承广,任民,蒋彩虹,等. 以关联分析发掘烟草抗赤星病基因分子标记[J]. 中国烟草科学,2017,38(1):68-72.
ZHU C G, REN M, JIANG C H, et al. Identification of molecular markers for tobacco brown spot resistant genes through association analysis[J]. Chinese Tobacco Science, 2017, 38(1): 68-72.
[6]焦蓉,何鹏飞,王戈,等. 内生菌YN201728的定殖能力及其防治烟草白粉病的效果研究[J]. 核农学报,2020,34(4):721-728.
JIAO R, HE P F, WANG G, et al. Colonization and control effect on tobacco powdery mildew of endophyte YN201728[J]. Journal of Nuclear Agriculture, 2020, 34(4): 721-728.
[7]魏代福,譚青涛,张广民. 防治烟草野火病的药剂测定与筛选[J]. 中国烟草科学,2010,31(2):42-44.
WEI D F, TANG Q T, ZHANG G M. Determination and selection of pesticides against tobacco wildfire disease (Pseudomonas syringae pv.tabaci)[J]. Chinese Tobacco Science, 2010, 31(2): 42-44.
[8]孙剑萍,文景芝,孙宏伟,等. 黑龙江省烟草角斑病菌菌系分化研究[J]. 中国烟草科学,2014,35(3):46-49.
SUN J P, WEN J Z, SUN H W, et al. Physiological races of genetic differentiation of tobacco angle spot pathogenic bacteria in Heilongjiang province[J]. Chinese Tobacco Science, 2014, 35(3): 46-49.
[9]段燕平,梁梅,秦西云. 云南保山烟草青枯病的病原鉴定及发生规律[J]. 中国烟草科学,2008,29(5):48-51.
DUAN Y P, LIANG M, QIN X Y. Pathogen identification of Ralstonia solanacearum E. F Smith on tobacco and its occurrence in Baoshan[J]. Chinese Tobacco Science, 2008, 29(5): 48-51.
[10]董鹏,朱三荣,蔡海林,等. 湖南烟草病毒病种类检测与系统进化分析[J]. 中国烟草科学,2020,41(3):58-64.
DONG P, ZHU S R, CAI H L, et al. Detection and phylogenetic analysis of tobacco viruses in Hunan province[J]. Chinese Tobacco Science, 2020, 41(3): 58-64.
[11]方振东. 植物病理学研究方法[M]. 3卷. 北京:中国农业出版社,1998:165-211.
FANG Z D. Plant pathology research methods[M]. 3rd Ed. Beijing: China Agriculture Press, 1998: 165-211.
[12]胡春辉,徐青,孙璇,等. 几种典型扫描电镜生物样本制备[J]. 湖北农业科学,2016,55(20):5389-5392,5402.
HU C H, XU Q, SUN X, et al. Several biological typical samples preparation methods of scanning electron microscope[J]. Hubei Agricultural Science, 2016, 55(20): 5389-5392, 5402.
[13]R.E.布坎南,N.E.吉本斯. 伯杰細菌鉴定手册[M]. 第八版. 北京:科学出版社,1984.
[14]SCHAAD N W,张克勤. 植物病原细菌鉴定实验指南[M]. 贵州:贵州人民出版社,1986.
SCHAAD N W, ZHANG K Q. Experimental guidelines for identification of plant pathogenic bacteria[M]. Guizhou: Guizhou People Press, 1986.
[15]谭才邓,朱美娟,杜淑霞,等. 抑菌试验中抑菌圈法的比较研究[J]. 食品工业,2016(11):122-125.
TAN C D, ZHUM J, DU S X, et al. Comparative study of bacteriostatic circle method in bacteriostatic test[J]. Food Industry, 2016(11): 122-125.
[16]彭炜. 植物细菌性病害和病原细菌分类研究进展[C]//中国植物保护学会. 公共植保与绿色防控. 北京:中国农业科学技术出版社,2010:166-175.
PENG W. Research progress on classification of plant bacterial diseases and pathogenic bacteria[C]//China Society of Plant Protection. Public Plant Protection and Green Prevention and Control. Beijing: China Agricultural Science and Technology Press, 2010: 166-175.
[17]赵耘霄. 危害核桃的成团泛菌及其系统进化分析[D]. 泰安:山东农业大学,2016.
ZHAO Y X. Identification and phylogenetic analysis of walnut-associated Pantoea agglomerans[D]. Tai'an: Shandong Agricultural University, 2016.
[18]曹慧英. 玉米新病害—细菌干茎腐病的研究[D]. 北京:中国农业科学院,2010.
CAO H Y. Bacterial dry stalk rot in maize, a new disease[D]. Beijing: Chinese Academy of Agricultural Sciences, 2010.
[19]保善存,夏吾拉太,殷光晶,等. 杨树枝干病害病原物分离与鉴定[J/OL]. 分子植物育种:1-11[2020-07-23]. http://kns.cnki.net/ kcms/detail/46.1068.S.20200720.0955.004.html.
BAO S C, XIA L T, YIN G J, et al. Isolation and identification of pathogens of poplar stem diseases[J/OL]. Molecular Plant Breeding: 1-11[2020-07-23]. http://kns.cnki.net/kcms/detail/46.1068.S. 20200720.0955.004.html.
[20]李君,韩颖,赵宁,等. 云南31个核桃品种对黑斑病的抗病性评价[J]. 中国植保导刊,2020,40(1):67-71.
LI J, HAN Y, ZHAO N, et al. Resistance evaluation of 31 walnut cultivars against bacterial black spot disease in Yunnan province[J]. China Plant Protection Guide, 2020, 40(1): 67-71.
[21]刘雅琴,杨丽,李国英,等. 成团泛菌引起的棉花烂铃病对棉花产量因子和品质的影响[J]. 植物保护,2008(5):103-106.
LIU Y Q, YANG L, LI G Y, et al. Effects of cotton boll rot caused by Pantoea agglomerans on cotton traits and yield[J]. Plant Protection, 2008(5): 103-106.
[22]郭萌. 大白菜软腐病新病原菌Pantoea agglomerans鉴定及抗性鉴定方法[D]. 哈尔滨:东北农业大学,2019.
GUO M. Identification of new pathogens of chinese cabbage soft rot and resistant identification method[D]. Harbin: Northeast Agricultural University, 2019.
[23]洪永聪,胡方平,黄晓南. 成团泛菌(Pantoea agglomerans)对稻谷的致病性[J]. 福建农林大学学报(自然科学版),2002(1):32-36.
HONG Y C, HU F P, HUANG X N. Pathogenicity of Pantoea agglomerans on rice seeds[J]. Journal of Fujian Agriculture and Forestry University (Natural Science edition), 2002(1): 32-36.
[24]严婉荣,肖敏,肖彤斌,等. 海南火龙果细菌性腐烂病的病原鉴定及田间药剂筛选[J]. 基因组学与应用生物学,2020,39(3):1185-1190.
YAN W R, XIAO M, XIAO T B, et al. Pathogen identification and screening of field agents on dragon fruit bacterial rot disease in Hainan[J]. Genomics and Applied Biology, 2020, 39(3): 1185-1190.
[25]郭安柱,張力元,李岩,等. 防治核桃黑斑病药剂筛选及田间药效试验[J]. 西北林学院学报,2020,35(1):177-182.
GUO A Z, ZHANG L Y, LI Y, et al. Selection and field application of effective bactericides against walnut blight[J]. Journal of Northwest Forestry University, 2020, 35(1): 177-182.
