烟草根黑腐病根际拮抗菌的筛选、鉴定及其促生防病效果
2021-08-09罗云艳安航何佶弦杨洋江连强闫芳芳徐传涛安德荣李斌
罗云艳 安航 何佶弦 杨洋 江连强 闫芳芳 徐传涛 安德荣 李斌


摘 要:為挖掘对烟草根黑腐病菌有较高拮抗效果的根际促生菌资源,从四川广元和陕西汉中等地采集30份烟草根际土壤,以烟草根黑腐病菌为靶标,采用温度筛选法和平板对峙法分离筛选出有高效拮抗活性的菌株,并对该菌株进行系统发育分析,采用抗生素标记法和温室盆栽法测定菌株LY79的定殖规律、对烟草的促生效果以及对烟草根黑腐病的防治效果。结果表明:(1)从烟草根际土壤分离到一株烟草根黑腐病高效拮抗菌株LY79,经形态学、生理生化鉴定结合16S rRNA和持家基因ropB分析将菌株LY79鉴定为解淀粉芽孢杆菌(Bacillus amyloliquefaciens)。(2)抗生素标记菌株LY79A在烟草根际土定殖规律为先下降后上升再下降最终趋于稳定,且施药40 d后仍能在烟草根际土、根系、茎、叶分离到1.34×106、2.91×104、1.81×104、1.01×104 CFU/g的菌株LY79A,说明其定殖能力较强。(3)菌株LY79对烟草促生效果较好,处理60 d后,烟草的株高、茎粗、整株干质量、根干质量分别增加了34.68%、37.85%、103.79%、72.55%。(4)1×109 CFU/mL浓度的菌株LY79发酵液对烟草根黑腐病的盆栽防效达71.54%,仅略低于对照药剂70%甲基托布津500倍液。解淀粉芽孢杆菌LY79在烟草根黑腐病防治中具有较大的应用潜力。
关键词:烟草根黑腐病;根际促生菌;定殖;促生;防效
Abstract: In order to explore the plant growth promoting rhizobacteria (PGPR) resources with high antagonistic effect against tobacco root black rot, 30 tobacco rhizosphere soil samples were collected from Hanzhong and Guangyuan. The strains with high antagonistic activities against Thielaviopsis basicola were isolated and screened by temperature screening and the plate face-off method, and the strains were identified by phylogenetic analysis. The colonization ability of tobacco rhizosphere, the growth-promoting effect and the control effect of tobacco root black rot were determined by using the flat plate method, the antibiotic labeling method, and the greenhouse pot culture method, respectively. (1) Strain LY79, an antagonistic strain of tobacco root black rot, was isolated from tobacco rhizosphere soil and identified as Bacillus amyloliquefaciens by combining morphology, physiology and biochemistry with 16S rRNA and rpoB gene sequences. (2) The colonization of tobacco rhizosphere soil by LY79A was decreased first, then increased, then decreased and finally tended to be stable, and 1.34×106, 2.91×104, 1.81×104, 1.01×104 CFU/g LY79A strain could still be isolated from tobacco rhizomes, root, stem and leaf tissues after 40 days, This indicates that LY79A has strong colonization ability. (3) LY79 had an obvious effect on the growth of tobacco. Plant height, stem diameter, dry weight and root dry weight were increased by 34.68%,37.85%, 103.79% and 72.55%, respectively. (4) LY79 with a concentration of 1×109 CFU/mL had a control effect of 71.54% on the root black rot of tobacco in the pot experiment, slightly lower than the control effect of 500 X Metobuzin (70%). In summary, Bacillus amyloliquefaciens LY79 had great potential in the control of tobacco root black rot.
Keywords: Thielaviopsis basicola; PGPR; colonization; grows; control effect
由基生根串珠霉菌(Thielaviopsis basicola)引起的烟草根黑腐病是危害严重的土传真菌病害,烟草苗期至成株期均可受害,直接影响烟叶的产量和品质[1]。化学药剂的长期高剂量使用容易导致“3R”问题,因此,绿色、无残留、无公害的生物防治日益受到重视[2]。已经发现多种防治烟草根黑腐病的生防菌,易龙等[3]从烟草根际土壤中分离并筛选出枯草芽孢菌株R27,并证明该菌株能够抑制烟草根黑腐病菌菌丝的生长,抑制病菌孢子萌发,温室盆栽防效达80.2%;易龙等[4]还发现棘孢木霉TB72对烟草根黑腐病的防效达84.5%;陈小均等[5]的研究表明,木霉菌T150对烟草根腐病和黑胫病均有一定的防控作用,平均防效在76%以上。
植物根际促生菌(PGPR)可对植物产生有益作用,包括促生效应、诱导抗性及拮抗病原菌等[6-7],其机理复杂多样,这些作用机制之间互相协调、互为补充,实现对植物病害的防御,具有非常大的应用潜力。利用PGPR既能控制病原菌,又能促进植物生长,符合农业可持续发展的要求[8-9]。芽孢杆菌作为PGPR的一员,其产生的芽孢对高温、紫外线、电磁辐射和某些化学药品有很强抗逆性,具有独特的生防优势[10-13]。目前可应用的高效生防菌株资源明显匮乏,且防治效果不稳定。本文从烟草根际土壤分离出一株高效拮抗烟草根黑腐病的芽孢杆菌,并对其进行了形态学、生理生化和分子生物学鉴定。通过探索其烟草根际定殖规律、促生效果以及对烟草根黑腐病的防治效果,进一步丰富烟草根黑腐病根际促生菌菌种资源,同时为菌株的田间开发应用提供理论依据。
1 材料与方法
1.1 材料
试验土壤样品分别采自陕西省汉中市南郑县新集镇烟区、宁强县二郎坝镇烟区、四川省广元市剑阁县普安镇烟区。供试烟草品种K326由陕西省烟草研究所提供。烟草根黑腐病菌(Thielaviopsis basicola)、烟草赤星病菌(Alternaria alternata)、马铃薯早疫病菌(Alternaria solani.sorauer)、苹果炭疽病菌(Colletotrichum gloeosporioides)、苹果腐烂病菌(Valsa ceratosperma)、西瓜炭疽病菌(Colletotrichum lagenarium)、棉花枯萎病菌(Fusarium oxysporum)、玉米大斑病菌(Exserohilum turcicum)、梨黑斑病菌(Alternaria kikuchiana)均由西北农林科技大学资源微生物与植物病毒实验室保存和提供。培养基:LB和PDA,配制参考沈萍等[14]的方法。
1.2 方法
1.2.1 根际拮抗菌的分离 分别于2019年6—9月从各烟草主栽区的发病田中采集健康烟草植株根际土壤,共计采集30份土样。采用温度筛选法(60 ℃恒温水浴30 min)和平板稀释涂布法,分离菌株,纯化后4 ℃冰箱保存[15]。
1.2.2 根际拮抗菌的筛选 拮抗菌的初篩采用平板对峙法[16],用接种环蘸取拮抗菌点接于距供试病原菌相等距离的十字交叉线的四端,以单独接种病原菌为对照,28 ℃恒温培养,3次重复。根据抑菌带宽度确定拮抗程度,选取拮抗效果好的菌株。拮抗菌的复筛参考周德庆[17]的方法,测量拮抗菌无菌滤液对烟草根黑腐病菌的相对抑制率。相对抑制率(%)=(对照菌落直径-处理菌落直径)/(对照菌落直径-5)×100。
1.2.3 菌株LY79抑菌谱的测定 采用平板对峙法,利用本实验室保存的病原菌测定拮抗菌的抑菌广谱性。
1.2.4 菌株LY79的鉴定 形态和生理生化鉴定:菌株LY79的菌体形态观察、生理生化测定参照《芽孢杆菌属》[18]和《常见细菌系统鉴定手册》[19]中介绍的芽孢杆菌生理生化试验进行。分子鉴定:用细菌16S rRNA基因通用引物27F(5?-GTTTGATCMT GGCTCAG-3?)和1492R(5?-TACGGYTACCTTG TTACGACTT-3?)扩增菌株LY79的16S rRNA基因序列,用细菌rpoB基因通用引物rpoB-F(ATCGAAACGCCTGAAGGTCCAAACT)和rpoB-R(ACACCCTTGTTACCGTGACGACC)扩增菌株LY79的rpoB持家基因,送往上海生工测序[20]。测得16S rRNA基因序列通过数据库Ezbiocloud与已知模式菌株进行比较[21],rpoB基因序列在NCBI中经BLAST比对后进行同源性比较,均使用MEGA 7.0软件的最大似然法(Maximum Likelihood Method)构建该菌株的系统发育树,并进行1000次Bootstraps检测。
1.2.5 菌株LY79对烟草的促生作用 烟草种子(K326)50 ℃温汤浸种30 min后播种于土壤中(V基质:V灭菌土壤=1:1),于防虫温室中25 ℃培养,光周期L:D=12 h:12 h。挑选6~8叶期的烟草,每株灌根1×108 CFU/mL菌株LY79发酵液15 mL,每处理30株,3次重复。共施药3次,每次间隔5 d,LB液体培养基为对照。60 d后,测量烟草株高、茎粗、鲜质量、干质量[22-23]。
1.2.6 菌株LY79定殖规律检测 利用抗生素标记法[24]标记菌株LY79,以5、20、40、60、80、100、150、200和300 μg/mL等不同浓度利福平对菌株LY79在LB培养基上逐级诱导,筛选出抗利福平浓度达300 μg/mL的菌株LY79A,经稳定性和活性检测后保存、备用,未标记菌株不能在含300 μg/mL利福平平板上生长。挑选6~8叶期的烟草,标记菌株LY79A发酵液(1×108 CFU/mL)灌根,每盆灌根10 mL,分3次处理,每次间隔3 d。于灌根处理结束后第1、3、5、7、10、15、20、30、40 天分离烟草根际土壤、根系、茎、叶的菌株LY79A[15]。烟草根际土壤LY79A的分离:将根际土壤菌悬液梯度稀释后涂布于含有300 μg/mL利福平的LB平板。烟草植株LY79A的分离:将烟草根系、茎、叶片研磨后稀释涂布,3次重复,计算含菌量(CFU/g)。
1.2.7 菌株LY79对烟草根黑腐病的防治效果 盆栽防治效果检测做3个处理:(1)1×107、1×108、1×109 CFU/mL浓度的菌株LY79发酵液;(2)70%甲基托布津1500、1000、500倍液;(3)LB液体培养基作对照。采取灌根法,每株处理15 mL,每处理50株,3次重复,共施药2次,间隔5 d。处理结束7 d后,接种1×109 CFU/mL浓度的烟草根黑腐病菌孢子悬浮液。记录发病情况,计算发病率[25-26],按烟草行业标准YC/T39—1996[27]进行病害调查和严重度分级,计算病情指数和防治效果。
1.3 数据分析
本试验采用统计分析软件SPSS 22和Excel进行数据处理和分析。
2 结 果
2.1 根际拮抗菌的分离、筛选
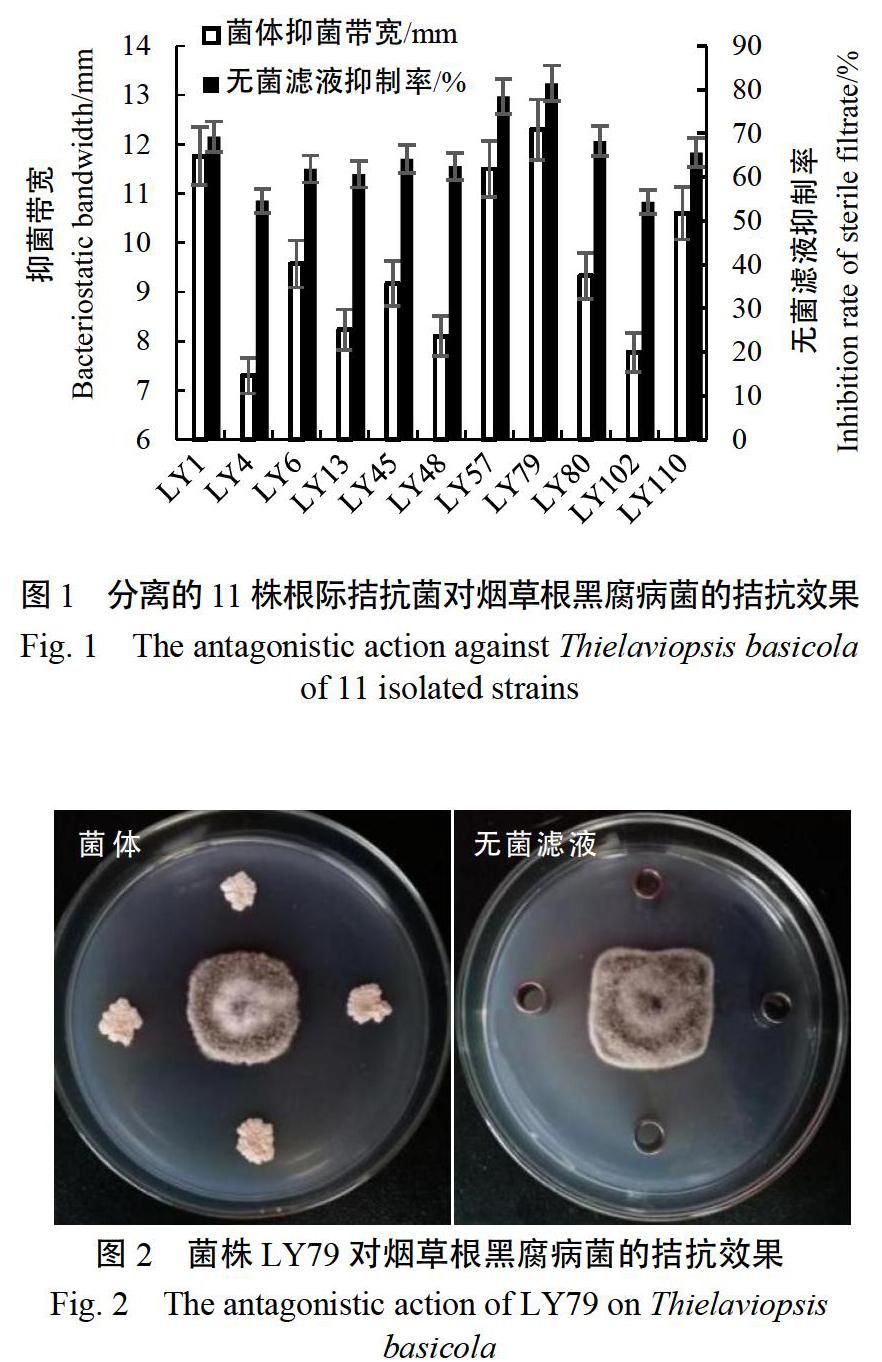
经稀释涂布平板法和温度筛选法,从30份烟草根际土样中,共计分离到127株不同的菌株。以烟草根黑腐病菌为靶标,经平板对峙法进行初筛和复筛,筛选到11株对烟草根黑腐病菌有较强拮抗活性的菌株,其中菌株LY79对烟草根黑腐病菌拮抗效果最好,平均抑菌带宽为12.30 mm(图1),无菌滤液对烟草根黑腐病菌的相对抑制率为81.46%(图1-2)。光学显微镜观察发现菌株LY79能够使烟草根黑腐病菌菌丝分枝增多、膨大变粗、扭曲畸形,对照菌丝生长均匀,并无畸形膨大现象(图3)。
2.2 菌株LY79抑菌谱测定
利用实验室保存的多种病原菌检测菌株LY79的抑菌谱。试验发现菌株LY79对梨黑斑病菌、马铃薯早疫病菌、棉花枯萎病菌、苹果腐烂病菌、苹果炭疽病菌、西瓜炭疽病菌、烟草赤星病菌和玉米大斑病菌的抑菌带宽分别为11.25±0.05、10.67±0.12、9.83±0.16、9.52±0.23、12.35±0.26、5.64±0.13、8.82±0.07、10.79±0.06 mm,具有抑菌广谱性(图4)。
2.3 菌株LY79的鉴定结果
2.3.1 形态观察及生理生化测定 菌株LY79在LB培养基上培养24 h,菌落呈无色透明液滴,有光泽,48 h的菌落表面光滑质地粘稠,呈乳白色圆形。革兰氏染色阳性,菌体呈杆状,芽孢椭圆形。扫描电镜下,菌株LY79呈短杆状、两端钝圆(图5)。
生理生化测定结果显示,菌株LY79可以利用葡萄糖、蔗糖、果糖等作为营养物质,甲基红试验为阳性,能产生菌膜。菌株在4 ℃、50 ℃、pH 4.0、pH 9.0、13% NaCl下仍能生长,说明菌株LY79对温度、酸碱度、盐浓度的稳定性较好(表1)。形態学和生理生化结果表明菌株LY79符合芽孢杆菌属的基本特征。
2.3.2 分子鉴定 利用通用引物,分别扩增菌株LY79的16S rRNA和持家基因rpoB序列,获得1442 bp和1182 bp的基因片段。同源性比对后采用MEGA7.0软件的最大似然法建系统发育树,在16S rRNA系统发育树中,菌株LY79与Bacillus amyloliquefaciens和Bacillus siamensis在同一分支(图6),继续对其持家基因rpoB序列建树后发现,菌株LY79与Bacillus amyloliquefaciens在同一分支,且支持率达100%(图7)。因此,结合形态特征、生理生化特征和系统发育分析将菌株LY79鉴定为解淀粉芽孢杆菌(Bacillus amyloliquefaciens)。
2.4 菌株LY79对烟草的促生效果
通过盆栽试验检测1×108 CFU/mL菌株LY79发酵液对烟草的促生效果,处理60 d后,烟草叶片宽厚、浓绿,根系发达,与对照相比,处理组烟草株高增加了34.68%,茎粗增加了37.85%,整株干质量增加了103.79%,根干质量增加了72.55%,说明菌株LY79对烟草的促生效果较好(图8、表2)。
2.5 菌株LY79在烟草体内的定殖规律检测
将1×108 CFU/mL标记菌株LY79A发酵液对烟草进行灌根处理,发现菌株LY79A在烟草根际的定殖量先迅速下降后少量上升再缓慢下降,最终趋于稳定,接种第40天的定殖量为1.34×106 CFU/g。菌株LY79A在烟草根系、茎和叶的定殖量呈先上升后下降,最终趋于稳定的趋势,至第40天的定殖量分别为2.91×104、1.81×104、1.01×104 CFU/g。从定殖数量上看,菌株LY79A易在烟草根际和根系定殖,茎和叶片次之(图9)。
2.6 菌株LY79对烟草根黑腐病的盆栽防治效果
采用灌根的方法检测菌株LY79对烟草根黑腐病的盆栽防治效果(表3),与对照相比,菌株LY79和70%甲基托布津处理烟草后,发病率和发病程度均显著降低。1×109 CFU/mL浓度的LY79发酵液对烟草根黑腐病防治效果达71.54%,且发病率为16.67%。500倍液70%甲基托布津对烟草根黑腐病防治效果达78.5%,略高于菌株LY79发酵液,但差异并不大,说明菌株LY79对烟草根黑腐病具有显著的防治效果。
3 讨 论
解淀粉芽孢杆菌(Bacillus amyloliquefaciens)作为植物根际促生菌,能分泌多种抗菌蛋白、β-1, 3-葡聚糖酶及伊枯草菌素A( iturin),对多种植物的促生作用和多种病原菌的抑制作用已有报道[28-29]。生防菌株能在寄主植物中稳定定殖是其发挥促生防病作用的重要前提,了解菌株的定殖特性,可以最大程度地发挥菌株的促生防病效果,实现生防菌的合理利用。同时,将防病作用与促生作用相结合,更能达到理想的效果[6]。
本试验从陕西汉中和四川广元烟草主栽区发病田中采集健康烟草根际土壤,从中分离、筛选到烟草根黑腐病菌的高效拮抗芽孢杆菌LY79,通过形态学、生理生化特征、16S rRNA和rpoB基因将其鉴定为解淀粉芽孢杆菌,因采用根际土壤,筛选出的拮抗菌对烟田土壤环境和烟草具有更强的适应性,有利于其在烟草上定殖并发挥其促生、防病效果。
李苗苗等[30]筛选出一株解淀粉芽孢杆菌GY10能够在烟草根际良好定殖,根际定殖量呈缓慢下降的趋势,15~30 d 趋于平稳,且多菌株复配相对于单一菌株在根际定殖更具优势。本试验中,菌株LY79在烟草根际土壤中呈先下降后上升再下降最后趋于稳定的趋势,这和李苗苗的研究略有差异,但是总体趋势是一样的,原因可能是本试验施用生防菌的量较多,增加了生防菌之间的种内竞争。另外,申莉莉等[31]观察到解淀粉芽孢杆菌Ba33发酵液灌根处理的烟苗鲜质量、最大叶长和叶宽均高于清水对照处理,叶色浓绿,长势良好。黄智华等[32]也从云南烟区烤烟根际土中筛选的解淀粉芽孢杆菌具有解磷、解钾或IAA促生功能。本试验测定了菌株LY79对烟草的促生效果,烟草整株干质量和根干质量分别增加了103.79%和72.55%,说明菌株LY79促进了烟草有机物积累以及根系生长,尤其是侧根明显增多。最后,比较了不同浓度梯度的菌株LY79和烟草根黑腐病常用农药70%甲基托布津的防治效果,结果显示菌株LY79对烟草根黑腐病的防效达71.54%,略低于70%甲基托布津,但较LB培养基对照防效明显。这与宋玉娟等[33]研究的棘孢木霉T-6对烟草根黑腐病的防治效果达75.14%相近。综上,虽然菌株LY79的防效略低于70%甲基托布津,但生物农药尤其是芽孢杆菌制剂较化学农药优势明显,在田间应用中,若发病严重,考虑使用菌株LY79与农药配合防治,以实现优势互补,减少化学农药使用,减少农药残留,推进农业可持续发展。
4 结 论
本试验分离到一株对烟草根黑腐病菌有较高拮抗活性的解淀粉芽孢杆菌LY79,具有抑菌谱广,耐高低温、耐酸碱、耐盐等特性。而且菌株LY79能较快在烟草根际定殖并维持稳定的数量,对烟草的促生作用明显。室内盆栽试验证明,菌株LY79对烟草根黑腐病菌的防治效果也较好。结果为菌株LY79在大田应用和烟草根黑腐的绿色防控提供了优质资源。
参考文献
[1]边传红,丁玥琪,赵世民,等. 河南省烟草根黑腐病菌的分子鉴定及致病性分析[J]. 烟草科技,2017,50(3):8-14.
BIAN C H, DING Y Q, ZHAO S M, et al. Molecular identification and pathogenicity analysis of Thielaviopsis basicola in Henan Province[J]. Tobacco Science & Technology, 2017, 50(3): 8-14.
[2]赵文军,杨继周,冯瑜,等. 烟草根黑腐病防治研究进展[J]. 湖南农业科学,2015(1):150-152.
ZHAO W J, YANG J Z, FENG Y, et al. Research progress in tobacco black root rot control[J]. Hunan Agricultual Sciences, 2015(1): 150-152.
[3]易龍,肖崇刚,马冠华. 防治烟草根黑腐病拮抗芽孢菌株的筛选[J]. 植物病理学报,2011,41(3):333-336.
YI L, XIAO C G, MA G H. Screening of antagonistic Bacillus strain against black rot of tobacco root[J]. Acta Phytopathologica Sinica, 2011, 41(3): 333-336.
[4]易龙,肖崇刚. 烟草根黑腐病拮抗木霉菌株TB72的鉴定及抑菌作用[J]. 西南农业学报,2016,29(8):1889-1893.
YI L, XIAO C G. Identification and inhibition effect of Antagonistic Trichoderma strain TB72 against Thielaviopsis basicola[J]. Southwest China Joumal of Agriculural Sciences, 2016, 29(8): 1889-1893.
[5]陈小均,何海永,喻会平,等. 木霉生防菌T150对烟草主要土传真菌病害的防治效果[J]. 贵州农业科学,2011,39(12):129-132.
CHEN X J, HE H Y, YU H P, et al. Control effect of Trichoderma T150 on main soil fungal diseases of tobacco[J]. Guizhou Agricultual Sciences, 2011, 39(12): 129-132.
[6]胡江春,薛德林,马成新,等. 植物根际促生菌(PGPR)的研究与应用前景[J]. 应用生态学报,2004,15(10):1963-1966.
HU J C, XUE D L, MA C X, et al. Research and application prospect of plant rhizosphere probiotics (PGPR)[J]. Chinese Journal of Applied Ecology, 2004, 15(10): 1963-1966.
[7]于文清,丁洪胜,闫凤超,等. 植物根际促生菌促生及御病研究进展[J]. 现代化农业,2020(8):53-56.
YU W Q, DING H S, YAN F C, et al. Research progress in promoting growth and controlling diseases of rhizosphere probiotics[J]. Modern Agriculture, 2020(8): 53-56.
[8]刘延荣,张修国,土智发,等. 烟草根黑腐病菌生物学特性的研究[J]. 中国烟草学报,1993(2):1-7.
LIU Y R, ZHANG X G, TU Z F, et al. Study on biological characteristics of black rot of tobacco root[J]. Chinese Journal of Tobacco, 1993 (2): 1-7.
[9]KAMAEI R, FARAMARZI F, PARSA M, et al. The effects of biological chemical and organic fertilizers application on root growth features and grain yield of Sorghum[J]. Journal of Plant Nutrition, 2019, 42(18): 2221-2233.
[10]MARTINET A, MARTINET P M, et al. Isolation and molecular characterization of an strain of Bacillus with antifungal activity from the sorghum rhizosphere[J]. Genet MolRes, 2012, 11(3): 2665-2673.
[11]MUNIMBAZI, BULLERM. Isolation and partial characterization of antifungal metabolites of Bacillus pumilus[J]. Journal of Applied Microbiology, 1998, 84(6): 959-968.
[12]刘波,陶天申,王阶平,等. 芽胞杆菌第三卷:芽胞杆菌生物学[M]. 北京:科学出版社,2016.
LIU B, TAO T S, WANG J P, et al. Bacillus Section 3: Biology of Bacillus[M]. Beijing: Science Press, 2016.
[13]SUMPAVAPOL P, TONGYONK L, TANASUPAWAT S, et al. Bacillus siamensis sp. nov. isolated from salted crab (poo-khem) in Thailand[J]. International Journal of Systematic & Evolutionary Microbiology, 2010, 60(10): 2364-2370.
[14]沈萍,陈向东. 微生物学实验[M]. 4版. 北京:高等教育出版社,2007.
SHEN P, CHEN X D. Microbiology experiments[M]. 4th. Beijing: Higher Education Press, 2007.
[15]顾金刚. 烟草根际促生细菌的分离、筛选及防治黑胫病研究[D]. 北京:中国农业科学院,2000.
GU J G. Antagonistic Tobacco growth-promoting rhizobacteria against black shank[D]. Beijing: Chinese Academy of Agricultural Sciences, 2000.
[16]方中达. 植病研究方法[M]. 3版. 北京:中国农业出版社,1998:46-47.
FANG Z D. Methods of plant disease research[M]. 3rd Ed. Beijing: China Agricultural Press. 1998: 46-47.
[17]周德慶,徐德强. 微生物学实验教程[M]. 3版. 北京:高等教育出版社,2013.
ZHOU D Q, XU D Q. Microbiology experiment course[M]. 3th. Beijing: Higher Education Press, 2013.
[18]蔡妙英,刘聿太,战立克,等. 芽孢杆菌属[M]. 北京:中国农业出版社,1983:4-16.
CAI M Y, LIU Y T, ZHAN L K, et al. Bacillus[M]. Beijing: China Agricultural Press, 1983: 4-16.
[19]蔡妙英,东秀珠,等. 常见细菌系统鉴定手册[M]. 北京:科学出版社. 2001:371-390.
CAI M Y, DONG X Z, et al. Handbook of systematic identification of common bacteria[M]. Beijing: Science Press, 2001: 371-390.
[20]DUANGMAL K. Systematics and comparative genomics of members of Streptomyces violaceoruber 16S rRNA gene clade[D]. New South Wales: University of Newcastle upon Tyne, 2004.
[21]YOON S H, HA S M, KWON S, et al. Introducing EzBioCloud: A taxonomically united database of 16S rRNA and whole genome assemblies[J]. International Journal of Systematic and Evolutionary Microbiology, 2017, 67(5): 1613-1617.
[22]朱贤朝,土彦亭,土智发. 中国烟草病害[M]. 北京:中国农业出社,2001:36-451.
ZHU X Z, TU Y T, TU Z F. Tobacco disease in China [M]. Beijing: China Agricultural Press, 2001: 36-451.
[23]李想,刘艳霞,夏范讲,等. 烟草根际促生菌(PGPR)的筛选、鉴定及促生机理研究[J]. 中国烟草学报,2017,23(3):111-118.
LI X, LIU Y X, XIA F J, et al. Screening and identification of rhizosphere probiotics (PGPR) in tobacco[J]. Chinese Journal of Tobacco, 2017, 23(3): 111-118.
[24]CHEN C, BAUSKE M, MUSSON G, et al. Biological control of Fusarium wilt on cotton by use of endophytic bacteria[J]. Biological control, 1995, 5: 83-91.
[25]赵永强. 烟草根黑腐病菌的分子检测与室内药剂筛选[D]. 泰安:山东农业大学,2009.
ZHAO Y Q. Molecular detection and laboratory screening of tobacco root black rot[D]. Taian: Shandong Agricultural University, 2009.
[26]陈年春. 农药生物测定技术[M]. 北京:北京农业大学出版社,1991:95-112.
CHEN N C. Bioassay of pesticides[M]. Beijing: Beijing Agricultural University Press, 1991: 95-112.
[27]全国烟草标准化技术委员会. 烟草病害分级及调查方法:YC/T 39—1996[S]. 北京:中国标准出版社. 1996.
National Standardization Technical Committee of Tobacco. Grade and investingating method of tobacco disease: YC/T 39-1996[S]. Beijing: China Standards Press, 1996.
[28]KIM P I, CHUNG K C. Production of an antifungal protein for control of colletotrichum lagenarium by Bacillus amyloliquefaciens[ J]. FEMS Microbiol Lett, 2004, 234: 177-183.
[29]YOSHIDA A, HIRADATE S, TSUKAMOTO T, et al. Antimicrobial activity of culture filtrate of Bacillus amyloliquefaciens RC-2 isolated from mulberry leaves[J]. Phytopathology, 2001, 91: 181-187.
[30]李苗苗,张家韬,崔传斌,等. 三株芽孢杆菌的生防特性研究 [J]. 中国烟草科学,2020,41(4):80-89.
LI M M, ZHANG J T, CUI C B, et al. Study on biocontrol characteristics of Three Bacillus strains[J]. Chinese Tobacco Science, 2020, 41(4): 80-89.
[31]申莉莉,王鳳龙,钱玉梅,等. 解淀粉芽孢杆菌Ba33对烟草的促生及抗TMV作用[J]. 吉林农业大学学报,2010,32(4):383-386.
SHEN L L, WANG F L, QIAN Y M, et al. Tobacco growth-promotion effect and TMV resistance of Bacillus amyloliquefaciens Ba33[J]. Journal of Jilin Agricultural University, 2010, 32(4): 383-386.
[32]黄智华,崔永和,计思贵,等. 云南烤烟根际土壤PGPR菌株的筛选与鉴定[J]. 中国烟草科学,2017,38(5):18-23.
HUANG Z H, CUI Y H, JI S G, et al. Isolation and Identification of PGPR Strains from rhizosphere soil of Yunnan flue-cured tobacco[J]. Chinese Tobacco Science, 2017, 38(5): 18-23.
[33]宋玉娟,韩雪莲,张安盛,等. 棘孢木霉T-6对烟草促生及对黑胫病和根黑腐病的抗病作用[J]. 中国烟草科学,2020,41(1):50-55.
SONG Y J, HAN X L, ZHANG A S, et al. Effects of Trichoderma asperellum T-6 on growth promotion, control of black shank and black root rot in tobacco[J]. Chinese Tobacco Science, 2020, 41(1): 50-55.
