A2DS2评分联合游离三碘甲状腺原氨酸预测卒中相关性肺炎的价值研究
2021-08-09姚阳阳张梦仝淑敏苏旖婕马联胜
姚阳阳,张梦,仝淑敏,苏旖婕,马联胜
卒中分为缺血性卒中和出血性卒中,缺血性卒中更为常见,占所有卒中的87%[1]。卒中相关性肺炎(stroke-associated pneumonia,SAP)是常见的卒中后并发症,影响14%的卒中患者[2],与卒中患者住院死亡率风险增加有关[3],增加住院时间[4],并且对医疗资源有相当大的经济影响[5]。SAP的概念由HILKER等[6]于2003年首先提出,《卒中相关性肺炎诊治中国专家共识(2019更新版)》[7]中仍然沿用英国SAP共识小组在2015年发表的共识,其将SAP定义为:非机械通气的卒中患者在发病7 d内新出现的肺炎。A2DS2评分可用于识别卒中后高危患者,有利于对肺炎高危患者进行预防及早期护理。低三碘甲状腺原氨酸(T3)综合征(low T3syndrome,LT3S)主要表现为游离三碘甲状腺原氨酸(free triiodothyronine,FT3)降低,而甲状腺素(T4)、促甲状腺激素(TSH)基本无变化。LT3S已被证明是危重患者预后的准确预测因素[8],可预测心力衰竭[9]、急性呼吸窘迫综合征(ARDS)[10]和脓毒症[11]的发生。本研究旨在探索FT3联合A2DS2评分对缺血性卒中患者SAP的预测能力,为SAP患者的早期预防提供帮助。
1 对象与方法
1.1 研究对象 回顾性选取2019年山西医科大学第一医院神经内科收治的急性缺血性卒中(AIS)患者300例。纳入标准:(1)符合《中国急性缺血性脑卒中诊治指南2018》[12];(2)症状出现7 d内入院;(3)入院后7 d内完成甲状腺功能检查。排除标准:(1)短暂性脑缺血发作;(2)已知甲状腺疾病史,既往2个月内服用干扰甲状腺功能的药物;(3)入院前已发生肺部感染;(4)其他原因导致的吞咽困难;(5)入院后24 h内死亡或出院;(6)合并其他危重疾病。
1.2 方法
1.2.1 数据收集 记录患者人口统计学特征,包括性别、年龄;既往疾病,包括高血压、糖尿病、心房颤动、高脂血症、吸烟史(吸烟定义为吸烟>1支/d,持续时间>1年)、饮酒史(饮酒定义为近3个月内饮酒量≥50 g/月)以及既往卒中史;临床资料,包括入院时美国国立卫生研究院卒中量表(NIHSS)评分,吞咽困难,是否溶栓、血管内治疗、入住重症监护病房(ICU)治疗和梗死部位、卒中分型;入院7 d内甲状腺激素水平〔FT3、游离甲状腺素(FT4)、TSH〕以及A2DS2评分。入院后对所有患者进行心电图检查,并记录心房颤动。吞咽功能评估采用洼田饮水试验,Ⅲ级~Ⅴ级为吞咽困难。卒中分型依据TOAST分型分为:大动脉粥样硬化、心源性栓塞、小动脉闭塞、其他明确原因、不明原因。入院后次日凌晨(空腹≥6 h)抽取肘静脉血3 ml,采用高效液相色谱法检测糖化血红蛋白。记录住院天数。
1.2.2 SAP诊断标准 SAP诊断符合《卒中相关性肺炎诊治中国专家共识(2019更新版)》[7]的诊断标准。(1)至少符合以下标准中任意一项:①无其他明确原因出现发热(体温≥38 ℃);②白细胞计数减少(≤4×109/L)或白细胞计数增多(≥10×109/L);③年龄≥70岁,且无其他明确原因出现意识状态改变;(2)并且至少符合以下标准中任意两项:①新出现的脓痰,或24 h内出现痰液性状改变或呼吸道分泌物增加或需吸痰次数增加;②新出现或加重的咳嗽或呼吸困难或呼吸急促(呼吸频率>25次/min);③肺部听诊发现啰音或爆裂音或支气管呼吸音;④气体交换障碍〔如低氧血症(氧分压/吸入氧浓度≤300%),需氧量增加〕。(3)至少2次胸部影像学检查具有以下表现中任意一项(既往无心肺基础疾病者,单次胸部影像学检查具有以下表现中任意一项即可):新出现或进展性的浸润影、实变影或磨玻璃影。同时满足以上(1)、(2)、(3)项,可诊断为SAP。患者根据是否发生SAP,分为SAP组和非SAP组。
1.2.3 A2DS2评分 A2DS2评分总分为10分,包括年龄、性别、心房颤动、NIHSS评分,见表1。

表1 A2DS2评分Table 1 A2DS2 score

2 结果
2.1 基线资料 SAP组43例(14.3%),非SAP组257例(85.7%)。两组性别、高血压所占比例、糖尿病所占比例、高脂血症所占比例、吸烟所占比例、饮酒所占比例、糖化血红蛋白、溶栓所占比例、入住ICU所占比例、FT4、TSH比较,差异均无统计学意义(P>0.05);SAP组年龄≥75岁、心房颤动、既往卒中史所占比例,入院时NIHSS评分,吞咽困难、血管内治疗、低FT3所占比例,A2DS2评分均高于非SAP组,住院天数长于非SAP组,差异均有统计学意义(P<0.05);两组梗死部位、卒中分型比较,差异均有统计学意义(P<0.05),见表2。
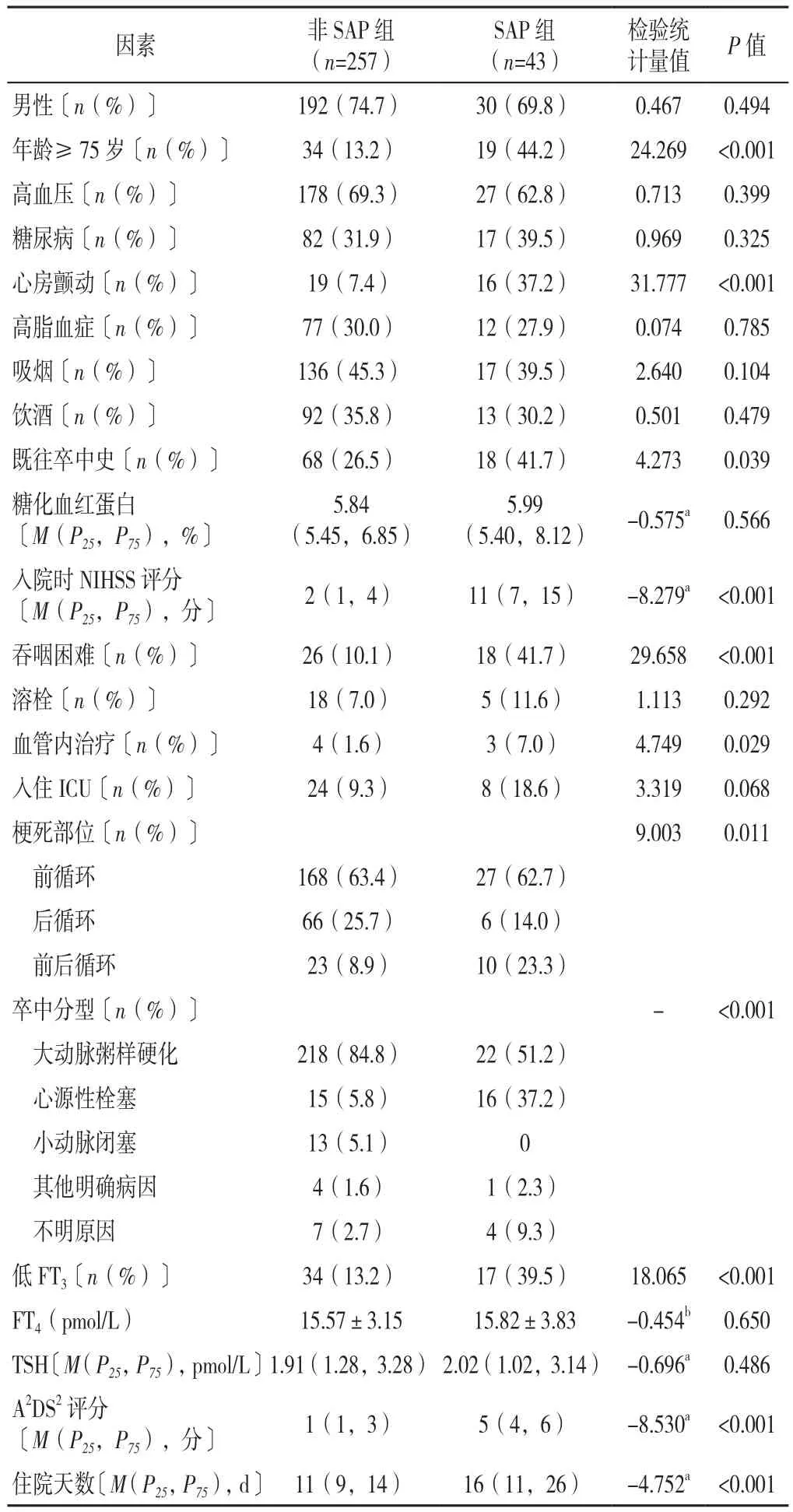
表2 SAP组和非SAP组人口统计学和基线资料比较Table 2 Comparison of demographic and baseline clinical data between SAP group and non-SAP group
2.2 多因素Logistic回归分析 以是否发生SAP(赋值:是=1,否=0)为因变量,以上述P<0.1的变量为自变量(自变量赋值见表3)进行多因素Logistic回归分析,结果显示,年龄≥75岁、心房颤动、入院时NIHSS评分、低FT3、A2DS2评分是SAP的独立危险因素(P<0.05),见表4。

表3 AIS患者发生SAP影响因素的多因素Logistic回归分析赋值表Table 3 Assignment table of variables possibly related to acute ischemic stroke-associated pneumonia included in multivariate Logistic regression analysis
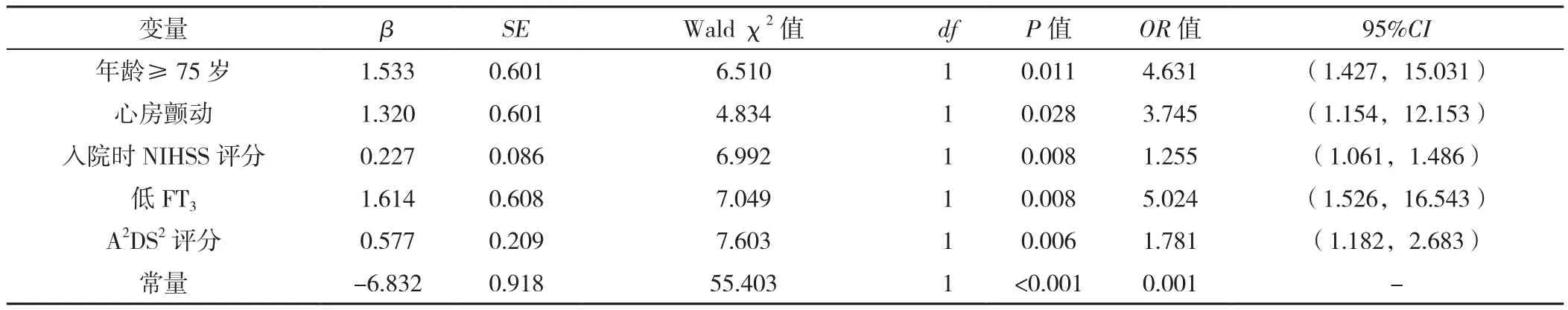
表4 AIS患者发生SAP影响因素的多因素Logistic回归分析Table 4 Multivariate Logistic regression analysis of risk factors of acute ischemic stroke-associated pneumonia
2.3 预测效能 A2DS2评分预测SAP的AUC为0.875〔95%CI(0.803,0.947)〕,最佳截断值为4.5分,灵敏度和特异度分别为0.689和0.957。FT3预测SAP的AUC为0.874〔95%CI(0.744,0.903)〕,最佳截断值为3.53 pmol/L,灵敏度和特异度分别为0.744和0.903。A2DS2评分联合FT3预测SAP的AUC为0.932〔95%CI(0.883,0.980)〕,灵敏度和特异度分别为0.884和0.860(图1、表5)。A2DS2评分联合FT3的AUC分别高于 A2DS2评分(Z=2.159,P=0.03)、FT3(Z=2.392,P=0.02),差异均有统计学意义。A2DS2评分与FT3的AUC比较,差异无统计学意义(Z=0.038,P=0.90)。
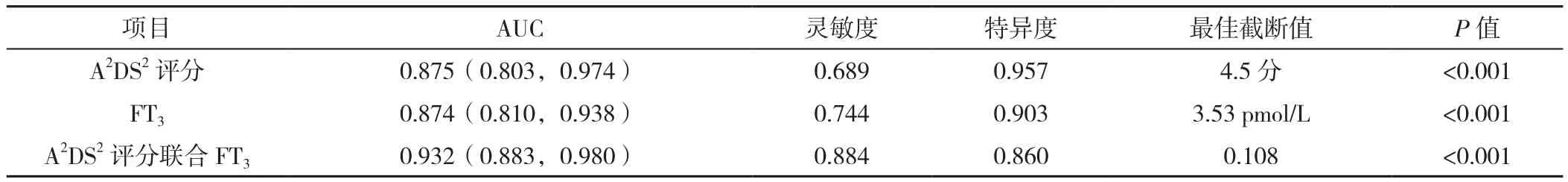
表5 A2DS2评分、FT3及A2DS2评分联合FT3预测AIS患者发生SAP的价值Table 5 Value of A2DS2 score,FT3 and A2DS2 score combined with FT3 in predicting acute ischemic stroke-associated pneumonia

图1 A2DS2评分、FT3以及二者联合预测SAP的ROC曲线分析Figure 1 ROC curve of A2DS2 score,FT3 and A2DS2 score combined with FT3 in predicting acute ischemic stroke-associated pneumonia
3 讨论
国外流行病学调查数据显示SAP发生率为7%~38%[13-16],我国资料显示缺血性卒中患者SAP发生率为11.4%~36.0%[17-18]。本研究结果显示AIS患者SAP发生率为14.3%,与既往研究结果一致。本研究还发现低FT3是SAP的独立危险因素,A2DS2评分联合FT3显示出了更好的预测能力(AUC=0.932)。
A2DS2评分是HOFFMANN 等[19]根据 15 335例缺血性卒中患者的一般资料制定的预测卒中后肺炎的有效工具,操作简单,预测效能高[20],但其内容均基于临床症状,目前研究多数为A2DS2评分联合降钙素原、白介素(IL)6、中性粒细胞与淋巴细胞比值等炎性指标预测SAP,但炎性指标变化短期内波动幅度较大,FT3在短期内可维持在低水平,神经危重症合并LT3S患者FT3下降的中位数为10.0(4.5,17.2)d[21],心脏手术后FT3通常在术后第7天才恢复到基线水平[22],所以FT3可以作为预测SAP的稳定指标。
血液中15%~20%的T3由甲状腺分泌,80%的T3由血清T4在外周组织脱碘而来。FT3、FT4是实际进入靶细胞与受体结合发挥作用的激素物质,其正常值不受T4结合蛋白的影响,是反映甲状腺功能的灵敏指标。LT3S是非甲状腺疾病综合征(nonthyroidal illness syndrome,NTIS)的一种类型,表现为总T3和FT3水平降低,T4和TSH水平正常。一项前瞻性研究对162例在ICU接受机械通气的患者进行入院时FT3检测,结果发现60%的患者合并低T3综合征,低FT3组患者的住院死亡率较高(52%与19%)[23]。国内研究显示腹腔感染患者LT3S的发生率高达82.5%,合并LT3S的患者疾病转归和预后较差[24]。SUDA等[25]研究表明低FT3水平可以预测卒中后感染。血清T3水平已被证明与感染性休克的死亡率有关[26]。以上研究表明,FT3在危重疾病和感染方面发挥作用,并且会导致更差的临床转归和预后。
SAP患者易合并低FT3与以下机制有关:第一,卒中诱导的细胞免疫功能低下是卒中患者SAP发生的重要内在机制,急性卒中后机体为保护脑组织会释放免疫调节递质IL-1β、肿瘤坏死因子α(TNF-α)、IL-6等细胞因子,产生免疫抑制,进而导致感染。这些细胞因子可以抑制5'-脱碘酶的活性[27-28],导致T4向T3转化减少。第二,SAP患者应激状态下下丘脑-垂体-肾上腺皮质轴(HPA)兴奋,糖皮质激素(GC)分泌增加,GC可以抑制TSH和甲状腺激素释放激素(TRH)的分泌,以及阻碍T4转化为有生物活性的T3。第三,T3降低可能为卒中患者发生SAP的诱发因素之一,T3是Ⅱ型肺泡细胞合成肺表面活性物质所必需的,T3直接刺激肺泡膜上的Na+泵,增加表面活性剂的产生,降低肺泡表面张力,增加肺顺应性[29]。
对于甲状腺激素治疗LT3S是否有益仍存在争议[30-32]。对神经危重症患者的回顾性分析显示,非激素替代疗法组的总生存期明显短于激素替代疗法组(16.45个月与47.47个月,P=0.034),然而两组之间死亡率风险没有显著差异〔HR=0.340,95%CI(0.099,1.172),P=0.087〕[21]。甲状腺激素可直接作用于心血管系统,增加心排血量和提高心肌效率[33],心脏疾病患者使用甲状腺激素替代治疗可能是有效的,目前还没有随机对照试验发现甲状腺激素治疗在危重症患者长期预后、降低死亡率等方面的有效性,但不可否认LT3S是各种危重疾病的一个有力预测指标。
本研究存在一些局限性。首先,本研究为单中心和观察性研究,其研究结果仍需要通过更大的多中心前瞻性试验来验证。第二,作者只检测了入院时的甲状腺激素水平,没有动态监测FT3、FT4和TSH的变化。第三,本研究纳入了三甲医院的住院患者,可能导致选择偏倚。第四,作者排除了由于各种原因未完成甲状腺功能检查的患者,这使结果的普遍性受到限制。
综上所述,A2DS2评分联合FT3对SAP的预测价值高,可以早期识别SAP患者。SAP患者合并LT3S是否受益于替代疗法还有赖于对LT3S组织水平病理生理机制的进一步研究。
作者贡献:姚阳阳进行文章的构思与设计,研究的实施与可行性分析,结果的分析与解释,撰写论文,进行论文的修订;姚阳阳、张梦进行数据收集;姚阳阳、苏旖婕进行数据整理;姚阳阳、张梦、仝淑敏进行统计学处理;姚阳阳、马联胜负责文章的质量控制及审校;马联胜对文章整体负责,监督管理。
本文无利益冲突。
