刺五加多糖对自身免疫性肝炎小鼠肝损伤的改善作用及机制研究
2021-08-09高鹏周凤蕊刘俊华李广明
高鹏 周凤蕊 刘俊华 李广明
郑州市第六人民医院 郑州 450015
自身免疫性肝炎 (autoimmune hepatitis,AIH)是由于机体自身免疫反应攻击肝组织所致的非病毒性、药物性或酒精性肝病。AIH病程迁延,治疗难度大,如延误治疗可发展为肝硬化、肝衰竭,导致门脉高压与肝功能不全[1]。目前AIH治疗以糖皮质激素及免疫抑制剂为主,可在一定程度上改善生化指标、减轻肝脏炎症,防止肝损伤,但患者容易产生耐药性,且药物毒副作用大,停药后面临着较高的复发风险[2-3]。近年来,中草药在改善AIH症状及延缓病情发展方面表现出相当的优势,大批基础研究致力于挖掘中药及其提取物在AIH治疗方面的作用。刺五加多糖(A-canthopanacis senticosi polysaccharides,ASPS)提取自五加科植物刺五加,具有诱导干扰素生成、抗氧化、降血糖、免疫调节等作用[4]。既往研究表明,ASPS可改善小鼠镇痛模型炎症状况,调节免疫器官指数及免疫细胞因子水平,从而发挥免疫调节作用[5],但目前关于其对AIH的治疗作用及相关机制研究尚少。鉴于此,本研究通过建立AIH小鼠模型,研究ASPS对AIH肝损伤的改善作用并探讨相关机制,为ASPS应用于AIH的临床治疗提供参考。
1 材料和方法
1.1 实验动物 4周龄无特定病原体(specific pathogen free,SPF)级雄性C57BL/6小鼠120只,体质量(18±1)g,购于中国医学科学院医学实验动物研究所[实验动物生产许可证号码:SCXK(京)2019-0011]。所有小鼠所处环境温度20~25℃,通风良好,饲养于河南中检检测技术有限公司[实验动物使用许可证号码:SYXK(豫)2018-0006]。
1.2 药物、主要试剂和仪器 ASPS购于西安首禾生物科技有限公司(批号:SH-01-05);泼尼松龙购于华润紫竹药业有限公司(国药准字:H11020374);弗氏完全佐剂购于美国Chondrex公司(批号:7008);卡介苗购于陕西医药控股集团生物制品有限公司(国药准字:S10960096);天门冬氨酸氨基转移酶(aspartate aminotransferase,AST)检测试剂盒购于上海远慕生物科技有限公司(批号:YE01915);丙氨酸氨基转移酶(alanine aminotransferase,ALT)检测试剂盒购于上海泽叶生物科技有限公司 (批号:ZY-ALT-Mu);白介素-22(interleukin-22,IL-22)酶联免疫吸附检测(enzyme-linked immunosorbent assay,ELISA) 试剂盒购于美国R&D公司 (批号:M2200);肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白介素-6(interleukin-6,IL-6)ELISA试剂盒均购于武汉伊莱瑞特生物科技股份有限公司(批号:E-EL-R0019c、E-ELR0015c);Toll样受体4(Toll like receptor 4,TLR4)多抗、髓样细胞分化因子88(myeloid differentiation factor 88,MyD88)单抗均购于武汉菲恩生物科技有限公司(批号:FNab08727、FNab09835); 核因子-κB(nuclear factor-κB,NF-κB)、磷酸化核因子-κB(phosphorylation-nuclear factor-κB,p-NF-κB)单抗均购于武汉益普生物科技有限公司(批号:ATA33868、ATA33869);辣根过氧化物酶标记的山羊抗兔IgG二抗购于上海研卉生物科技有限公司(批号:E030120)。
UniCel DxC 800全自动生化分析仪购于美国Beckman Coulter有限公司;Synergy H4全功能酶标仪购于美国Bio Tek公司;Cytomics FC 500流式细胞仪为美国Beckman Coulter有限公司产品;DSX100光学显微镜购于日本奥林巴斯株式会社。
1.3 方法
1.3.1 模型建立及分组 参照文献[6]建立小鼠AIH模型。选取C57BL/6小鼠60只,颈椎脱臼处死,分离肝脏,剪碎肝组织,以0.9%氯化钠溶液洗去血液,3 000r/min离心20min,离心半径12cm,采用琼脂糖凝胶6B分离上清液,收集第一峰,即获取肝特异性膜脂蛋白(liver specific membrane lipoprotein,LSP)。 采用0.9%氯化钠溶液将LSP稀释至25g·L-1,每次免疫时将其与弗氏完全佐剂等比例混合,充分研磨至乳白色后,滴加5mg·mL-1卡介苗继续研磨。取C57BL/6小鼠50只,采用新鲜制备的免疫剂腹腔注射,0.2mL/次,1次/周,共注射4次。尾静脉采血1mL,离心后采用间接免疫荧光法(indirect immunofluorescence,IIF)检测小鼠血清中抗核抗体(antinuclear antibody,ANA)、抗平滑肌抗体(smooth muscle antibody,SMA)水平,以两者均为阳性为建模成功的标准。ANA阳性标准:以Hep-2细胞为抗原包被,分裂间期细胞核可观察到均匀荧光,分裂期细胞浓缩染色体可观察到更强的均匀荧光。SMA阳性标准:小鼠平滑肌细胞可观察到为明亮的黄绿色荧光。将42只建模成功的小鼠随机分为AIH组(10只)、ASPS低剂量组(10只)、ASPS高剂量组(11只)、泼尼松龙组(11只)。其余10只小鼠不进行处理,设为健康组。
1.3.2 干预方式 末次免疫注射后第2天,ASPS低、高剂量组分别以50、100mg·kg-1的ASPS (溶于0.9%氯化钠溶液5mL中)灌胃[7],1次/d;泼尼松龙组采用泼尼松龙9mg·kg-1(溶于0.9%氯化钠溶液5mL中)灌胃,1次/d;健康组与AIH组均等量0.9%氯化钠溶液灌胃,1次/d。各组均连续干预7d。
1.3.3 取材方式 取材前晚禁食,末次给药后4h,各组小鼠尾静脉采血1mL,其中0.5mL新鲜血液用于外周血Th22细胞水平检测,其余0.5mL经3 500r/min离心15min,离心半径12cm,分离血清冰箱保存。取血后小鼠脱颈处死,冰盘上分离肝组织,冷冻保存用于后续研究。
1.3.4 血清AST、ALT水平检测 取冰箱保存的血清,采用全自动生化分析仪测定血清AST、ALT水平,根据小鼠AST、ALT试剂盒说明书要求严格设计检测步骤。
1.3.5 血清IL-22、TNF-α、IL-6水平检测 取冰箱保存的血清,采用ELISA法检测血清IL-22、TNF-α、IL-6水平,严格按照小鼠IL-22、TNF-α、IL-6 ELISA试剂盒说明书操作,经酶标仪检测570nm波长处吸光度值,以标准品浓度和吸光度值绘制标准曲线,根据标准曲线计算IL-22、TNF-α、IL-6水平。
1.3.6 外周血Th22细胞水平检测 取新鲜血液1mL,加入淋巴细胞分离液后离心,制备成单个核细胞悬液,离心后经磷酸盐缓冲液(phosphate buffer saline,PBS)重悬,每管取100μL,调整细胞数量为2×105个/管,每管中加入异硫氰酸荧光素(fluorescein isothiocyanate isomer,FITC)标记的抗CD4抗体1.5μL及别藻蓝蛋白(allophycocyanin,APC)标记的抗IL-22抗体1.5μL,4℃避光孵育25min,PBS洗涤。破膜后以阴性对照管设门,以多参数流式细胞术检测Th22细胞占比。
1.3.7 肝组织病理变化观察 取约5mm×5mm×5mm大小冷冻保存的肝组织,40%中性甲醛固定,经梯度乙醇脱水,二甲苯透明,浸蜡,石蜡包埋,4μm连续切片,烘干后二甲苯脱蜡、乙醇水化,HE染色,中性树脂封片,光镜下观察肝组织病理变化。
1.3.8 肝组织TLR4、MyD88、p-NF-κB p65、NF-κB p65蛋白表达检测 取冷冻保存的肝组织40mg,充分研磨后移至离心管,加入细胞裂解液冰上裂解30min,12 000r/min离心15min,离心半径8cm,蛋白定量后取40μg待检测样本与上样缓冲液混合,100℃水浴5min,12 000r/min离心15min,离心半径8m,取上清液,十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)后湿转至硝酸纤维素膜上,5%脱脂奶粉室温封闭2h,加入兔抗鼠TLR4多抗,MyD88、p-NF-κB p65、NF-κB p65单抗(稀释比例均为1∶1 000),4℃孵育过夜,含有Tween的Tris缓冲盐溶液(Tris-buffered saline and 0.1%Tween-20,TBST)洗膜3次,加入辣根过氧化物酶标记的山羊抗兔IgG二抗(稀释比例1∶8 000),室温孵育2h,TBST洗涤3次,加入显色剂暗室中曝光、显影,以凝胶成像系统扫描、分析灰度值,以目的蛋白条带灰度值/内参β-actin条带灰度值表示蛋白相对表达量,并计算p-NF-κB p65/NF-κB p65的比值。
1.4 统计学分析 采用SPSS 23.0统计软件进行统计学分析,计量资料以±s表示,多样本资料组间比较采用单因素方差分析,如Levene检验方差齐,采用单因素方差分析比较总均值,再用最小显著性差异法(least significant difference,LSD)-t进行两两比较;如Levene检验方差不齐,改用welch检验比较总体均值,再用Dunnett T3检验进行两两比较。以P<0.05为差异有统计学意义。
2 结果
2.1 各组小鼠一般情况比较 健康组小鼠饮食正常、动作敏捷,毛发黑亮有光泽;AIH小鼠食欲不振、行动迟缓、精神不佳,喜弓背,毛发粗乱无光泽。见图1。
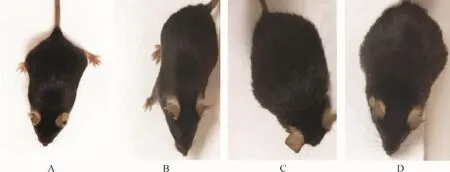
图1 健康组和AIH组小鼠外观比较Fig.1 Comparison of appearance in healthy group and AIH group
2.2 各组小鼠血清AST、ALT水平比较 各组间总体比较,血清AST、ALT水平差异有统计学意义(P<0.001)。与健康组比较,AIH组、ASPS低、高剂量组和泼尼松龙组血清AST、ALT水平均升高(P<0.05);与AIH组比较,ASPS低、高剂量组和泼尼松龙组血清AST、ALT水平均降低(P<0.05);与ASPS低剂量组比较,ASPS高剂量组和泼尼松龙组血清AST、ALT水平均降低(P<0.05);ASPS高剂量组、泼尼松龙组血清AST、ALT水平比较,差异无统计学意义(P>0.05)。 见表1。
表1 各组小鼠血清AST、ALT水平比较(±s,U·L-1)Tab.1 Comparison of serum AST and ALT levels in each group(±s,U·L-1)
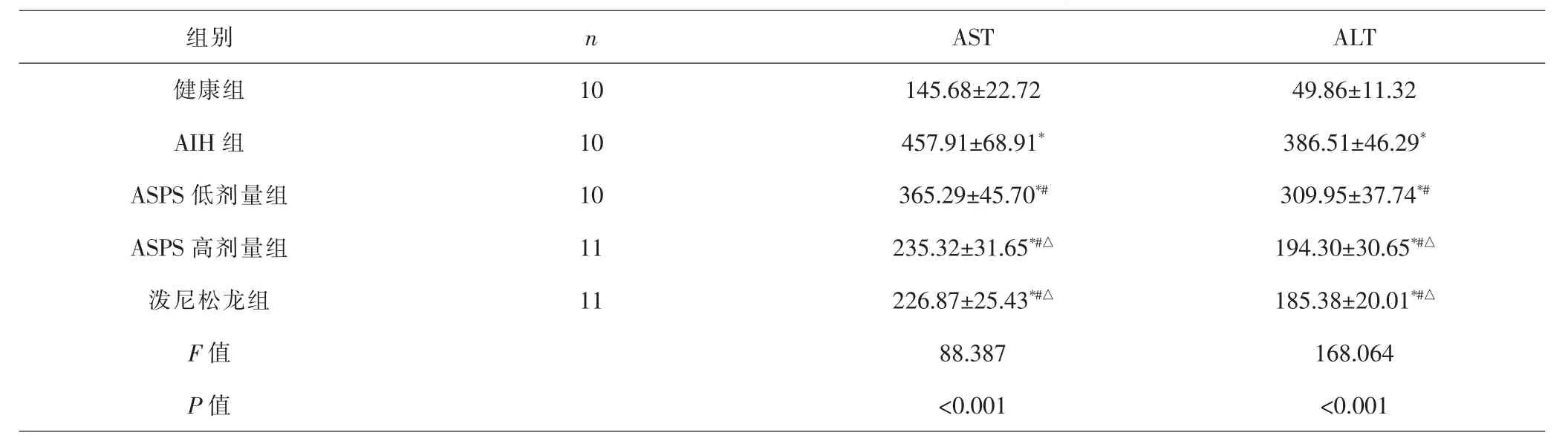
表1 各组小鼠血清AST、ALT水平比较(±s,U·L-1)Tab.1 Comparison of serum AST and ALT levels in each group(±s,U·L-1)
注:与健康组比较,*P<0.05;与AIH组比较,#P<0.05;与ASPS低剂量组比较,△P<0.05Note:Compared with healthy group,*P<0.05;compared with AIH group,#P<0.05;compared with ASPS low dose group,△P<0.05
组别 n AST ALT健康组 10 145.68±22.72 49.86±11.32 AIH 组 10 457.91±68.91* 386.51±46.29*ASPS 低剂量组 10 365.29±45.70*# 309.95±37.74*#ASPS高剂量组 11 235.32±31.65*#△ 194.30±30.65*#△泼尼松龙组 11 226.87±25.43*#△ 185.38±20.01*#△F值 88.387 168.064 P值 <0.001 <0.001
2.3 各组小鼠血清IL-22、TNF-α、IL-6水平比较 各组间总体比较,血清IL-22、TNF-α、IL-6水平差异有统计学意义(P<0.001)。 与健康组比较,AIH组、ASPS低、高剂量组和泼尼松龙组血清IL-22、TNF-α、IL-6水平均升高(P<0.05);与AIH组比较,ASPS低、高剂量组和泼尼松龙组血清IL-22、TNF-α、IL-6水平均降低(P<0.05);与ASPS低剂量组比较,ASPS高剂量组和泼尼松龙组血清IL-22、TNF-α、IL-6水平均降低(P<0.05);ASPS高剂量组、泼尼松龙组血清IL-22、TNF-α、IL-6水平比较,差异无统计学意义(P>0.05)。见表2。
表2 各组小鼠血清IL-22、TNF-α、IL-6水平比较(±s,pg·mL-1)Tab.2 Comparison of serum IL-22,TNF-α and IL-6 levels in each group(±s,pg·mL-1)
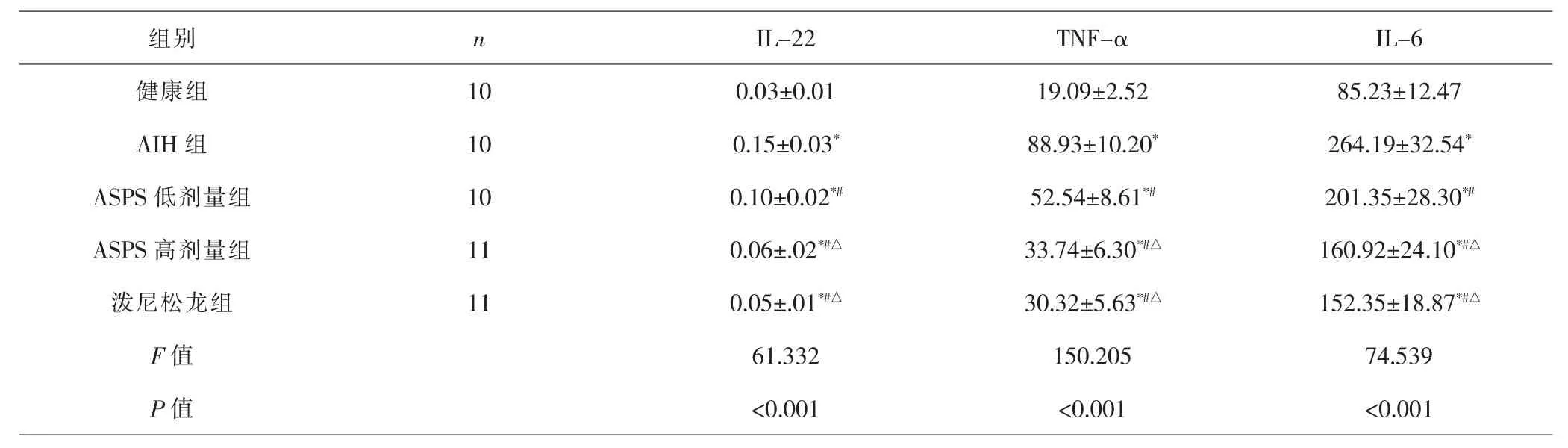
表2 各组小鼠血清IL-22、TNF-α、IL-6水平比较(±s,pg·mL-1)Tab.2 Comparison of serum IL-22,TNF-α and IL-6 levels in each group(±s,pg·mL-1)
注:与健康组比较,*P<0.05;与AIH组比较,#P<0.05;与ASPS低剂量组比较,△P<0.05Note:Compared with healthy group,*P<0.05;compared with AIH group,#P<0.05;compared with ASPS low dose group,△P<0.05
组别 n IL-22 TNF-α IL-6健康组 10 0.03±0.01 19.09±2.52 85.23±12.47 AIH 组 10 0.15±0.03* 88.93±10.20* 264.19±32.54*ASPS 低剂量组 10 0.10±0.02*# 52.54±8.61*# 201.35±28.30*#ASPS 高剂量组 11 0.06±.02*#△ 33.74±6.30*#△ 160.92±24.10*#△泼尼松龙组 11 0.05±.01*#△ 30.32±5.63*#△ 152.35±18.87*#△F值 61.332 150.205 74.539 P 值 <0.001 <0.001 <0.001
2.4 各组小鼠Th22细胞比例比较 各组间总体比较,CD4+T淋巴细胞中Th22细胞比例差异有统计学意义(P<0.001);与健康组比较,AIH组、ASPS低、高剂量组和泼尼松龙组Th22细胞比例均升高(P<0.05);与AIH组比较,ASPS低、高剂量组和泼尼松龙组Th22细胞比例均降低(P<0.05);与ASPS低剂量组比较,ASPS高剂量组和泼尼松龙组Th22细胞比例均降低(P<0.05);ASPS高剂量组、泼尼松龙组Th22细胞比例比较,差异无统计学意义(P>0.05)。 见表3、图2。
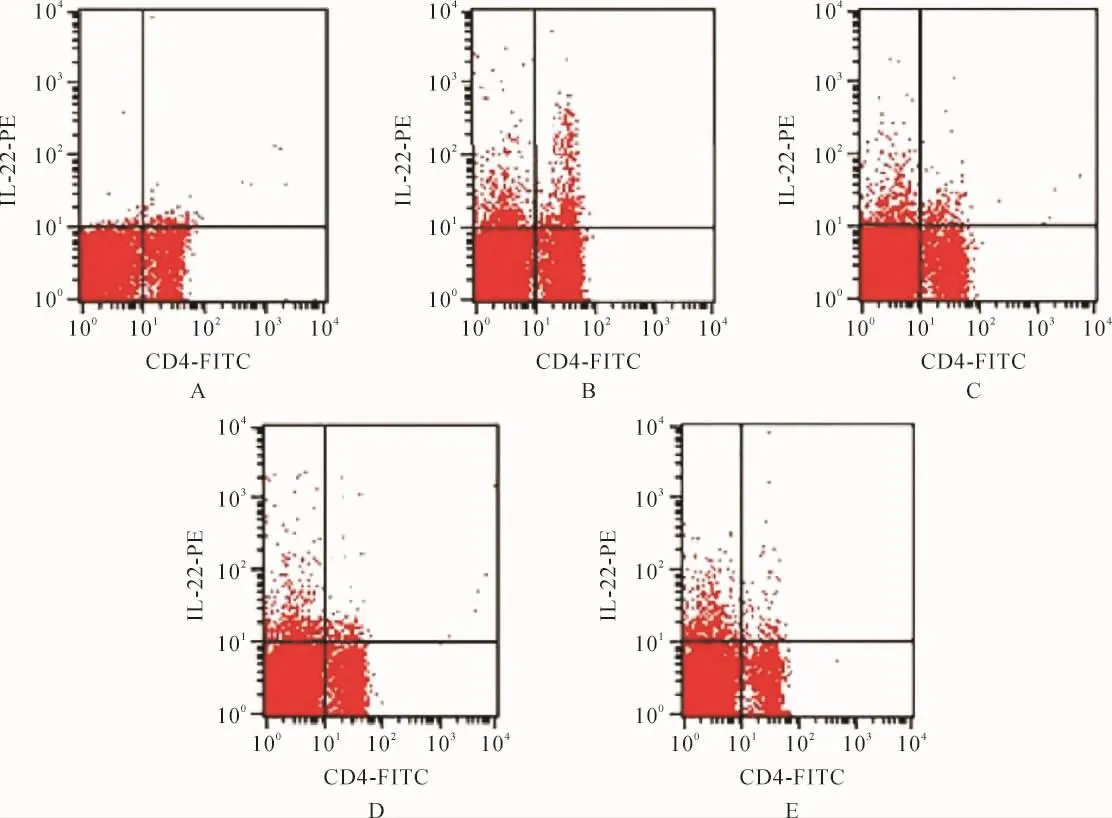
图2 各组CD4+T淋巴细胞中Th22细胞比例Fig.2 The proportion of Th22 cells in CD4+T lymphocytes in each group
表3 各组小鼠Th22细胞比例比较(±s,%)Tab.3 Comparison of Th22 cell proportions in each group(±s,%)

表3 各组小鼠Th22细胞比例比较(±s,%)Tab.3 Comparison of Th22 cell proportions in each group(±s,%)
注:与健康组比较,*P<0.05;与AIH组比较,#P<0.05;与ASPS低剂量组比较,△P<0.05Note:Compared with healthy group,*P<0.05;compared with AIH group,#P<0.05;compared with ASPS low dose group,△P<0.05
组别n Th22细胞比例健康组 10 1.07±0.23 AIH 组 10 2.86±0.45*ASPS低剂量组 10 2.21±0.39*#ASPS 高剂量组 11 1.62±0.38*#△泼尼松龙组 11 1.60±0.35*#△F值 34.941 P值 <0.001
2.5 各组小鼠肝组织病理变化比较 HE染色结果显示,健康组肝细胞形态正常,肝小叶结构清晰、完整,汇管区域正常;AIH组肝细胞明显水肿,肝小叶结构被破坏,可观察到大面积小灶样坏死,且存在大量炎性细胞浸润;ASPS低、高剂量组和泼尼松龙组干预后小灶样坏死面积缩小,肝小叶结构较为完整,炎性细胞浸润减少,其中ASPS高剂量组和泼尼松龙组改善作用较为明显。见图3。
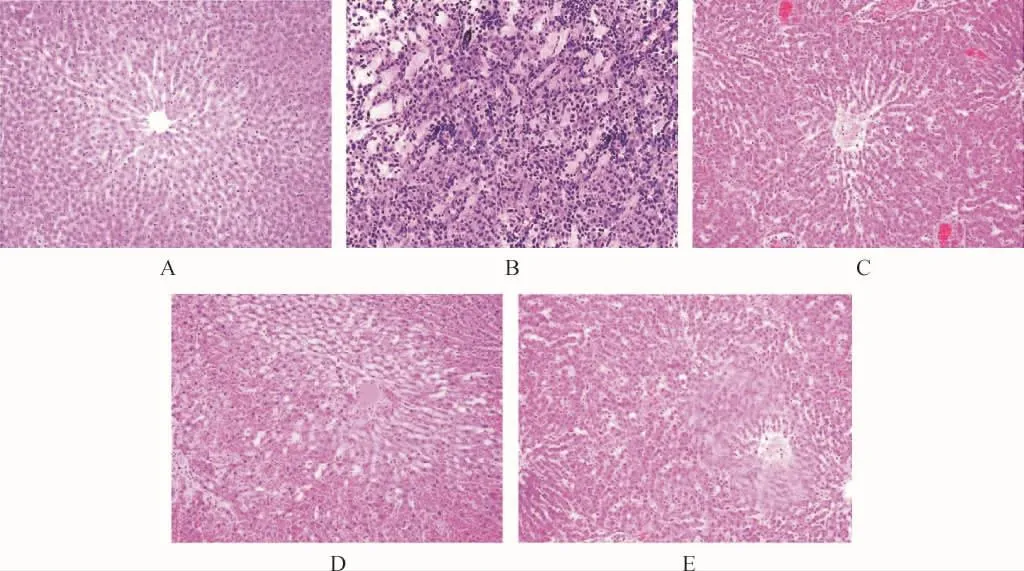
图3 各组小鼠肝组织病理变化(HE染色,100×)Fig.3 Pathological changes of liver tissue in each group(HE staining,100×)
2.6 各组小鼠肝组织TLR4、MyD88蛋白表达及p-NF-κB p65/NF-κB p65比较 各组间总体比较,肝组织TLR4、MyD88蛋白相对表达量,p-NF-κB p65/NF-κB p65差异有统计学意义(P<0.001)。与健康组比较,AIH组、ASPS低、高剂量组和泼尼松龙组肝组织TLR4、MyD88蛋白相对表达量,p-NF-κB p65/NF-κB p65均升高(P<0.05);与AIH组比较,ASPS低、高剂量组和泼尼松龙组肝组织TLR4、MyD88蛋白相对表达量,p-NF-κB p65/NF-κB p65均降低 (P<0.05);与ASPS低剂量组比较,ASPS高剂量组和泼尼松龙组肝组织TLR4、MyD88蛋白相对表达量,p-NF-κB p65/NF-κB p65均降低 (P<0.05);ASPS高剂量组和泼尼松龙组肝组织TLR4、MyD88蛋白相对表达量,p-NF-κB p65/NF-κB p65比较,差异无统计学意义 (P>0.05)。 见表4、图4。
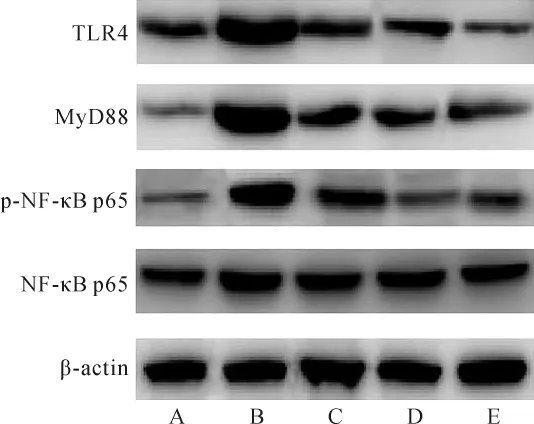
图4 各组TLR4、MyD88、NF-κB p65、p-NF-κB p65蛋白表达结果Fig.4 Protein expression results of TLR4,MyD88,NF-κB p65,p-NF-κB p65 in each group
表4 各组小鼠肝组织TLR4、MyD88蛋白表达及p-NF-κB p65/NF-κB p65比较(±s)Tab.4 Comparison of relative expression levels of TLR4,MyD88 and NF-κB proteins in liver tissues in each group(±s)
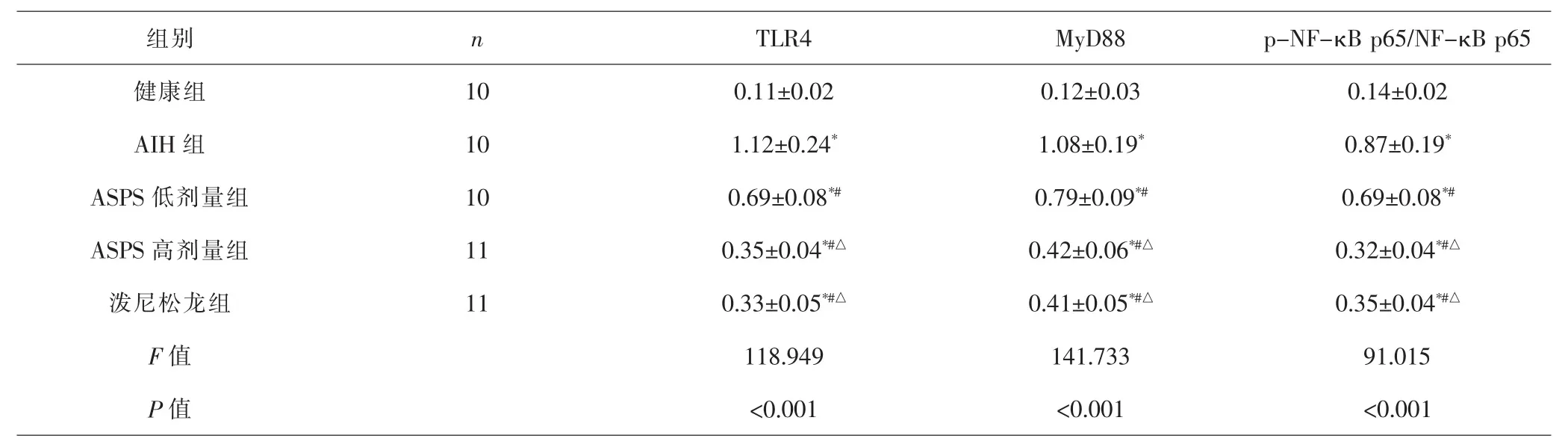
表4 各组小鼠肝组织TLR4、MyD88蛋白表达及p-NF-κB p65/NF-κB p65比较(±s)Tab.4 Comparison of relative expression levels of TLR4,MyD88 and NF-κB proteins in liver tissues in each group(±s)
注:与健康组比较,*P<0.05;与AIH组比较,#P<0.05;与ASPS低剂量组比较,△P<0.05Note:Compared with healthy group,*P<0.05;compared with AIH group,#P<0.05;compared with ASPS low dose group,△P<0.05
组别 n TLR4 MyD88 p-NF-κB p65/NF-κB p65健康组 10 0.11±0.02 0.12±0.03 0.14±0.02 AIH 组 10 1.12±0.24* 1.08±0.19* 0.87±0.19*ASPS 低剂量组 10 0.69±0.08*# 0.79±0.09*# 0.69±0.08*#ASPS 高剂量组 11 0.35±0.04*#△ 0.42±0.06*#△ 0.32±0.04*#△泼尼松龙组 11 0.33±0.05*#△ 0.41±0.05*#△ 0.35±0.04*#△F值 118.949 141.733 91.015 P 值 <0.001 <0.001 <0.001
3 讨论
AIH是一种常见的慢性炎症性肝病,以血清转氨酶水平升高,SMA、ANA等自身抗体阳性等为主要临床特征。AIH病理学特征主要为汇管区及门静脉巨噬细胞、浆细胞、淋巴细胞浸润并侵入周围肝实质,导致肝门周围及间隔周围中、重度小叶性界板炎症及坏死[8-9]。研究显示,细胞因子、氧化应激、自身抗原抗体反应等多种因素均可激活T淋巴细胞,介导免疫反应,攻击肝脏组织;并能够促进免疫细胞合成、释放多种炎症介质,导致肝脏炎性损伤[10]。但目前临床尚未完全阐明AIH的病因与发病机制,通常认为与遗传基因易感、免疫调节及效应机制密切相关[11]。目前AIH最常用的治疗方案为糖皮质激素联合免疫抑制剂,具有较强的免疫抑制及抗炎功效,但长期用药毒副作用较强,患者依从性不佳。近年来,中药因副作用小、安全性高,在肝病的临床治疗中逐渐受到关注。
Th22细胞是新发现的一种独立的辅助性T淋巴细胞亚群,主要通过释放效应细胞因子IL-22发挥免疫调节作用。Ma等[12]报道指出,AIH患者Th22细胞数量与血清IL-22水平均显著增加,且与病情严重程度呈正相关,提示Th22细胞与IL-22与AIH发生、发展关系密切。多糖作为构成生命体的基本物质之一,亦是一种重要的天然活性成分。既往研究认为,多糖通常通过抑制黏附因子、趋化因子及炎症发展过程中关键酶的活性,进而调节细胞因子生成,实现抗炎及免疫调节作用[13]。作为五加科植物刺五加的活性成分之一,ASPS由阿拉伯糖、木糖、葡萄糖、果糖等成分组成,具有生物活性广泛、毒性低等优势,在临床疾病的治疗中表现出较大的潜力。孙守坤等[14]采用环磷酰胺诱导法建立免疫抑制小鼠模型,经刺五加酸性多糖干预后,小鼠免疫器官脏器指数、外周血白细胞数量、炎症因子水平和脾淋巴细胞增殖能力等均得到显著改善,提示刺五加酸性多糖可显著增强免疫抑制小鼠的免疫功能。本研究结果提示,AIH组、ASPS低、高剂量组血清AST、ALT、IL-22、TNF-α、IL-6水平以及CD4+T淋巴细胞中Th22细胞占比依次降低;AIH组肝细胞明显水肿,肝小叶结构被破坏,可观察到大面积小灶样坏死及大量炎性细胞浸润,ASPS低、高剂量组和泼尼松龙组肝组织病理变化有所改善,其中ASPS高剂量组和泼尼松龙组改善作用较为明显,提示ASPS可改善AIH小鼠肝功能,减轻炎症反应及病理变化,其作用呈剂量依赖性。
Toll样受体属Ⅰ型跨膜糖蛋白,是一种天然免疫模式识别受体,TLR4是Toll样受体家族重要成员,主要表达在免疫细胞表面,在机体固有免疫系统激活及抗病原微生物免疫中扮演着重要角色。MyD88是TLR4的衔接蛋白,TLR4可经MyD88依赖途径被激活,进而活化MyD88蛋白,诱导下游因子NF-κB转入细胞核,NF-κB发生磷酸化后进一步激活巨噬细胞、单核细胞释放TNF-α、IL-6等炎症介质,引发一系列炎症反应,参与自身免疫性疾病的发生和发展过程。Chi等[15]认为,TLR2/4配体放大的肝脏炎症,是IL-6、IL-12等炎症因子持续表达及AIH发生、发展的重要因素。既往动物实验表明,TLR4途径可能是ASPS降低Lewis荷瘤小鼠外周血中炎症因子水平、发挥肿瘤抑制及免疫调节作用的通路之一,推测ASPS对该通路具有调节作用[16]。Li等[17]在研究ASPS介导小鼠巨噬细胞免疫调节的潜在机制及信号传导级联反应时发现,ASPS可增强巨噬细胞吞噬作用,可能成为潜在的免疫增强剂,并确定TLR4是ASPS的主要受体。上述研究均提示ASPS对TLR4信号通路可能具有调节作用。本研究结果显示,ASPS高剂量组和泼尼松龙组肝组织TLR4、MyD88蛋白相对表达量,p-NF-κB p65/NF-κB p65比例低于AIH组和ASPS低剂量组,而ASPS低剂量组低于AIH组,提示ASPS可能通过抑制TLR4/MyD88信号通路,发挥保护AIH小鼠肝功能、减轻炎症反应及病理变化、调节Th22细胞比例的作用。
综上所述,ASPS可保护AIH小鼠肝功能,减轻炎症反应,调节Th22细胞比例,改善肝组织病理变化,其作用呈剂量依赖性,推测其分子机制与抑制TLR4/MyD88信号通路有关。
