铅和脂多糖暴露致小鼠神经炎症的损伤机制
2021-08-07王伟轩李爽陈松曹福源张学彦张洋庞淑兰张艳淑
王伟轩,李爽,陈松,曹福源,张学彦,张洋,庞淑兰,张艳淑,
华北理工大学 a.公共卫生学院 b.实验动物中心,河北 唐山 063210
中国是世界铅生产和消费大国,长期慢性铅暴露可导致神经炎症,脑组织中促炎因子肿瘤坏死因 子-α(tumor necrosis factor-α,TNF-α)、白介素-6(interleukin-6,IL-6)、白介素-1β(interleukin-1β,IL-1β)等表达升高,引起学习记忆等能力缺陷或下降[1-2]。此外,日常生活中革兰氏阴性菌感染比较广泛,如食物污染、水源污染等。革兰氏阴性菌感染导致的疾病与其释放的内毒素脂多糖(lipopolysaccharide,LPS)密切相关。研究显示脂多糖也可引起神经炎症[3-4],然而,环境中铅和LPS 共同暴露是否可以导致神经炎症加剧还未见报道。
神经炎症的重要标志之一是小胶质细胞过度活化。小胶质细胞是中枢神经系统中固有免疫细胞,参与大脑发育、神经环境维持、损伤反应和修复。研究显示小胶质细胞具有两种明显不同的极化方式:一是经典激活途径,即M1 表型,释放TNF-α、IL-6、IL-1β等,促进诱导型一氧化氮合酶(induced nitric oxide synthase,iNOS)、NADPH 氧化酶2(NADPH oxidase 2,NOX2)、趋化因子受体7(chemokine receptor 7,CCR7)等高表达,加重炎症反应,破坏血脑屏障,促进神经元死亡;二是替代激活途径,即M2 表型,释放转化生长因子-β(transforming growth factor-β,TGF-β)、白介素-10(interleukin-10,IL-10)等,并高表达精氨酸-1(arginase 1,Arg-1)、趋化因子受体2(chemokine receptor 2,CCR2)等,抑制炎症反应、促进神经修复、保护神经元[5-6]。小胶质细胞活化过程中,髓样细胞触发受体2(triggering receptor expressed on myeloid cells 2,TREM2)可参与其过程且主要在小胶质细胞膜上特异表达[7],可通过促进小胶质细胞向M2 表型转化,从而维持脑环境稳定,参与阿兹海默症、帕金森病等神经退行性病变[8-9]。TREM2 的表达变化可受微小RNA(microRNAs,miRNAs)的调控,有研究显示,微小RNA-34a(microRNA-34a,miR-34a)靶向TREM2mRNA 3’非翻译区,并显著下调小胶质细胞中TREM2的表达[10]。然而,miR-34a在铅和LPS 联合暴露小鼠皮质中的变化未见报道。
本研究通过建立铅和LPS 联合暴露小鼠模型,探讨铅和LPS 联合暴露后皮质中炎症因子和小胶质细胞M1、M2 标志物及TREM2 和miR-34a表达的变化,以期为铅和LPS 联合暴露导致的神经损伤防治提供理论依据。
1 对象与方法
1.1 实验动物分组及处理
SPF 级雄性C57 小鼠64 只,适应性喂养1 周后将小鼠随机均分为对照组、LPS组、低铅组、中铅组、高铅组、低铅+LPS组、中铅+LPS组和高铅+LPS组,每组8只。铅染毒剂量为:0.25、0.50、1.00 g·L-1乙酸铅饮水,共9周,对照组给予等量的双蒸水。LPS处理方式:在铅染毒结束前一周,每天腹腔注射一次LPS(250 g·kg-1,以体重计),共7 次,末次注射24 h 后处死动物。小鼠麻醉处死,迅速分离脑组织,并在冰上分离出皮质,-80℃保存备用。本研究已获华北理工大学实验动物伦理委员会批准(审批号:LAEC-NCST-2020082)。
1.2 ELISA法检测小鼠皮质组织中炎症因子
采用ELISA 试剂盒(Solarbio,中国),检测皮质组织中炎症因子TNF-α、IL-1β 和IL-6 的水平,具体操作步骤严格按照试剂盒说明书进行。最低检出限为31.25 ng·L-1。
1.3 实时荧光定量PCR 法检测M1、M2 型标志物和TREM2 mRNA、miR-34a 的表达水平
取小鼠皮质30 mg,采用Trizol 法提取总RNA,反转录为cDNA,进行实时荧光定量PCR 分析。miR-34a购买于广州锐博生物科技有限公司。内参基因为U6、β-actin,引物由上海生工生物技术服务有限公司合成,各引物序列见表1。扩增反应条件为:95℃预热60 s,然后按95℃ 10 s,60℃ 15 s,72℃ 10 s进行50个循环,最后72℃延伸10 min。

表1 目的基因引物序列Table 1 Primer sequences of target genes
1.4 Western blotting法检测TREM2、iNOS和Arg-1蛋白表达
将皮质组织充分裂解并研磨,4℃、12 000 r·min-1离心(离心半径为4 cm)15 min后取上清液,取2 μL样品放入96孔板,加入18 μL的PBS稀释,最终体积为20 μL,将200 μL BCA工作液(BCA试剂∶Cu 体积比=50∶1,提前配制,室温稳定2 h)分别加入标准品和样品孔中,使其充分混匀后于37℃孵育箱孵育30 min。冷却至室温后用酶标仪在波长为592 nm 处检测各孔的光密度(D)值,将96 孔板放进酶标仪,摇板5 s。根据各孔D值绘制标准曲线,在标准曲线中计算各组样品蛋白浓度。采用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳分离蛋白(分离胶和浓缩胶体积分数分别为10.00%和5.00%),转膜后进行封闭,洗膜,加入TREM2、Arg-1和iNOS 抗体,4℃过夜,洗膜,加二抗37℃孵育2 h,显影。内参蛋白为β-actin。
1.5 统计学分析
所有数据采用均数±标准差表示。采用SPSS 23.0软件进行统计学分析,组间比较采用单因素方差分析,LPS 组、低铅组、中铅组和高铅组与对照组比较,低铅+LPS 组、中铅+LPS 组和高铅+LPS 组与相应剂量的铅暴露组比较采用LSD-t检验。采用析因分析法探讨铅与LPS之间的关系。检验水准α=0.05。
2 结果
2.1 炎症因子TNF-α、IL-1β和IL-6的表达
与对照组相比,LPS 组、中铅组和高铅组皮质中TNF-α、IL-1β 和IL-6 表达均升高,低铅组TNF-α、IL-1β 表达升高(P<0.05)。与LPS 组相比,中铅+LPS组和高铅+LPS 组小鼠皮质中TNF-α、IL-1β 和IL-6 表达增加(P<0.05)。分别与低铅组、中铅组和高铅组相比,低铅+LPS组、中铅+LPS组、高铅+LPS组的TNF-α、IL-1β 和IL-6 表达均升高。结果见表2。析因分析研究结果显示,低铅、中铅、高铅与LPS 在TNF-α、IL-1β 和IL-6炎症因子中均不存在交互作用(P>0.05)。
表2 铅和LPS暴露对皮质中炎症因子的影响(±s,n=8)Table 2 Effects of lead and LPS exposures on inflammatorycytokines in the cortex of mice (±s,n=8) 单位(Unit):ng·g-1
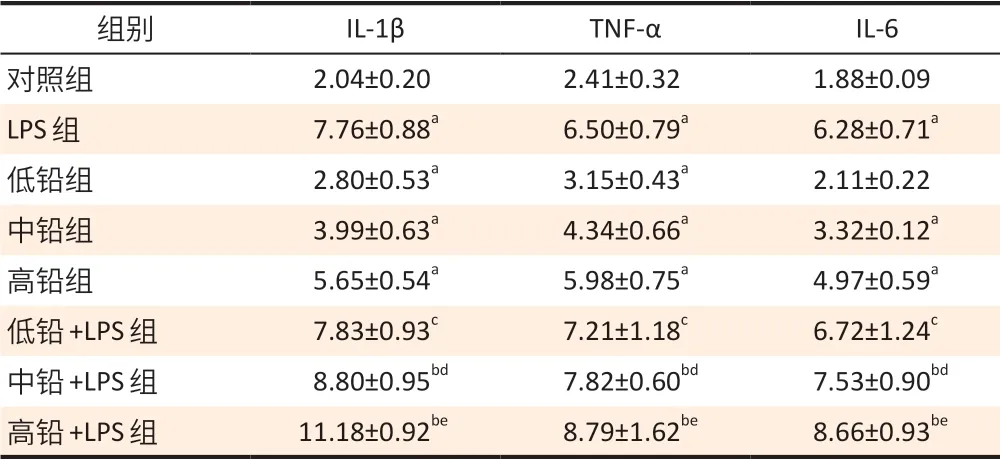
表2 铅和LPS暴露对皮质中炎症因子的影响(±s,n=8)Table 2 Effects of lead and LPS exposures on inflammatorycytokines in the cortex of mice (±s,n=8) 单位(Unit):ng·g-1
[注]a:与对照组比较,P<0.05;b:与LPS 组比较,P<0.05;c:与低铅组比较,P<0.05;d:与中铅组比较,P<0.05;e:与高铅组比较,P<0.05。中铅组的IL-1β 有2个异常值故剔除。
组别 IL-1β TNF-α IL-6对照组 2.04±0.20 2.41±0.32 1.88±0.09 LPS 组 7.76±0.88a 6.50±0.79a 6.28±0.71a低铅组 2.80±0.53a 3.15±0.43a 2.11±0.22中铅组 3.99±0.63a 4.34±0.66a 3.32±0.12a高铅组 5.65±0.54a 5.98±0.75a 4.97±0.59a低铅+LPS 组 7.83±0.93c 7.21±1.18c 6.72±1.24c中铅+LPS 组 8.80±0.95bd 7.82±0.60bd 7.53±0.90bd高铅+LPS 组 11.18±0.92be 8.79±1.62be 8.66±0.93be
2.2 iNOS、NOX2、CCR7 mRNA变化
与对照组相比,LPS 组、中铅组和高铅组小鼠皮质中iNOS、NOX2、CCR7mRNA 表达升高(P<0.05),低铅组中NOX2mRNA 表达也增加(P<0.05)。与LPS 组相比,中铅+LPS 组和高铅+LPS 组iNOS、NOX2、CCR7mRNA表达增加。与低铅组相比,低铅+LPS组中iNOS、NOX2mRNA 表达未见明显升高。与中铅组相比,中铅+LPS组iNOS、CCR7mRNA表达升高(P<0.05),NOX2未见明显变化。与高铅组相比,高铅+LPS 组iNOS、NOX2、CCR7mRNA表达均增加。结果见图1。
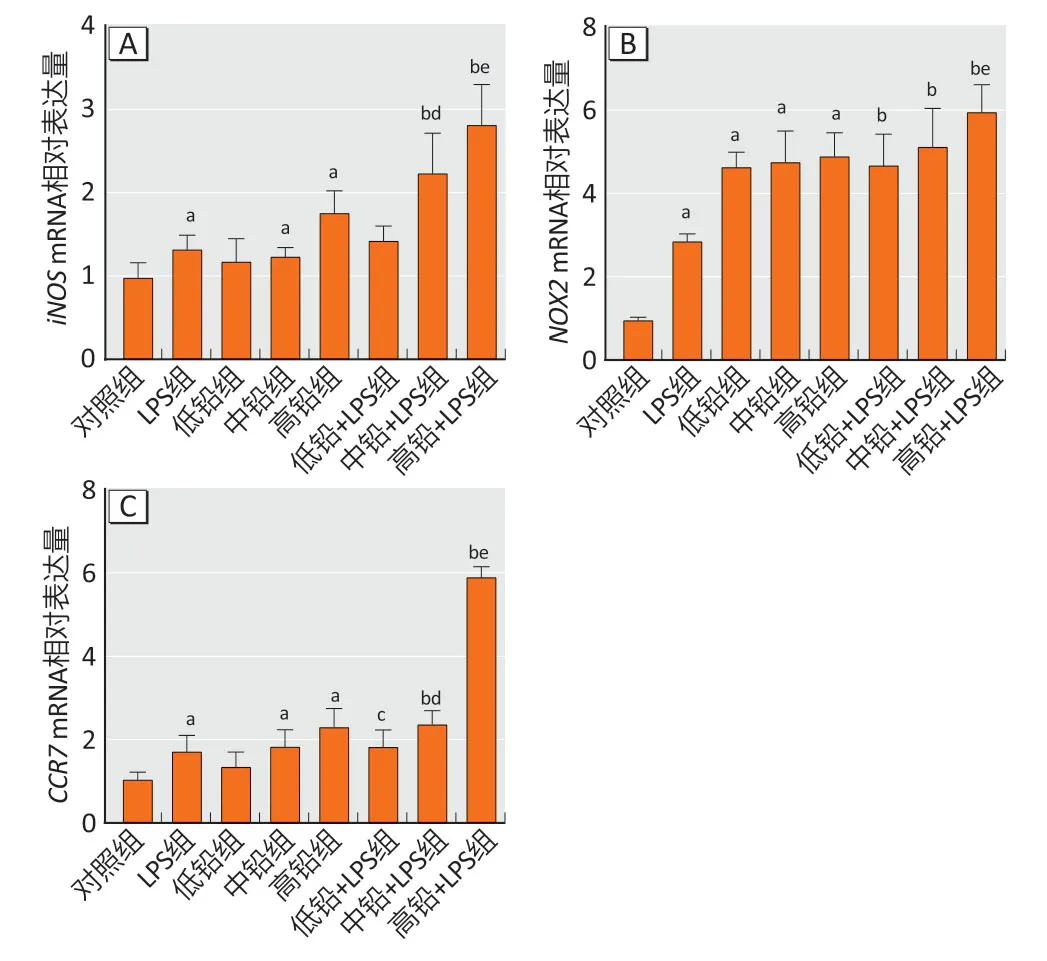
图1 各组小鼠皮质中M1 标志物iNOS(A)、NOX2(B)、CCR7(C) mRNA 表达情况(n=6)Figure 1 Expressions of M1 markers iNOS (A),NOX2 (B),and CCR7 (C) mRNA in the cortex of mice (n=6)
2.3 Arg-1、TGF-β、CCR2 mRNA变化
与对照组相比,低铅组Arg-1mRNA 表达未见明显变化,LPS 组、中铅组和高铅组Arg-1、TGF-β、CCR2mRNA 表达降低(P<0.05)。与LPS 组相比,中铅+LPS组和高铅+LPS 组中Arg-1mRNA 表达明显减少。与铅暴露组相比,铅和LPS 联合暴露组中Arg-1mRNA表达降低最为明显,未见TGF-β、CCR2mRNA 表达有明显差异。结果见图2。
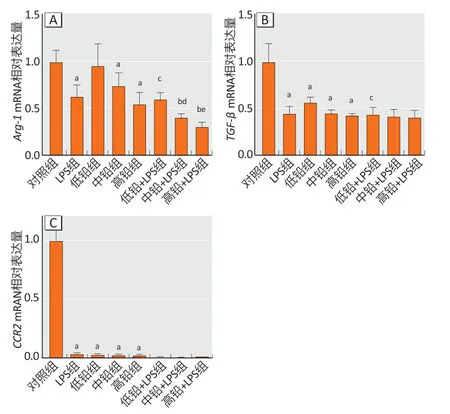
图2 各组小鼠皮质中M2 标志物Arg-1(A)、TGF-β(B)和CCR2(C)mRNA 表达情况(n=6)Figure 2 Expressions of M2 markers Arg-1 (A),TGF-β (B),and CCR2 (C)mRNA in the cortex of mice (n=6)
2.4 iNOS 和Arg-1蛋白变化
与对照组相比,铅暴露组iNOS 蛋白表达量升高;与LPS 组、同剂量铅暴露组相比,LPS 和铅联合暴露组中iNOS 蛋白表达量升高。与对照组相比,LPS 组和铅暴露组Arg-1蛋白表达降低(P<0.05);与LPS组相比,联合暴露组Arg-1 蛋白表达降低;与低铅组相比,低铅+LPS 组Arg-1蛋白表达明显减少,中铅+ LPS组和高铅+LPS 组差异无统计学意义。结果见图3。
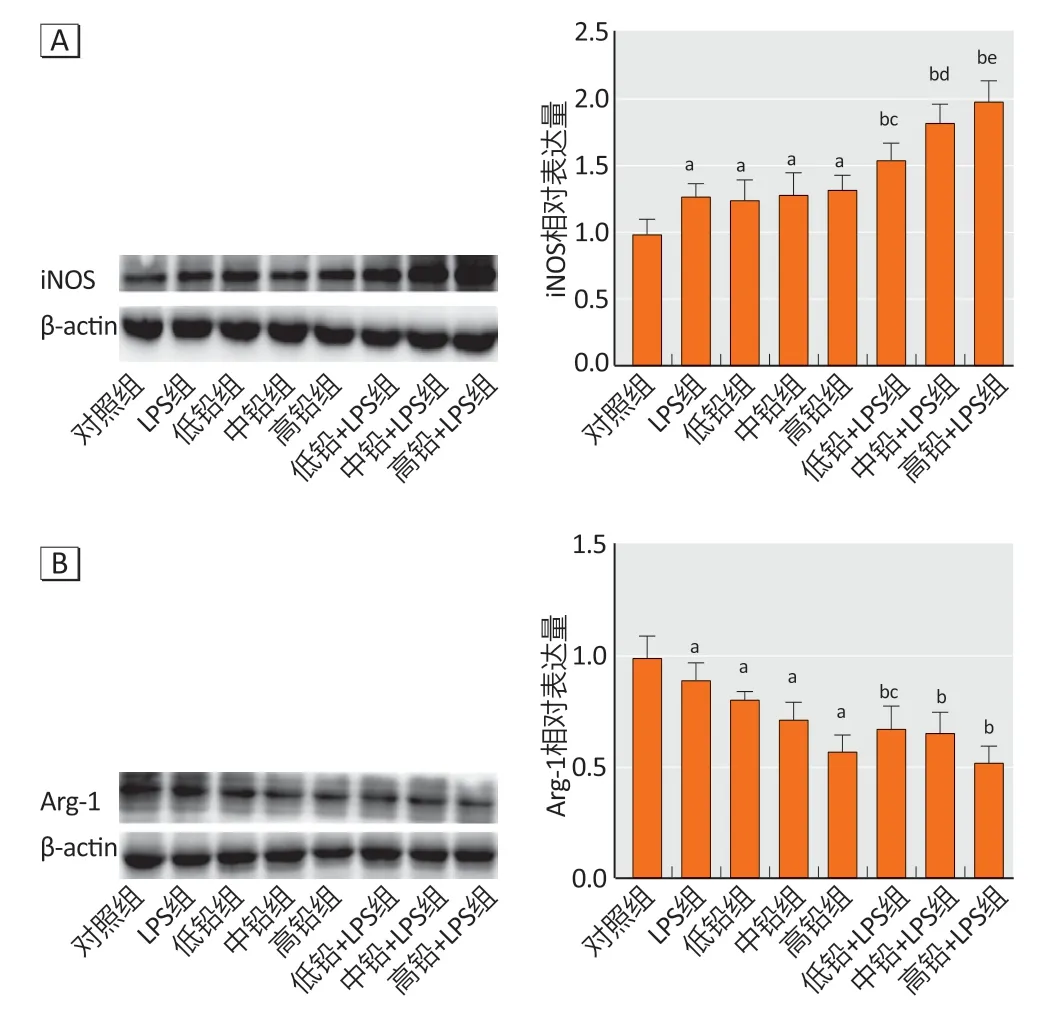
图3 各组小鼠皮质中iNOS(A)和Arg-1(B)蛋白表达(n=3)Figure 3 Expressions of iNOS (A) and Arg-1 (B) protein in the cortex of mice (n=3)
2.5 TREM2 mRNA 和蛋白表达
与对照组相比,LPS 组、低铅组、中铅组和高铅组TREM2mRNA 和蛋白表达降低(P<0.05)。与LPS 组相比,低铅+LPS、中铅+LPS 和高铅+LPS 组TREM2mRNA和蛋白表达降低明显。分别与低铅组、中铅组和高铅组相比,低铅+LPS、中铅+LPS、高铅+LPS 组TREM2mRNA和蛋白表达减少(P<0.05)。结果见图4。
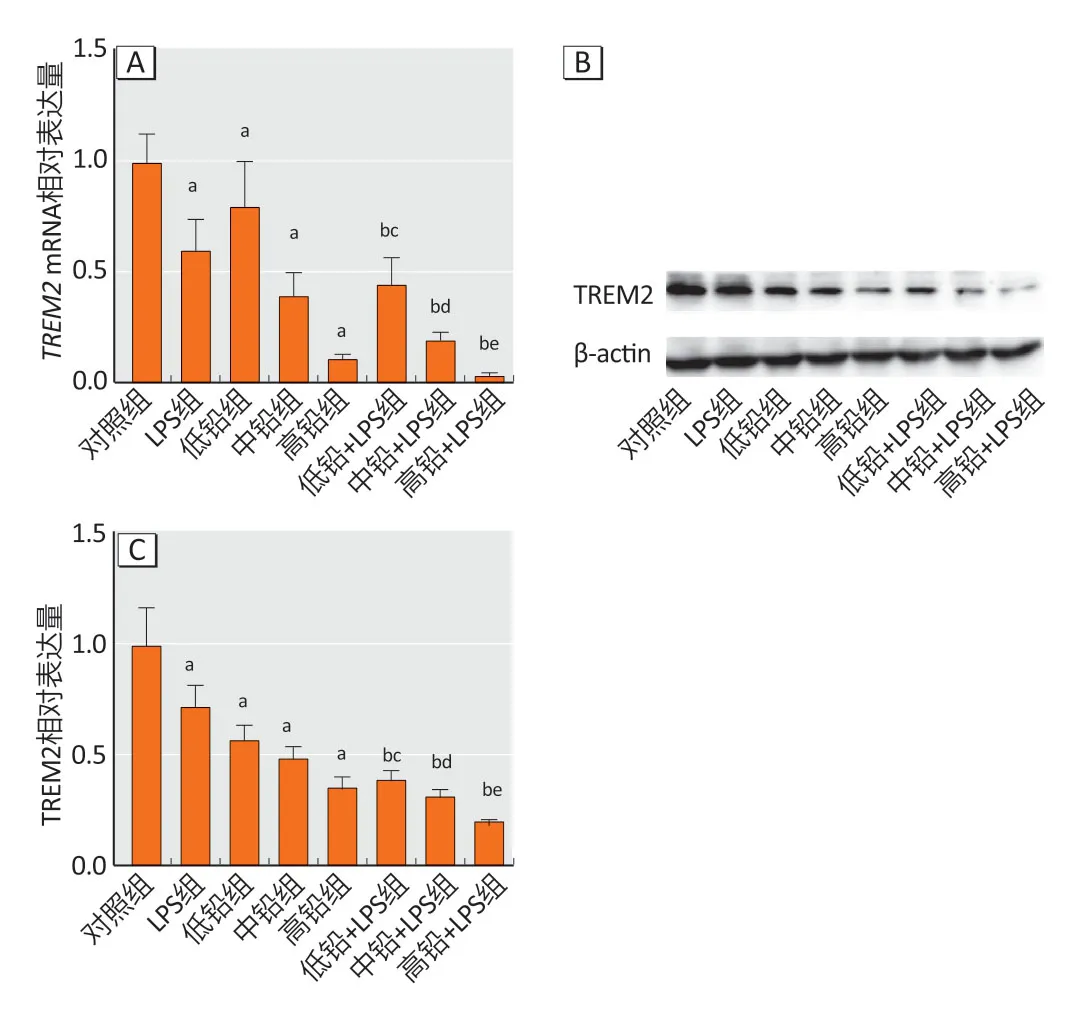
图4 各组小鼠皮质中TREM2 mRNA(A)和蛋白(B、C)表达Figure 4 Expressions of TREM2 mRNA (A) and protein (B and C)in the cortex of mice in each group
2.6 对皮质中miR-34a 表达的影响
与对照组相比,LPS 组、低铅组、中铅组和高铅组miR-34a表达升高(P<0.05)。与LPS 组相比,低铅+LPS 组、中铅+LPS 组和高铅+LPS 组miR-34a表达升高1.5倍多。分别与低铅组、中铅组和高铅组相比,低铅+LPS 组、中铅+LPS 组和高铅+LPS 组miR-34a表达增加。结果见图5。
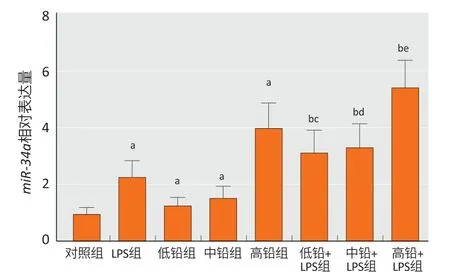
图5 各组小鼠皮质中miR-34a 表达情况(n=6)Figure 5 Expressions of miR-34a in the cortex of mice in each group (n=6)
3 讨论
中枢神经系统炎症以神经胶质细胞的异常激活和中枢系统微环境中炎症介质的存在为特征。神经炎症的特征为在脑组织中积累大量的炎症细胞因子TNF-α、IL-1β和IL-6等,这些炎症因子长期积累在大脑中可引发神经炎症级联反应,进而加速中枢神经系统的病变过程。TNF-α在脑组织中过度积累会损伤神经元,IL-1β可诱导小胶质细胞的活化,分泌TNF-α 和IL-6 等促炎因子,进一步引发神经炎症反应,加速脑损伤。本研究结果显示铅和LPS单独暴露后小鼠皮质中炎症因子TNF-α、IL-1β和IL-6表达均升高。这与胡蒙蒙等[11]研究中LPS暴露后脑组中TNF-α、IL-1β表达升高的结果是一致的。本研究结果还显示铅和LPS联合暴露后皮质中炎症因子TNF-α、IL-1β和IL-6表达高于单独暴露组,提示铅和LPS联合暴露加剧了神经炎症损伤。
小胶质细胞是中枢神经炎症反应的重要招募者和执行者。在健康的大脑中,小胶质细胞表现出“稳态”表型,其表达表面分子和分泌可溶性因子影响其他神经细胞,促进细胞碎片和聚集蛋白的清除,维持中枢神经系统稳态。但外环境发生改变时或者刺激反应发生时,小胶质细胞表型可由稳态(M0)型转变为M1或者M2。在疾病的不同发展阶段,小胶质细胞对外界刺激的反应在炎症、组织修复、突触可塑性及神经再生中起着不同的作用[12]。在神经退行性病变中,小胶质细胞呈M1型,释放炎症介质,诱导神经元丢失。M1型小胶质细胞增加,可促进神经退行性疾病如阿尔茨海默病、帕金森病的发生发展[13-14]。有研究显示铅和LPS可以引起小胶质细胞活化[2,4],促进小胶质细胞向M1型极化,释放出大量炎症细胞因子、抗炎因子、趋化因子、生长因素等,维持中枢神经系统的慢性炎症[15-16],本研究结果显示,中剂量铅(0.50 g·L-1)和高剂量铅(1.00 g·L-1) 以及LPS单独暴露后,M1型标志基因和iNOS蛋白表达增加,而M2 标志基因和Arg-1 蛋白表达下降;这与Li等[17]的研究中LPS处理原代小胶质细胞后呈M1型,iNOS、IL-1β等表达增加的结果一致。而铅和LPS联合暴露与单独暴露相比,M1型小胶质细胞标志物升高,M2型标志物明显降低,推测铅和LPS联合暴露加剧了小胶细胞向M1型转变,进而加剧神经炎症。
小胶质细胞极化受到TREM2 等关键蛋白的调控。TREM2 仅表达于小胶质细胞上,且在神经退行性病变不同阶段发挥不同作用[18]。有研究显示TREM2 在M2 型小胶质细胞上表达升高,而在M1 型小胶质细胞上表达降低,且上调TREM2 的表达促进小胶质细胞向M2 型转变,而下调TREM2 促进小胶质细胞向M1 型转变。在本研究中,LPS和铅单独暴露后,皮质中TREM2mRNA和蛋白表达下降;铅和LPS联合暴露后TREM2表达更加降低。推测在铅和LPS暴露后TREM2调控小胶质细胞向M1极化,而且铅和LPS联合暴露加剧了极化程度,加速了神经炎症的发生。这与伍敏[19]的研究中LPS 刺激后TREM2 表达下降,BV-2 细胞M1标志物表达增加一致。TREM2 的表达受到非编码RNA的调控,本研究中铅和LPS 单独暴露可使miR-34a表达量升高,且联合暴露后miR-34a表达明显增加,推测铅和LPS 暴露后miR-34a增加,从而调控TREM2 的表达下降。这Bhattacharjee 等[20]的研究在老年性黄斑变性中miR-34a靶向TREM2 mRNA 3’非编码区,并下调小胶质细胞中TREM2 的发现一致。
综上所述,铅和LPS 联合暴露后小鼠炎症损伤加剧,小胶质细胞M1 标志物表达增加,小胶质细胞可能向M1 极化,推测其机制可能与miR-34a表达升高和TREM2表达降低有关。
