基于EEM与PCR-DGGE技术分析温度对蚯蚓堆肥处理城镇污泥的影响
2021-08-07侯素霞雷旭阳张辉丁淑杰崔广宇
侯素霞,雷旭阳*,张辉,丁淑杰,崔广宇
1.邢台职业技术学院资源与环境工程系,河北 邢台 054000;2.同济大学污染控制与资源化研究国家重点实验室,上海 200092
蚯蚓堆肥作为一种环境友好的、可持续的安全生物处理技术逐渐被我们所熟知(Elvira et al.,1997;Kuzyakov et al.,2000;Castillo et al.,2013)。在前期的研究中发现,蚯蚓能够显著加快城镇脱水污泥中有机质的降解速率(陈学民等,2010a;陈学民等,2010b;陈学民等,2010c);将污泥造粒后,能为蚯蚓提供适宜的生存环境(Fu et al.,2015a),并显著提高堆肥产物稳定化程度(伏小勇等,2015)。在蚯蚓堆肥过程中,微生物对基质中有机质降解起着重要作用,而蚯蚓的介入会对微生物的数量及种群结构产生影响(Munnoli et al.,2015)。在蚯蚓处理猪粪系统中,细菌、真菌的微生物种群多样性均下降(Gómez-Brandón et al.,2011),而以牛粪混合树叶作为蚯蚓堆肥基质发现,蚯蚓的存在丰富了系统中微生物种群多样性(Yakushev et al.,2009)。此外,Fu et al.(2015b)通过研究蚯蚓处理不同粒径的颗粒污泥发现,随着两种粒径堆肥系统中矿化程度升高,细菌多样性降低,而真核微生物多样性升高。因此,蚯蚓堆肥基质和实验条件与系统微生物种群多样性关系密切(Koubová et al.,2015)。
温度作为堆肥过程中诸多环境影响因子中较容易控制的因素之一,不但对蚯蚓的生长繁殖以及代谢活性有着巨大影响,对微生物代谢活性以及种群结构的影响也极为突出(曹先艳等,2008;郭昱廷等,2012)。在 15—25 ℃范围内,赤子爱胜蚓(Eisenia foetida)在颗粒污泥基质中表现出较好的适应性,温度升高能够加快蚯蚓堆肥的稳定化速率,且在25 ℃下系统稳定化程度远高于15、20 ℃(陈学民等,2016),这可能是由于系统中微生物种群结构发生改变,导致系统稳定程度产生了差异,然而目前鲜有报道。
本文利用三维荧光光谱(EEM)探讨了系统中溶解有机质(DOM)的变化规律;继而通过PCRDGGE技术和测序手段研究不同温度条件下蚯蚓堆肥微生物种群结构的差异,为蚯蚓处理城镇污泥补充理论依据。
1 实验材料与方法
1.1 实验材料
实验所用赤子爱胜蚓(Eisenia foetida)为实验室培养。实验所用污泥为兰州市七里河污水处理厂脱水污泥,将其制成5 mm粒径的颗粒,实验用泥开始和堆肥结束时理化、生化指标见表1。

表1 实验用泥开始和结束时理化、生化指标Table 1 Physicochemical parameters of the initial substrate and the composting products
实验分为3组,每组3个平行。每个平行反应器中加入4 kg颗粒污泥和100条蚯蚓,每条蚯蚓重约1.0 g。将3组反应器置于恒温培养箱中,并分别维持在 (15±1)、(20±1)、(25±1) ℃实验环境下,每天人工翻动一次。实验期间用塑料薄膜保湿、深色覆盖物避光。实验进行了60 d,分别在第0、10、30、60天采样一次,分为两部分,一部分鲜样进行阴干、研磨,过100目筛(孔径为0.15 mm)、装聚乙烯袋保持备用;另一部分鲜样在−40 ℃保存做分子生物学实验。
1.2 测定方法
1.2.1 三维荧光光谱分析
取阴干、研磨后的样品,以去离子水为浸提剂,将样品与去离子水以质量比1∶20混合,震荡24 h后离心,过0.45 μm滤膜后保存,采用日立F-7000型荧光光度仪进行三维荧光光谱分析。测定条件:电压为700 V,激发波长(λEx)250—550 nm,步长5 nm;狭缝宽度5 nm;扫描速度2400 nm·min−1。其中:类络氨酸、类色氨酸(Ex:220—250 nm/Em:285—380 nm);类富里酸(Ex:220—250 nm/Em:>380 nm);类胡敏酸(Ex:>310 nm/Em:>380 nm);类蛋白质(Ex:>250 nm/Em:<380 nm)。
1.2.2 DNA的提取及PCR扩增
取冷冻污泥 0.3 g室温下解冻,用强力土壤DNA提取试剂盒(美国,MOBIO)提取DNA,并将提取好的DNA用超纯水稀释20倍,以做后续扩增 实 验 。16S rDNA 的 引 物 为 341f(5′-CCTACGGGAGGCAGCAG-3′),所带 GC夹子为(5′-CGCCCGCCGCGCGCGGCGGGCGGGGCGGG GCACGGGGGG-3′),907r(5′-CCGTCAATTCCTTT GAGTTT-3′);18S rDNA 的引物为 Fung(5′-ATTCCCCGTTACCCGTTG-3′),所带 GC夹子为( 5′-CGCCCGCCGCGCCCCGCGCCCGGCCCGCC GCCCCCGCCCC-3′),NS1(5′-GTAGTCATATGCTT GTCTC-3′)(Huang et al.,2014;Chen et al.,2015)。50 μL 扩增体系:DNA 模板 1 μL,10×Taq buffer 5 μL,dNTP Mixture 4 μL,前引物(20 μM)0.5 μL,后引物(20 μM)0.5 μL,BSA(5 g·kg−1)1 μL,Ex Taq 0.25 μL,超纯水 37.75 μL,同时做不加 DNA 模板的空白对照。将上述反应液在TP600 PCR仪(日本TaKaRa)扩增。16S rDNA扩增条件:预变性95 ℃(10 min),35 个循环(95 ℃ 30 s,57 ℃ 30 s,72 ℃ 40 s),延伸72 ℃(10 min)。18S rDNA扩增条件:94 ℃(10 min),30个循环(94 ℃ 30 s,50 ℃30 s,68 ℃ 60 s),延伸 68 ℃(10 min),用质量分数为1.2%的琼脂糖电泳检测扩增效果。
1.2.3 变性梯度凝胶电泳(Denatured gradient gel electrophoresis,DGGE)及测序
用DcodeTM system(美国Bio-Rad)扩增PCR产物。电泳条件:质量分数为6%聚丙烯酰胺凝胶,16S rDNA变性梯度(ω尿素/ω甲酰胺)为35%—60%,电压80 V,时间16 h;18S rDNA变性梯度(ω尿素/ω甲酰胺)为25%—40%,电压60 V,时间20 h。电泳结束后的胶用 Andy Gold TM Nucleic Acid GelStain(美国Andy)染色30 min,于凝胶成像仪(上海培清JS-2012)拍照。
1.3 数据处理
1.3.1 微生物种群多样性的计算方法
DGGE指纹图谱中条带的数目、亮度及迁移位置反映了基质中微生物种群的多样性及丰度。各泳道条带的迁移情况分为4种:出现、加强、消失、减弱。不同位置的条带代表不同的微生物类群,条带越多表明微生物种群多样性越高。而同一水平位置的条带代表同一微生物种群,条带的亮暗程度则反映该类微生物的相对数量。根据DGGE图谱中条带的位置、数量及亮暗程度,通过quantity one软件处理后,得出微生物种群结构 Shannon-Wiener指数。Shannon-Wiener指数又称香浓指数(H′),被用来对各样品微生物的多样性进行评价。计算公式如下:

式中:pi=ni/N;ni为峰面积,N为所有峰的总面积;E反映微生物种群的均匀程度;S是某个样品中所有条带数目总和。
1.3.2 DGGE条带的序列测定及系统发育树的构建
将清晰单一的条带进行切割,溶于80 μL超纯水中,4 ℃放置24 h。继续PCR扩增,DGGE电泳,切胶,直到条带清晰并单一。用不含GC夹子的引物对341f-907r、Fung-NS1进行PCR扩增,产物加ExoSAP-IT®试剂(美国Affymetrix)纯化,纯化条件为37 ℃(45 min),80 ℃(15 min),并提交测序公司测序(上海生工)。利用Chromas软件对测序结果中的图谱文件进行分析,筛选测序结果。将筛选出的目标序列利用NCBI网站上BLAST程序与GenBank中已有序列进行同源性比较,下载具有代表性的同源性较高的序列,并利用 MEGA 5.0软件中的邻接算法(Neighbor-joining method)构建系统发育树。
1.3.3 DGGE指纹图谱的主成分(PCA)分析图
使用Quantity One软件对DGGE指纹图谱进行计算,然后使用statistics 10.0对3个温度组中各条带的pi值进行主成分分析(PCA)。
2 结果与分析
2.1 不同温度组DOM的光谱特征变化情况
溶解性有机质(DOM),在堆肥过程中可利用其判断堆肥的腐熟程度(陆彦宇,2017;单光春,2018),因此为了考察温度对蚯蚓堆肥处理城镇污泥的影响,本实验对3个温度组分别在0、10、30、60 d的DOM进行分析,结果如图1所示。
DOM 的组分主要是由腐殖质(包括腐殖酸HA、富里酸FA)和一些亲水性有机酸、氨基酸、碳水化合物、表面活性剂以及多环芳烃类等物质组成(何小松等,2010;管茂全等,2013)。由图1可知,初始污泥组中可以分为4个峰区,其中Peak A的波长范围Ex/Em:225/325 nm,为芳香类蛋白质,主要与微生物的活动有关;PeakB的波长范围Ex/Em:275/340 nm,主要为溶解性微生物产物;Peak C和Peak D的波长范围分别为Ex/Em:275/450 nm、Ex/Em:350/430 nm,均为腐殖酸类物质(李海青等,2020)。

图1 堆体不同阶段DOM的EEM谱图Fig.1 EEM spectra of DOM at different stages
随着时间的推移,Peak A、Peak B的峰区一直存在但强度和面积均逐渐变弱,说明系统中一直存在芳香类蛋白质并一直在被利用和降解并未消失,这是因为蚯蚓的存在能够促进系统中可溶性有机质的降解,随着时间的推移,蚯蚓堆肥系统中微生物量逐渐降低,导致可溶性代谢产物的减少。初始污泥中 Peak C和 Peak D峰区的强度和面积弱于Peak A、Peak B,表明城镇污泥中DOM主要是以芳香类蛋白质和微生物代谢产物为主。在堆肥30 d时Peak C和Peak D峰区消失,表明系统中腐殖酸类物质基本被降解完。前人的研究发现,高温堆肥接近尾声时,系统中会产生大量的腐殖酸,这与堆肥系统中含有大量的木质素有关(陈迪等,2015)。本研究所用基质为城镇市政污泥,木质素含量较少,且蚯蚓的存在可能有利于腐殖质的分解,因此与前人研究并不矛盾。在同一时期,系统随着温度的提高,峰区强度与面积均出现缩小趋势,表明随着温度的升高,蚯蚓吞食和系统内的微生物的协同增效作用能够加快系统中DOM的降解效率,提高系统的矿化程度,促进系统的稳定化进程(陈学民等,2016)。
2.2 微生物种群多样性分析
3个温度条件下的16S rDNA和18S rDNA种群DGGE指纹图谱见图2,Shannon-Wiener指数见图3。由图2-A可知,16S rDNA指纹图谱中条带1、3、4、5、6、8、9、10、12、14、16、17、18、19、21、22、23、25、26共存于3个温度组中。条带2、7、11、13、27仅存在15 ℃组、20 ℃组;条带15、20、24仅存在于25 ℃组。图2B显示,18S rDNA指纹图谱中条带6、7、8、9、10、11、12、13、17均存在于3个温度组中,条带1、2仅存在15 ℃组;条带16存在15 ℃组和20 ℃组;条带15存在20 ℃组和25 ℃组;条带3、4、5、14仅存在25 ℃组。图3可知,细菌和真核微生物Shannon-winter 指数在 15 ℃组和 20 ℃组之间均无明显差异,25 ℃组细菌的Shannon-Wiener指数低于15 ℃组、20 ℃组,而25 ℃组真核微生物高于15 ℃组、20 ℃组。

图2 16S rDNA(A)和18S rDNA(B)的DGGE指纹图谱Fig.2 DGGE fingerprint and its schematic representation of 16S rDNA(A) and 18S rDNA(B) at three different temperature conditions

图3 不同温度16S rDNA和18S rDNA的DGGE指纹图谱Shannon-Wiener指数Fig.3 Shannon-Wiener index of biodiversity on 16S rDNA and 18S rDNA at three different temperature conditions
2.3 微生物种群主成分分析(PCA)
通过计算各条带的 pi值,对 3个温度组 16S rDNA和18S rDNA的DGGE指纹图谱中各条带进行主成分分析(PCA)见图 4,样品之间的距离代表它们的差异大小。

图4 16S rDNA(a)和18S rDNA(b)的DGGE指纹图谱PCA分析图Fig.4 Principal components analysis of the microbial community on 16S rDNA (a) and 18S rDNA (b)
16S rDNA的DGGE图谱PCA分析得出,第一主成分(PC1)与第二主成分(PC2)的累积方差贡献率达到 95.19%。其中第一主成分的贡献率为61.47%;第二主成分的贡献率为33.72%。第一主成分中15 ℃组和20 ℃组载荷均在0.95以上,表明第一主成分主要与 15 ℃组和 20 ℃组有关。第二主成分中25 ℃组载荷在0.95以上,表明第二主成分主要与25 ℃组有关。
18S rDNA的DGGE图谱PCA分析得出,第一主成分(PC1)与第二主成分(PC2)的累积方差贡献率达到 98.63%。其中第一主成分的贡献率为85.15%;第二主成分的贡献率为13.48%。15 ℃组、20 ℃组和25 ℃组在第一主成分中载荷均在0.9以上,而在第二主成分中的载荷均低于0.5,表明第一主成分与3个温度组均有关,第二主成分与3个温度组的关联较低。
2.4 微生物种群基因测序
将16S rDNA和18S rDNA的DGGE图谱中特异性条带进行测序,把得到的序列与GenBank数据库中已有序列进行比对分析,获得各个序列的同源性信息,构建系统发育树(图5和图6)。16S rDNA的 DGGE图谱中特异性条带 1、3、4、6、7、8、12、21、25所对应微生物与近源微生物的相似度关系分属4个门:拟杆菌门(Bacteroidetes)、绿菌门(Chlorobi)、酸杆菌门(Acidobacteria)、变形菌门(Proteobacteria)。18S rDNA的DGGE图谱中特异性条带7、8、9、10、11、13所对应微生物与近源微生物的相似度关系分为真菌界(Fungi)和原生动物界(Protozoa)。

图5 16S rDNA的DGGE图谱系统发育树Fig.5 Neighbour-joining tree of partial 16S rDNA gene sequences from DGGE image
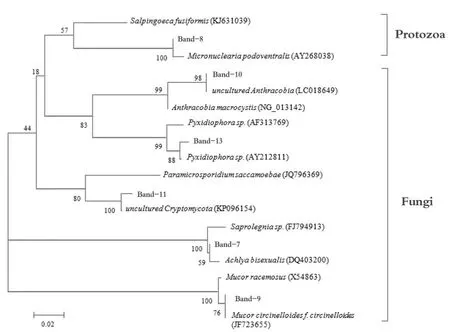
图6 18S rDNA的DGGE图谱系统发育树Fig.6 Neighbour-joining tree of partial 18S rDNA gene sequences from DGGE image
2.5 讨论
从理论上讲,DGGE图谱中的条带代表一个微生物类群,条带的有无及明暗程度,可判断各样品中微生物种群结构及菌种的相对数量。表1和图1显示,25 ℃组系统有机质的降解速率、矿化程度高于15 ℃和20 ℃组。由图2、3可知,25 ℃组细菌种群多样性低于15 ℃组、20 ℃组,而真核微生物种群多样性高于15 ℃组、20 ℃组,这可能由于温度高强化了蚯蚓和微生物对基质的降解和同化作用(韩雅莉,1993;孙振钧等,2004),腐殖质含量降低,仅剩下稳定的芳香族类物质,营养物质单一、矿化程度升高,导致了细菌种群多样性降低,而真核微生物种群多样性升高。
从图4可以看出,15 ℃组与20 ℃组的微生物种群结构略有差异,但种群类别完全相同,差异主要体现在微生物种群的相对数量有所不同。同时,15 ℃组、20 ℃组的细菌种群结构与 25 ℃组差异性较大,这是由于个别微生物种群类别的出现和消失以及共有微生物种群的相对数量不同所致。16S rDNA的DGGE指纹图谱PCA分析结果显示,3个温度组共有条带数均占各温度组总条带数的 79%以上,除条带3、4、6、8外,其他共有条带均集中在原点附近,表面3个温度组中主要细菌种群类别并未出现较大差异,这可能与3个温度组的系统中DOM的主要成分有关。18S rDNA的DGGE指纹图谱PCA分析结果显示,3个温度组的真核微生物种群结构之间均存在差异,但相邻温度的两组之间差异较小,并且共有条带数分别占3个温度组总条带数的75%、82%、64%,表明15 ℃、20 ℃组的真核微生物种群类别与25 ℃组差异性较大。此外,条带8对3个温度组的贡献均较高,条带9对15 ℃组贡献较大,条带13对20 ℃组、25 ℃贡献较高。综上可知,蚯蚓堆肥系统中微生物种群对于温度的改变存在缓冲区间,当温度在 15—20 ℃范围内变化时,系统中微生物种群类别及结构差异较小;而当温度接近 25 ℃时则会对系统中微生物种群类别及结构产生影响,造成这种结果的原因可能与25 ℃组的有机质含量显著低于15 ℃组和20 ℃组有关。
图5显示,系统中共有的细菌种群有条带3、4、6、7、8、21属于拟杆菌门,是蚯蚓堆肥中存在的主要细菌门类(Danon et al.,2008),也是活性污泥法和生物膜法水处理工艺系统中的优势细菌(Wagner et al.,2002),并且对纤维素、几丁质等难降解大分子有机物具有较强的降解能力(Li et al.,2013a;Li et al.,2013b)。条带1和12分别为绿菌门和酸杆菌门均属于厌氧菌,绿菌门具有固氮作用,能够利用各种形式的碳素和氮素作为自己的碳源和氮源,为某些异养微生物提供有机氮源(Keppen et al.,2008);而酸杆菌门微生物能够降解多种有机物质,从简单的糖类到复杂的半纤维素等都具有降解能力(Ward et al.,2009)。以上条带所对应的微生物对 25 ℃组的贡献度均高于 15 ℃组和20 ℃组。此外,条带25属于变形菌门,且属于γ变形菌门(Gammaproteobacteria)中的黄单胞菌(Xanthomonadaceae),专性好氧,是一种植物病原菌,在3个温度组的相对数量均较低。图6显示,系统共有的真核微生物种群有条带10、11、13属于子囊菌门(Ascomycota),对木质素及纤维素等具有较强降解能力(Guillén et al.,2005;Baldrian et al.,2008),对3个温度组均有贡献。条带7对应的微生物为两性绵酶菌(Achlya bisexualis),属于水霉目的一类霉菌,常在活性污泥法水处理工艺系统中发现(Matsunaga et al.,2014),对3个温度组的贡献均较弱。条带9属于毛霉菌(Mucorales)是一类典型的木质素、纤维素降解菌,能够分泌完整的纤维素降解酶(Saha,2004;Karimi et al.,2013),对 15 ℃组贡献较大。条带 8对应的无根虫门(Apusozoa)属于原生动物,目前对于其功能报道较少,然而该类微生物对3个温度组的贡献均较高,表明此时的系统环境适合其生存,无根虫门可能对于系统稳定化起到积极作用。
温度可以直接或间接地改变蚯蚓和微生物的活性,从而对蚯蚓堆肥基质的性质产生影响,这种影响反馈到微生物种群结构,使其发生改变更加适应环境。因此,堆肥结束时系统较为稳定,系统中主要是以降解纤维素、几丁质等难降解有机质为主的拟杆菌门和子囊菌门为优势种群,且温度高,相对数量多,系统中易利用有机质所占比小大,系统更稳定。
3 结论
(1)DOM的三维荧光分析表明,随着温度的提高,蚯蚓堆肥可以充分降解利用城镇污泥中的腐殖酸类有机质,促进系统腐熟程度,增加其稳定化效率。
(2)蚯蚓处理城镇污泥系统中的微生物种群结构对 15—20 ℃的温度条件反应不敏感,细菌和真核微生物的种群多样性差异均较小。温度为 25 ℃时,系统中细菌种群多样性降低,真核微生物种群多样性升高。
(3)堆肥结束时,3个温度组系统中均以拟杆菌门和子囊菌门为优势种群,且温度越高,拟杆菌门微生物和子囊菌门微生物的相对数量越多,系统中易利用有机质所占比重越小,系统更加稳定。
