基于质量源于生产的广藿香质量标志物的确立
2021-08-05荆文光郭晓晗程显隆马双成
荆文光,郭晓晗,李 楚,2,程显隆,马双成*,魏 锋*
1.中国食品药品检定研究院,北京 100050
2.北京中医药大学中药学院,北京 102488
广藿香为唇形科植物广藿香Pogostemon cablin(Blanco) Benth.的干燥地上部分,原产于东南亚一带,后在我国岭南地区引种成功,现主产于我国广东、海南、广西等省区,具有芳香化浊、和中止呕、发表解暑的功效,是藿香正气水、抗病毒口服液、霍胆丸等中成药重要的原料之一[1]。
在众多本草典籍中,广藿香药用部位为叶,李时珍《本草纲目》为藿香释名曰:“豆叶曰藿,其叶似之,故名”,并详述藿香性状及药用部位的应用变迁“方茎有节中虚,叶微似茄叶。洁古、东垣惟用其叶,不用枝梗。今人并枝梗用之,因叶多伪故耳”。由此可见,广藿香叶的使用对于临床药效的发挥至关重要,广藿香质量评价也多以叶多、杂质少,香气浓者为佳。《中国药典》2020年版一部广藿香标准中检查项规定叶不得少于20%,饮片炮制要求 “除去残根和杂质,先抖下叶,筛净另放;茎洗净,润透,切段,晒干,再与叶混匀。”但饮片标准中,并未延续药材标准控制叶比例,也没有百秋李醇的含量测定项,标准检验项目缺失较多,无法合理控制饮片质量。
由于广藿香挥发油多集在叶中,且为重要的香水和藿香正气类中成药生产用原料,因此,广藿香叶多单独采集用于提取挥发油,导致加入饮片生产中的广藿香叶明显不足,存在不规范生产的现象,严重影响广藿香饮片的质量。对于广藿香的质量控制,李小琪等[2]采用一测多评法同时测定广藿香中4 种挥发性成分;毕丹等[3]采用超高效液相色谱法同时测定广藿香中6 个成分的含量;Li 等[4]采用HPLC-DAD 测定了广藿香中9 种成分,结果均显示不同批次广藿香药材中所测定的挥发性和非挥发性成分的含量存在较大差异;张洪坤等[5]从广藿香标准汤剂HPLC 指纹图谱的聚类分析和判别分析研究入手,对广藿香不同产地进行了判别分析,这些为广藿香的质量评价奠定了基础,但以上研究均未说明哪些成分是广藿香叶区别于其茎梗的差异性标志成分,因此也无法从生产规范性角度解决现有广藿香饮片中广藿香叶比例偏低的问题。
中药质量标志物(quality markers,Q-Marker)最早由刘昌孝院士提出[6-7],其在现有质量评价与控制方法基础上,从质量要素的传递与溯源、化学成分与药性药效2 方面的关系、基于植物亲缘学及生源途径的成分特有性分析等角度,提出以中药Q- Marker 研究为核心的中药质量评价模式[8-9]。通过对复方丹参制剂中丹参、三七药材[10-12]、延胡索[13]、元胡止痛滴丸[14]、益母草和赶黄草[15]的Q-Marker进行了深入的研究,详细阐述了Q-Marker 的研究路径。郝敏等[16]认为应针对不同的中药产品针对性地制定质量标准更为科学合理,提出了基于中药Q- Marker 的饮片质量控制研究思路。刘晓娜等[17]从中药质量的整体性和功效的特异性属性角度出发,提出了一种着重体现元素Q-Marker 的研究思路。
Q-Marker 的出现为中药质量评价提供多种思路和方法,但中药质量特别是作为原料的中药材质量的形成过程是一个复杂的体系,有别于一般产品,其质量属性禀赋于人工和天然2 部分因素:从人工的角度,和所有产品一样,中药材的质量源于生产(quality by production,QbP),过程控制和生产(种植/养殖)规范性是质量的保证;从天然的角度,中药材的质量受产地环境的影响极大,因而有“道地药材”之称,基于此,本课题组提出了道地性和生产规范性是中药材质量形成的关键[18]。而对于部分中药饮片在原料道地性未知的情况下,保证生产规范性尤为重要,理清饮片质量属性形成过程中的关键因素,充分挖掘能够体现生产规范性的关键Q-Marker,亦是保证饮片质量的关键内容。本实验基于QbP 的理念,利用指纹图谱结合化学计量学、多成分含量测定等方法,筛选出能够体现广藿香饮片生产规范性的关键Q-Marker,为保证广藿香饮片质量、提升饮片标准奠定基础。
1 仪器与材料
Acquity H-Class 型超高效液相色谱仪,美国Waters 公司;Waters e2695 高效液相色谱仪,美国Waters 公司,Empower 3 工作站;Agilent 7890B 气相色谱仪,Agilent 公司;AE240 型十万分之一电子天平,梅特勒-托利多仪器(上海)有限公司;LX220ASCS 型万分之一电子天平,普利赛斯国际贸易(上海)有限公司;101-1AB 型电热鼓风干燥箱,天津市泰斯特仪器有限公司;KQ-500E 超声波清洗器,昆山市超声仪器有限公司。
对照品百秋李醇(批号110772-201909)、广藿香酮(批号111822-201904)、毛蕊花糖苷(批号111530-201713)购自中国食品药品检定研究院;对照品新西兰牡荆苷(批号P01F9F54173)、异毛蕊花糖苷(批号W17J10C90785)、藿香黄酮醇(批号P18A11S111514 )、 雷 杜 辛 黄 酮 醇( 批 号P30A10S87217)购自上海源叶生物科技有限公司;对照品鼠李素(批号20012029)购自上海同田科技股份有限公司;各对照品质量分数均>98.0%。
广藿香饮片样品来源于药材市场、饮片企业和医院,共计59 批,详细信息见表1。无水乙醇、二氯甲烷、醋酸乙酯、石油醚、正己烷均为国药集团化学试剂有限公司,分析纯;水为屈臣氏纯净水;乙腈、甲醇为色谱纯来自Fisher 公司。
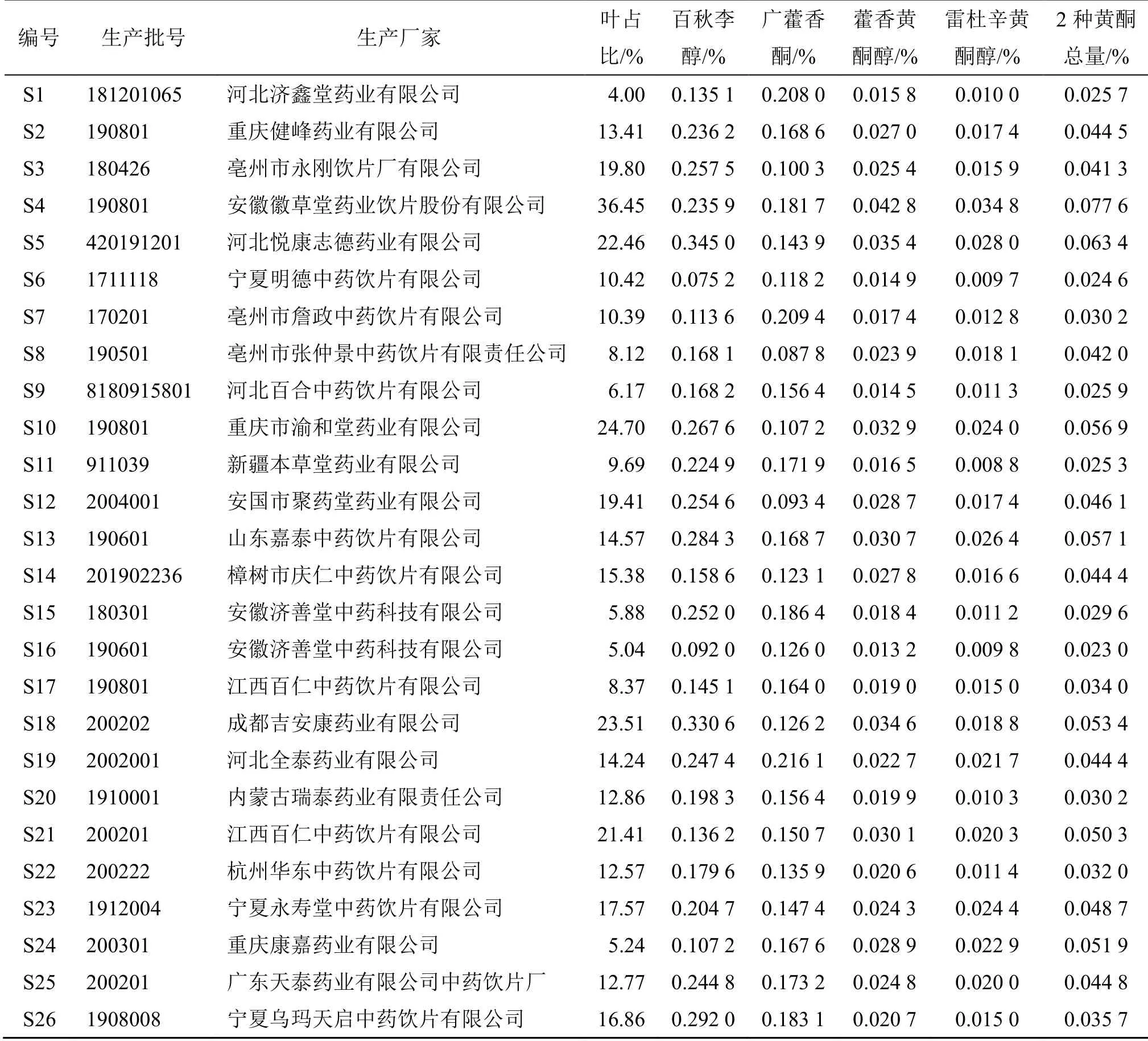
表1 59 批广藿香饮片的来源信息、叶占比及百秋李醇、广藿香酮、藿香黄酮醇、雷杜辛黄酮醇含量测定结果 (n = 2)Table 1 Source informations, PCL ratio of 59 batches of PH pieces and contents of patchouli alcohol, pogoston, pachypodol and retusin (n = 2)
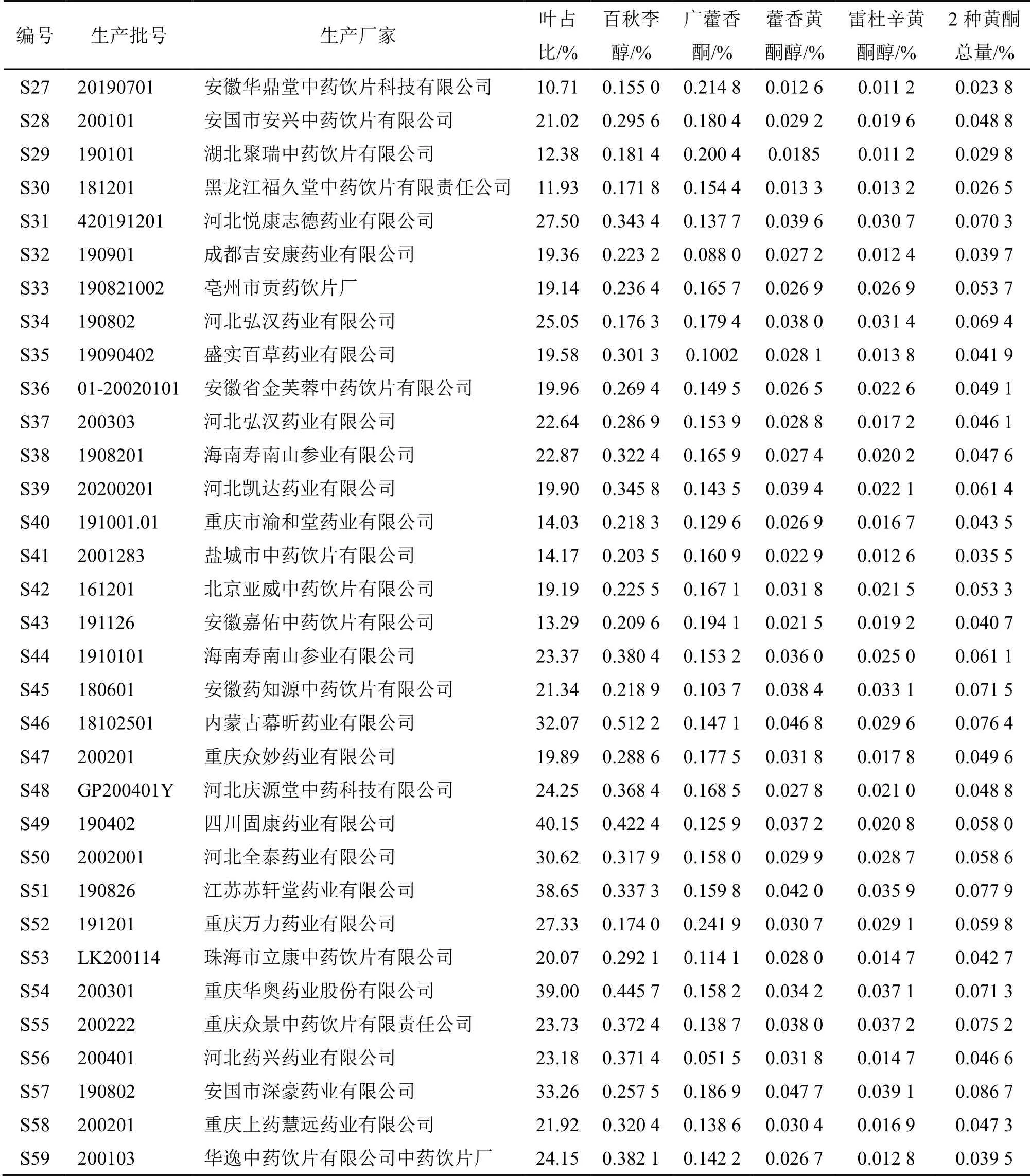
续表1
2 方法与结果
2.1 饮片中叶比例测定
取广藿香饮片样品约100 g,手工挑取广藿香叶,称定质量,记录叶的比例,59 批次饮片中广藿香叶的占比见表1。经统计,广藿香叶比例低于15%的样品占比37.2%,低于20%的样品占比57.6%,高于20%的样品占比42.4%。
广藿香药材标准规定叶不低于20%,即使考虑饮片加工过程中的损失(按15%比例计),仍有超过三分之一的样品中叶的比例未达标。因此,确立广藿香叶中关键的Q-Marker,充分体现广藿香饮片生产规范性,即足量加入广藿香叶,保证饮片质量和临床疗效势在必行。本实验从59 批次样品中,挑选10 批次(S48、S50~S58)广藿香叶的比例较高的样品,分别配制10%、20%、30%、40% 4 种叶比例,合计40 个样品作为验证用样品。
2.2 饮片样品和验证用样品中百秋李醇和广藿香酮含量测定
《中国药典》2020年版一部中广藿香药材以百秋李醇为含量测定指标性成分,但饮片项下并未延续药材标准,缺少含量测定项。文献研究表明[19-20],广藿香油的主要有效成分为百秋李醇和广藿香酮,百秋李醇具有抗炎、免疫调节及抗幽门螺旋杆菌的作用;广藿香酮具有抗菌、抗炎、抗氧化、杀虫以及抗肿瘤等多种生物活性[21-22]。
本实验参考《中国药典》2020年版百秋李醇含量测定方法同时测定广藿香中百秋李醇和广藿香酮的含量。样品前处理方法:取广藿香饮片粉末(过三号筛)约1 g,精密称定,置锥形瓶中,加无水乙醇50 mL,超声处理2 次,每次30 min,滤过,合并滤液,回收溶剂至干,残渣加正己烷使溶解,转移至5 mL 量瓶中,精密加入内标溶液(正十八烷)0.5 mL,加正己烷至刻度,摇匀,吸取1 μL,注入气相色谱仪,测定,即得(图1)。饮片样品测定结果见表1,验证样品测定结果见表2。
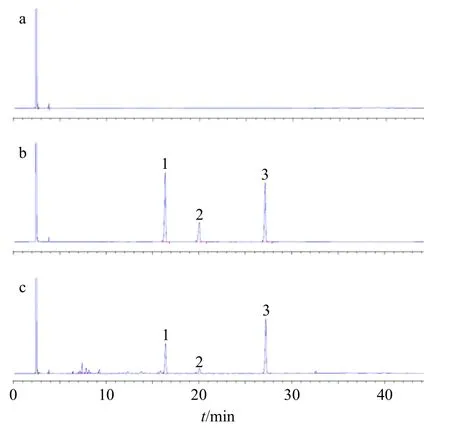
图1 百秋李醇和广藿香酮含量测定GC 图Fig.1 GC diagram of patchouli alcohol and pogostone determination
2.3 指纹图谱结合化学计量学筛选不同叶比例样品非挥发性差异成分
2.3.1 色谱条件 色谱柱为Waters Acquity UPLC BEH-C18柱(50 mm×2.1 mm,1.7 μm);流动相为0.2%磷酸水溶液-乙腈;梯度洗脱:0~10 min,8%~16%乙腈;10~18 min,16%~20%乙腈;18~30 min,20%~42%乙腈;30~35 min,42%乙腈;35~40 min,42%~80%乙腈;40~50 min,80%~95%乙腈;体积流量0.3 mL/min;柱温35 ℃;检测波长335 nm;进样量1.0 μL。
2.3.2 对照品溶液的制备 分别取新西兰牡荆苷、毛蕊花糖苷、异毛蕊花糖苷、鼠李素、藿香黄酮醇、雷杜辛黄酮醇、广藿香酮对照品适量,置于25 mL量瓶中,加甲醇超声溶解,放冷,用甲醇定容至刻度作为混合对照品溶液,冷藏,备用。
2.3.3 供试品溶液的制备 精密称取样品粉末(过三号筛)0.5 g,精密加入甲醇25 mL,称定质量,超声30 min,放冷,再称定质量,用甲醇补足减失的质量,摇匀,滤过,取续滤液,即得供试品溶液。
2.3.4 广藿香指纹图谱的建立 取59 批广藿香饮片样品,分别按“2.3.3”项下方法制备供试品溶液,按“2.3.1”项下色谱条件分析,将所得的色谱数据导入国家药典委员会《中国色谱指纹图谱相似度评价系统软件(2012 版)》,以S5 样品图谱作为参照图谱,采用中位数法,时间窗设为0.1 min,经多点校正后,进行色谱峰的匹配,生成指纹图谱共有模式,标定共有峰23 个,经对照品比对,指认出7个共有峰,分别为1 号峰新西兰牡荆苷、4 号峰毛蕊花糖苷、5 号峰异毛蕊花糖苷、11 号峰鼠李素、17 号峰藿香黄酮醇、20 号峰雷杜辛黄酮醇、21 号峰广藿香酮(图2)。59 批次饮片进行指纹图谱测试,以全谱峰匹配,相似度为0.24~0.83,说明各批次样品之间指纹图谱差异显著。
2.3.5 基于正交偏最小二乘判别分析(OPLS-DA)的不同广藿香叶比例的饮片差异性化学成分分析 将59 批次饮片按广藿香叶的比例数值高低进行分类,叶的比例低于15%的归为I 组,介于15%~25%的归为II 组,高于25%比例的归为III 组。以指纹图谱23 个色谱峰的峰面积与样品称样量比值为变量,运用 SIMCA 13.0 软件对 59 批样品进行OPLS-DA,结果显示叶片比例分布不同的3 组样品基本能够得到区分(图3)。
通过提取OPLS-DA 模型中变量重要性投影(variable importance for the projection,VIP)值图(图4),对23 个共有峰面积按照VIP 值大小进行排列,以VIP 值>1.0 为标准筛选差异性标志物,结果共得到10 个VIP 值大于1 的共有峰,分别为16~20、22、23、10、11、14 号色谱峰,其中11 号色谱峰为鼠李素、17 号色谱峰为藿香黄酮醇、20 号色谱峰为雷杜辛黄酮醇、21 号色谱峰为广藿香酮,说明这些共有峰对不同叶比例的饮片样品分类具有显著影响。16~20 号色谱峰从紫外吸收上判断均为黄酮类化合物,说明广藿香中黄酮类成分可作为控制叶片比例的关键指标。从相对峰面积上比较,17 号色谱峰藿香黄酮醇和20 号色谱峰雷杜辛黄酮醇的相对峰面积较其他成分高,可作为黄酮类主要的指标性成分,故同时测定以上2 种黄酮类化合物的含量,并通过与叶片比例的相关性来确定能否作为控制饮片中叶比例的关键指标。
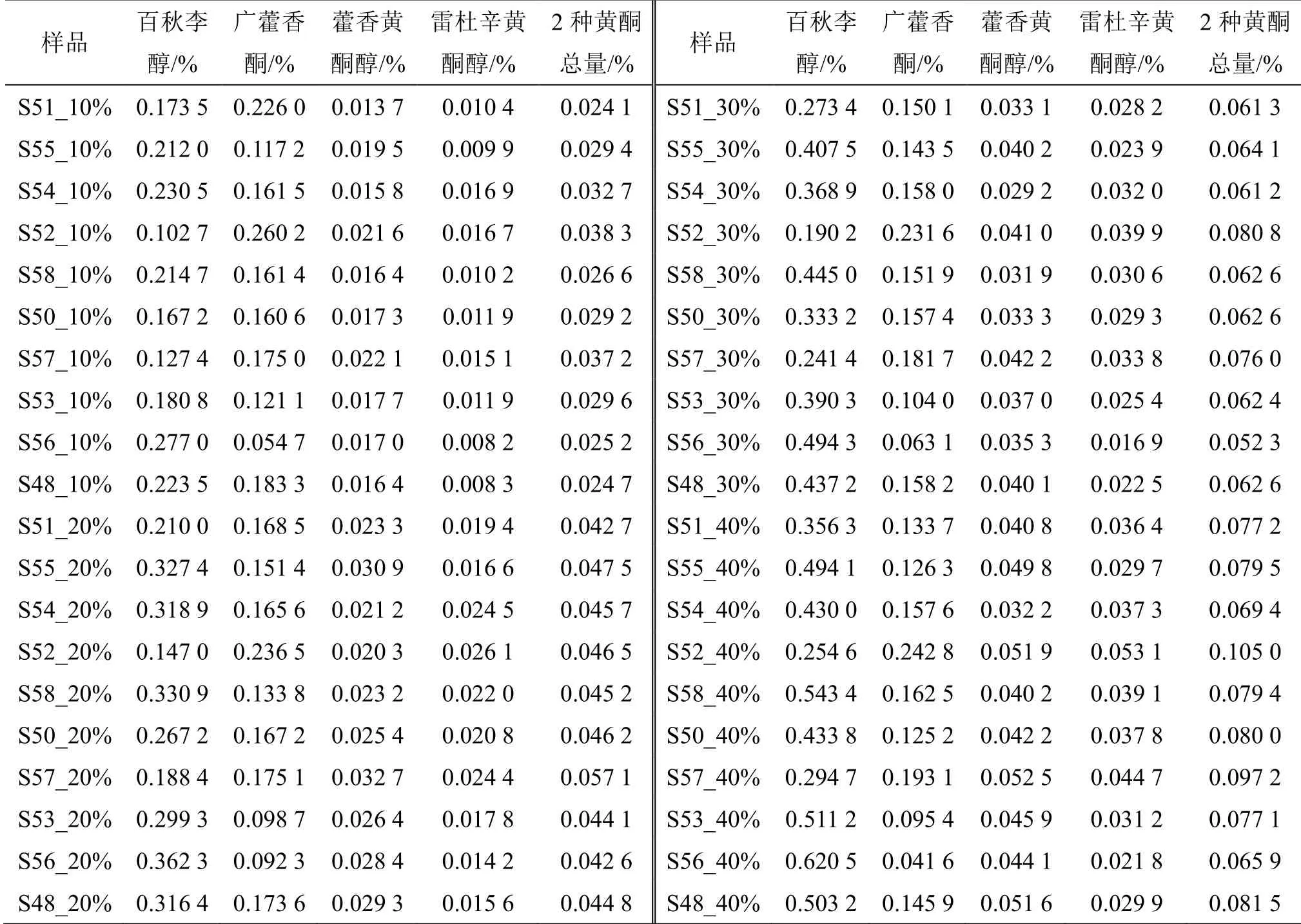
表2 不同比例广藿香叶验证样品中百秋李醇、广藿香酮、藿香黄酮醇、雷杜辛黄酮醇含量测定结果 (n = 2)Table 2 Contents of patchouli alcohol, pogoston, pachypodol and retusin in different ratio samples (n = 2)
2.4 藿香黄酮醇和雷杜辛黄酮醇含量测定
2.4.1 色谱条件 色谱柱为Waters SunFire C18液相色谱柱(250 mm×4.6 mm,5 µm);流动相为0.1%磷酸水溶液-乙腈;洗脱程序:0~10 min,30%~33%乙腈;10~15 min,33%乙腈;15~20 min,33%~41%乙腈;20~40 min,41%乙腈;40~45 min,41%~56%乙腈;45~61 min,56%乙腈;体积流量1.0 mL/min;柱温35 ℃;检测波长355 nm,进样量10 µL。色谱图见图5。
2.4.2 对照品溶液的制备 分别取藿香黄酮醇、雷杜辛黄酮醇对照品适量,精密称定,用甲醇配制成质量浓度分别为11.2、12.0 µg/mL 的混合对照品溶液,冷藏,备用。
2.4.3 供试品溶液的制备 精密称取样品粉末(过三号筛)0.5 g,精密加入甲醇25 mL,称定质量,超声30 min,放冷,再称定质量,用甲醇补足减失的质量,摇匀,滤过,取续滤液,即得供试品溶液。
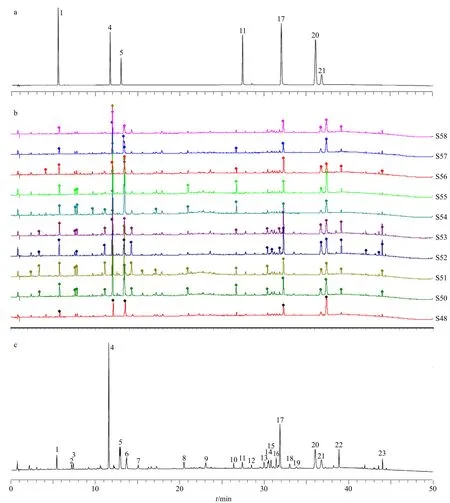
图2 混合对照品 (a)、广藿香饮片指纹图谱 (b) 和共有指纹图谱 (c)Fig.2 Mixed reference substances (a), fingerprints of PH pieces (b), and common fingerprint (c)
2.4.4 线性关系考察 精密吸取“2.4.2”项下混合对照品溶液各0.1、0.2、0.4、0.6、0.8、1.0 mL 置于10 mL 量瓶中,加甲醇稀释至刻度,摇匀,得系列不同浓度的混合对照品溶液,按“2.4.1”项下色谱条件进样测定峰面积。以进样量为横坐标(X), 色谱峰面积为纵坐标(Y),绘制标准曲线,进行线性回归,得回归方程结果分别为藿香黄酮醇Y= 3.27×106X-4 108.56,线性范围为11.2~168.0 ng,R2=0.999 9;雷杜辛黄酮醇Y=3.19×106X- 2 588.88,线性范围为12.0~180.0 ng,R2=0.999 9;结果显示线性关系良好。
2.4.5 精密度试验 分别精密吸取同一对照品溶液10 μL,连续进样6 次,结果6 次进样所测得藿香黄酮醇峰面积RSD 为0.20%,雷杜辛黄酮醇峰面积RSD 为0.12%,表明精密度良好。
2.4.6 稳定性试验 分别精密吸取同一供试品溶液(S47)1 μL,分别在0、2、4、8、12、24 h 进样,结果6 次进样所测得藿香黄酮醇峰面积的RSD 为0.90%,雷杜辛黄酮醇峰面积的RSD 为0.59%,表明24 h 内供试品溶液稳定性较好。
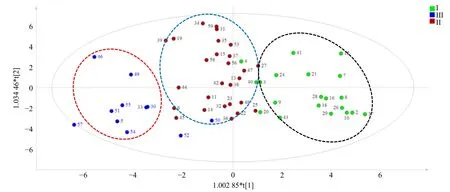
图3 59 批样品OPLS-DA 得分图Fig.3 OPLS-DA scores plot of 59 patch samples
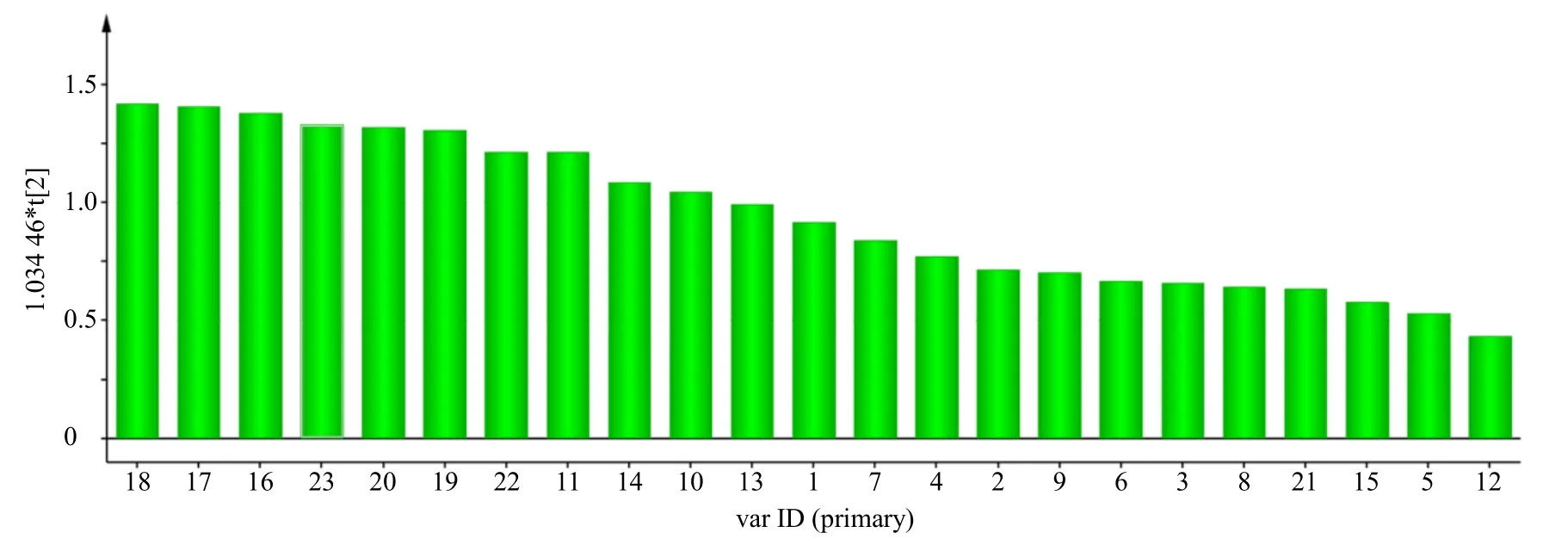
图4 23 个共有峰的OPLS-DA VIP 值图 Fig.4 OPLS-DA VIP value of 23 shared peaks
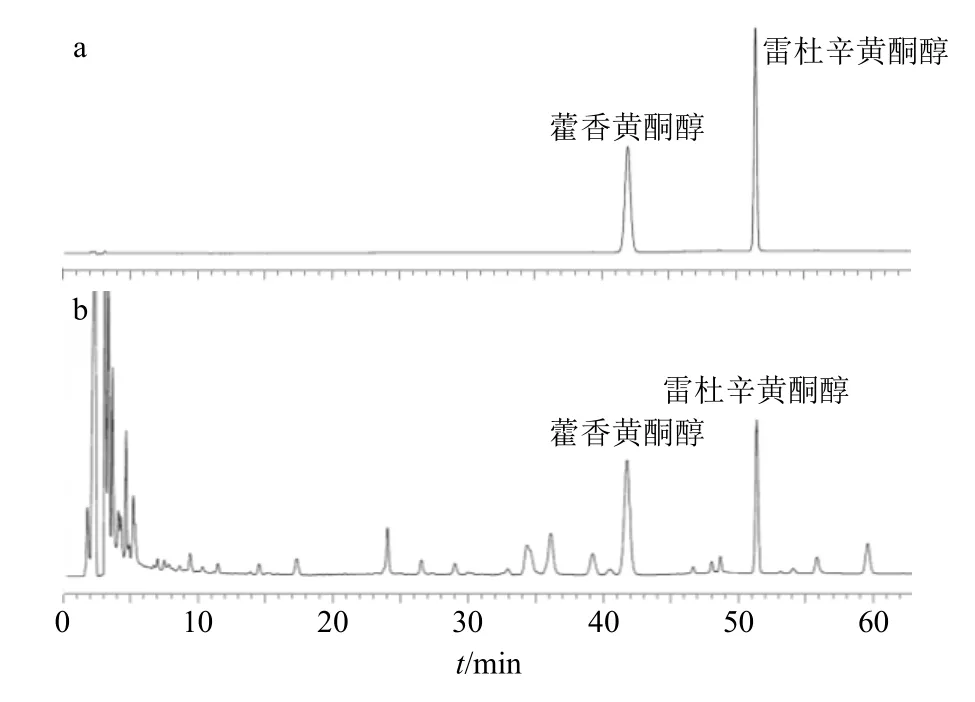
图5 混合对照品溶液 (a) 和广藿香样品 (b) 的HPLC 图Fig.5 HPLC of mixed reference substances (a) and PH sample (b)
2.4.7 重复性试验 分别精密称取同一批样品(S47) 6 份,按供试品溶液制备方法制备并进样分析,结果6 次试验含量结果显示藿香黄酮醇质量分数的RSD 为1.19%,雷杜辛黄酮醇质量分数的RSD 为1.18%,表明重复性良好。
2.4.8 加样回收率试验 取重复性试验已测知含量粉末0.25 g,精密称定,精密加入等量待测成分,按照“2.4.3”项下方法制备供试品溶液,平行制备6 份,按“2.4.1”项下色谱条件进样测定,计算加样回收率,结果藿香黄酮醇平均加样回收率为102.74%,RSD 为1.45%;雷杜辛黄酮醇平均加样回收率为103.96%,RSD 为1.41%。
2.5 广藿香规范化生产的Q-Marker 确立
利用SPSS 22.0 对自制40 个不同比例验证性样品中百秋李醇、广藿香酮、藿香黄酮醇、雷杜辛黄酮醇含量以及2 种黄酮总含量进行单因素方差分析(表3),并采用Student-Newman-Keuls(SNK)法进行组间两两比较,结果显示,百秋李醇含量在各比例组间均呈显著差异(P<0.05),广藿香酮含量在各比例组间均无显著性差异(P>0.05),藿香黄酮醇、雷杜辛黄酮醇以及2 种黄酮总量的两两之间均呈显著差异(P<0.05)。
表3 广藿香叶不同比例验证样品组百秋李醇、广藿香酮、藿香黄酮醇、雷杜辛黄酮醇含量统计分析 ( ± s)Table 3 Variance analysis of patchouli alcohol, pogoston, pachypodol, and retusin in different ratio groups ( ± s)

表3 广藿香叶不同比例验证样品组百秋李醇、广藿香酮、藿香黄酮醇、雷杜辛黄酮醇含量统计分析 ( ± s)Table 3 Variance analysis of patchouli alcohol, pogoston, pachypodol, and retusin in different ratio groups ( ± s)
*表示显著性水平α=0.05,**表示显著性水平α=0.01,下表同* indicate significance α = 0.05, ** indicate significance α = 0.01, same as below table
组别 质量分数/% 百秋李醇 广藿香酮 藿香黄酮醇 雷杜辛黄酮醇 2 种黄酮总量 10%比例 0.191±0.05* 0.162±0.06 0.018±0.00** 0.012±0.00** 0.030±0.01** 20%比例 0.277±0.07* 0.156±0.04 0.026±0.00** 0.020±0.00** 0.046±0.00** 30%比例 0.358±0.10* 0.150±0.04 0.036±0.00** 0.028±0.01** 0.065±0.01** 40%比例 0.444±0.11* 0.142±0.05 0.045±0.01** 0.036±0.01** 0.081±0.01**
同时将40 个样品以百秋李醇含量、藿香黄酮醇含量、雷杜辛黄酮醇含量以及2 种黄酮总量为变量进行OPLS-DA 分析,结果显示,4 个不同叶比例组别可以得到明显区分(图6),说明百秋李醇含量、藿香黄酮醇含量、雷杜辛黄酮醇含量以及2 种黄酮总量可作为控制叶比例的关键指标。
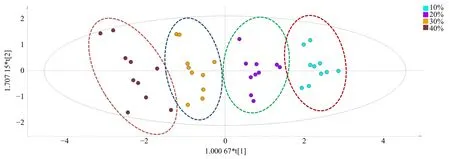
图6 不同广藿香叶的比例验证样品OPLS-DA 得分图Fig.6 OPLS-DA scores plot of verification samples with different PCL ratio
将所有饮片样品中百秋李醇含量和2 种黄酮总含量与叶片比例进行相关分析(表4),结果显示饮片叶比例与百秋李醇、藿香黄酮醇、雷杜辛黄酮醇含量以及2 种黄酮总含量均呈现显著的正相关(P<0.05),说明百秋李醇、藿香黄酮醇和雷杜辛黄酮醇可作为控制叶比例的关键Q-Marker。因此,为规范广藿香饮片生产加工,保证饮片中广藿香叶的真实加入,可通过以上3 种Q-Marker 的含量测定进行饮片中叶比例控制。将所有饮片按比例进行统计分析,考虑到饮片加工过程中叶片损失,以15%比例为参考,以3 种Q-Marker 含量均值80%为限度,百秋李醇含量应不低于0.24%,雷杜辛黄酮醇和藿香黄酮醇总量应不低于0.045%,建议以此补充完善《中国药典》“广藿香”饮片标准,充分保证饮片质量。
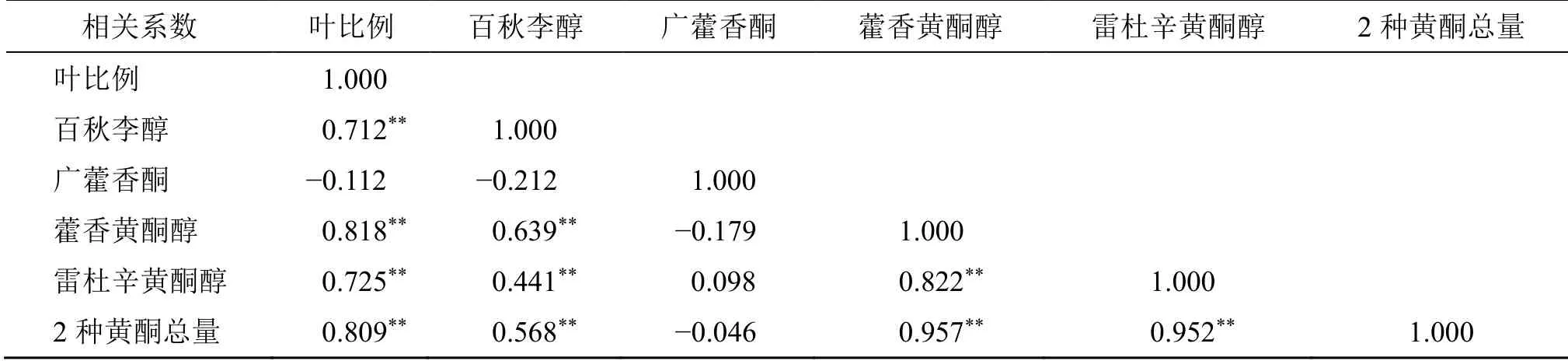
表4 广藿香叶的比例与饮片各测定成分含量相关性分析Table 4 Correlation analysis of PCL ratio and the content of each determined component
3 讨论
广藿香明代以前本草中多以“藿香”之名出现,原产于南洋,自宋朝引入我国,现主要种植于广东、广西、海南等地,尤以广东产量最高,是“十大南药”之一,地道的“广药”。广藿香全草含有挥发油,而尤以叶中挥发油的含量最高,是广藿香芳香化湿的主要药效部位。
《中国药典》2020年版一部广藿香药材检查项规定叶不低于20%,但饮片项下只有性状和鉴别项,缺少检查项、含量测定项等,不能全面反映饮片质量。且广藿香饮片炮制要求先抖下叶另放,在与切段干燥的茎混合,正因如此,广藿香叶多被用来提取广藿香油,实际加入到饮片中的叶较少,叶比例偏低,这既不符合炮制要求,又极大的影响了饮片质量。因此,生产不规范是导致广藿香饮片质量问题的主要原因,合理控制饮片中广藿香叶的比例,保障饮片使用的临床疗效,确立能代表广藿香生产加工规范性的Q-Marker 则显得尤为重要。
传统广藿香入药部位为叶,叶中挥发油较多,现代中成药藿香正气类也均以广藿香油为原料,但霍胆丸(片)则以广藿香叶乙醇提取物为原料,且古方中广藿香也多入汤剂,说明广藿香中一些非挥发性物质仍然可能是有效成分,故本实验建立了非挥发油类成分的指纹图谱,分别采用甲醇、乙醇、75%甲醇、75%乙醇为溶剂,考察建立指纹图谱,结果显示甲醇提取的色谱峰较多,故选择甲醇为提取溶剂;通过全波长扫描,并提取各波长下指纹图谱,结果显示在335 nm 色谱峰数目较多,分离度较好,响应较高,故选择335 nm 作为指纹图谱的检测波长。
本实验利用化学计量学筛选出黄酮类成分可作为控制叶片比例的关键指标,结合Q-Marker 的可定量性,选择藿香黄酮醇和雷杜辛黄酮醇2 种黄酮成分作为潜在的Q-Marker,后期实验可尝试采用总黄酮部位的测定,探索其与叶比例的关联性,同时其余黄酮类成分的鉴定尚需进一步研究。
2 种黄酮类成分含量测定曾考察甲醇、95%乙醇、75%乙醇、75%甲醇等不同提取溶剂,同时对超声、冷浸、回流等提取方法进行考察,最后确定甲醇超声提取30 min 为2 种黄酮类成分含量测定前处理方法。从40 个验证性样品含量测定结果可知,10%比例的饮片样品百秋李醇的含量均值达0.19%,已高于药材标准0.1%的限度,而药材叶比例检查不低于20%,饮片20%的叶比例限度样品百秋李醇的含量均值达0.28%,远高于药材标准,因此需结合广藿香不同品种的百秋李醇含量分布,适当修订或提高药材中百秋李醇的含量限度。
利益冲突所有作者均声明不存在利益冲突
