钟基因在炎性肠病中的免疫调控研究进展*
2021-08-04秦青华邱春红
秦青华, 邱春红
(山东大学齐鲁医学院基础医学院细胞生物学系,山东济南250012)
炎性肠病(Inflammatory bowel disease,IBD)的发病率在中国呈现逐年上升的趋势,而且其难以治愈及反复发作的特点具有恶化为结直肠癌症的风险。目前,对于IBD 的主要药物治疗策略可分为两类:(1)用抗炎类药物进行治疗,例如5-氨基水杨酸[1];(2)免疫抑制剂疗法,例如肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)抑制剂[2]。这两种治疗方法虽然可以有效的抑制IBD,但仍然不能从本质上起到治愈IBD 的作用。此外,长期使用抗炎药物易致使机体产生耐药性,而免疫抑制剂可导致机体产生免疫紊乱从而影响治疗效果。因此,明确疾病的发病机制、探索更为有效的治疗方式成为临床和基础研究急需解决的问题。
时钟基因的节律性表达在正常生命活动中普遍存在,并通过参与调控外周生物钟与中央生物钟正常运转实现各器官功能的调控[3]。已有相关研究表明时钟基因可以参与免疫调控过程进而干预炎症疾病的发生发展[4],从钟基因的角度探究IBD 的发病机制并开发非药物依赖性的物理治疗手段干预肠道疾病具有重要的临床意义。因此,本文综述钟基因与炎症免疫的相关研究,为IBD 的临床诊治提供参考资料。
1 钟基因基本调控机制
昼夜节律的紊乱与临床多种疾病有关[5]。生物钟作为机体产生节律行为的内在因素主要由输入通路、中央振荡器和输出通路3 个部分组成,通过分子水平反馈环路和信号级联放大机制实现机体生理和行为活动产生周期性变化,从而维持机体器官与内外界环境变化相适应并发挥正常生理功能[6]。
截止目前,已报道的哺乳动物钟基因主要包括以下几种:Per1、Per2、Per3(period circadian genes);Cry1、Cry2(cryptochromes);Bmal1(brain and muscle ARNT-like 1);Rev-erbα、Clock(circadian locomotor output cycles kaput)、Dbp(D-site binding protein)和Nfil3(nuclear factor,interleukin 3 regulated)。这些基因的转录翻译活动构成哺乳动物中的3条转录-翻译反馈环路(图 1):(1)正调控蛋白 CLOCK 和BMAL1 通过bHLH-PAS 结构异二聚化结合到负调控基因(Cry1、Cry2、Per1和Per2)的E-box 上,从而激活基因转录;其表达产物钟蛋白CRY 和PER 达阈值后,二者相互作用(CRY-PER)从胞浆转移至核内,进而抑制Clock和Bmal1的转录,阻断BMAL1-CLOCK异二聚体的形成[7]。(2)BMAL1-CLOCK 异二聚体促进Rorα/β/γ[8]和Rev-erbα/β[9]基因的表达;RORα/β/γ和 REV-ERBα/β 蛋白与Bmal1启动子的反应元件RORE 结合而发挥促进或阻遏Bmal1基因转录的作用[10]。(3)BMAL1-CLOCK 异二聚体启动Dbp基因的表达产生DBP 蛋白:一方面,DBP 可与带有D 盒的基因(如Rorα/β/γ)结合并激活其转录;另一方面,NFIL3 蛋白也能够竞争性结合至D 盒而抑制相关基因表达。此外Nfil3基因本身也作为 RORα/β/γ 的靶基因而受到调控[11]。这3条转录-翻译反馈环路通过控制钟基因的表达,进而调节哺乳动物的节律,维持各器官生理功能的稳定。
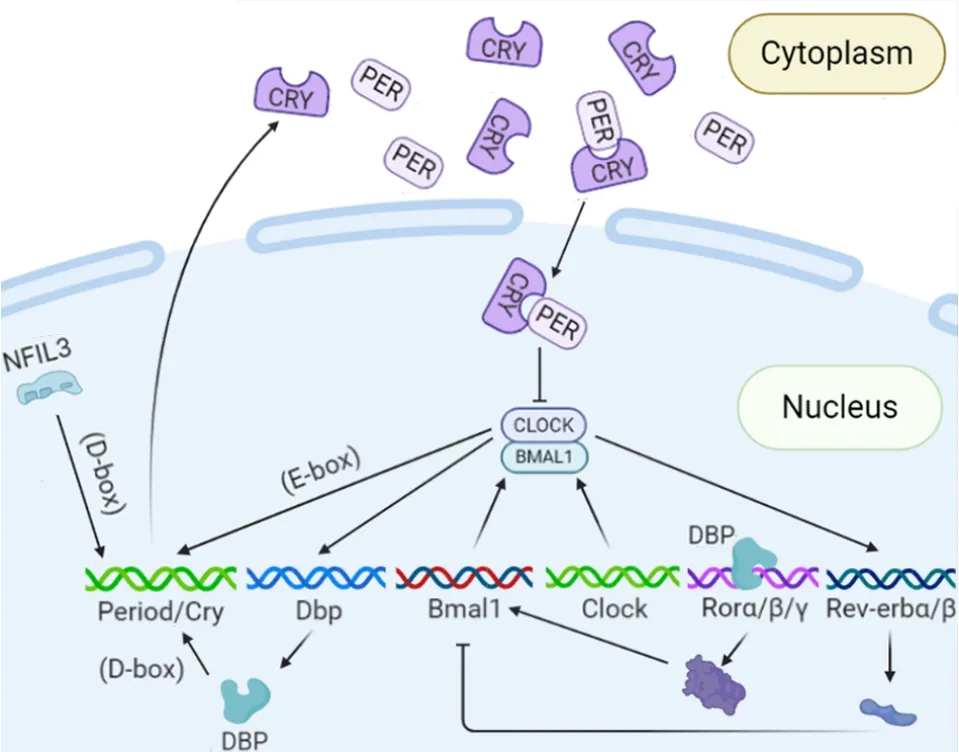
Figure 1.Transcriptional-translational feedback loop of clock genes.图1 钟基因的转录-翻译反馈环路
2 钟基因与炎症性肠病的关系
克罗恩病(Crohn disease,CD)和溃疡性结肠炎(ulcerative colitis,UC)是IBD 的两种主要类型。IBD患者如不能进行及时、有效治疗,约三分之一的结肠炎患者会发生癌变[12]。因此,进一步明确IBD 的发病机制、防止其恶化,并提供更加行之有效的治疗方法是临床治疗和基础医学研究中所要解决的重要问题。
肠道免疫细胞、细胞因子、肠道菌群等被证明与内部时钟密切相关。这些因素一方面受到钟基因的调控呈现昼夜变化,另一方面也干扰钟基因的表达[13],例如Bmal1、Rev-erbα等钟基因能够参与调控细胞分化、脂质代谢、线粒体生物发生和炎症等各种生理病理过程。因此,以生物钟系统调节机体免疫反应或将成为治疗肠道炎症疾病的一种新方法[14]。
2.1 钟基因调控固有免疫细胞参与炎症反应 特定的固有免疫细胞亚群对IBD 的发生发展发挥着关键调控作用[15-17]。单核细胞、巨噬细胞、肥大细胞、中性粒细胞和自然杀伤细胞等多种固有免疫细胞[18]已被证明具有内在的“时钟机制”,这些“时钟”影响细胞的功能,如调节巨噬细胞吞噬活性、细胞因子释放、抗病毒活性、肥大细胞的组胺释放、过敏反应等[19],是调节固有免疫细胞发挥作用的关键因素。
周期性蛋白PER1是脾脏NK细胞发挥有效功能所必需的[20],而在巨噬细胞中含有Bmal1 的时钟转录因子网络能够通过调控增强子的表观遗传状态来控制巨噬细胞的炎症反应[21]。髓系来源的细胞在干扰Bmal1 后抑制了核因子E2 相关因子2(nuclear factor E2-related factor 2,Nrf2)的转录,进而促进白细胞介素1β(interleukin-1β,IL-1β)的产生[22],加重炎症反应。
NLRP3(NLR family pyrin domain containing 3)炎症小体是由NLRP3、ASC 和caspase-1 组成的大蛋白复合物[23],在对病原体相关分子模式(pathogen-associated molecular patterns,PAMPs)或损伤相关分子模式(damage-associated molecular patterns,DAMPs)的先天免疫反应中起着核心作用[24-25]。巨噬细胞中激活的NLRP3 炎症体促进caspase-1、促炎细胞因子IL-1β 和IL-18 的成熟和分泌,而这一过程同样也受到REV-ERBα的严格调控[26]。此外,巨噬细胞中Bmal1的敲除可上调丙酮酸激酶M2(pyruvate kinase M2,PKM2)蛋白水平并促进乳酸产生,最终导致免疫检查点蛋白程序性死亡配体1(programmed death ligand 1,PD-L1)高表达[27]。
隐花色素(cryptochromes,CRYs)通过对腺苷酸环化酶的作用直接影响炎症通路。在敲除Cry1的情况下,cAMP 的基础水平升高导致蛋白激酶A 激活增强,进而诱导p65 亚基S276 位点磷酸化,促进NF-κB信号通路激活。Cry1-/-Cry2-/-小鼠的巨噬细胞、成纤维细胞和骨髓细胞中几种促炎细胞因子,如IL-6、TNF-α 和 CXC 趋化因子配体 1(CXC chemokine ligand 1,CXCL1)的基础水平升高[28]。
中性粒细胞被募集至利什曼原虫感染位点也已被证明受到钟基因的调节[29];Godinho-Silva 等[30]证明,第3 组固有淋巴样细胞(group 3 innate lymphoid cells,ILC3s)内也存在生物钟。
2.2 钟基因调节适应性免疫细胞的发育及迁移 早期人们认为适应性免疫从激活到发挥作用再到结束的整个过程发生速度较快,因而不受生物钟的调控。近些年分子水平的研究表明淋巴细胞的发育分化及功能发挥同样受到生物钟的调控[31]。
2.2.1 BMAL1 与淋巴细胞的发育 钟基因参与B淋巴细胞的发育机制尚不明确,但淋巴细胞发育的昼夜节律调节对于每天维持细胞类型的平衡至关重要。Bmal1-/-小鼠血液和脾脏中B 细胞数量明显减少,过继转移实验表明阻碍B细胞分化的不是B细胞的内在“时钟”,而是骨髓微环境中BMAL1 的缺失[32]。关于生物钟对T 细胞发育的影响,研究认为总的T 细胞数目不受整体或细胞特异性Bmal1敲除的影响[33]。
2.2.2 NFIL3 与T 细胞的发育 转录因子NFIL3 又称E4BP4,在多种免疫细胞中表达并可调节多种细胞类型不同的免疫功能,而Nfil3转录同样受细胞生物钟控制[11]。在活化的Rev-erbα-/-CD4+T 细胞中,NFIL3 的表达通常高于未敲除Rev-erbα的 CD4+T 细胞[9]。NFIL3 通过节律性抑制Rorc的转录以实现对TH17 细胞的调节(Rorc编码的 RORγt 是 TH17 所必需的关键转录因子);细胞分化研究发现,NFIL3在白天表达较低,夜间表达较高,RORγt 在白天表达较高,夜间表达较低,因此白天分离的纯CD4+T细胞在体外极化后更容易分化为TH17细胞[34]。
在Nfil3-/-小鼠中ILC3s 发育受阻,从而导致TH17细胞的分化受到抑制[35]。但这一差异在Nfil3-/-细胞中是不存在的,这表明体内TH17细胞的数量平衡是依赖NFIL3的,并通过生物钟在整个T细胞群体中同步进行。也有研究表明,夜间信号激素褪黑素的水平较低会影响TH17 细胞的分化,褪黑素对人T细胞的治疗已被证明可以通NFIL3-RORγt途径抑制TH17细胞的分化来实现[36]。
2.2.3 淋巴细胞的节律性转移 血液中T 细胞和B细胞表现出强烈的昼夜节律振荡。在小鼠体内稳态条件下,淋巴结内的淋巴细胞也呈现昼夜节律振荡,而且淋巴细胞数量峰值出现在小鼠活动阶段[37]。在夜间CC 趋化因子受体 7(CC chemokine receptor 7,CCR7)和 CC 趋化因子配体 21(CC chemokine receptor 21,CCL21)表达水平达到最高,CD4+T 细胞、CD8+T 细胞和B 细胞在淋巴节中大量募集;而在Bmal1表达受到抑制后,依赖于时间的T 淋巴细胞归巢与分布则受到抑制[38]。淋巴细胞从淋巴结进入传出淋巴管并最终排出的节律性依赖于鞘氨醇1-磷酸受体 1(sphingosine 1-phosphate receptor 1,S1P1)的节律性表达。Nakai 等[39]的研究表明,晚上迁移到淋巴结的细胞停留的时间也比白天迁移的细胞要长。
2.3 钟基因与肠道菌群互作控制肠道稳态 微生物是肠道功能的重要调节因子,其代谢产物影响宿主免疫系统的发育,钟基因异常表达可能通过改变肠道微生物群导致IBD的发病。
肠上皮细胞通过Toll 样受体(Toll-like receptors,TLRs)及共同信号受体MyD88 来感知微生物以调节关键基因的表达[40]。肠树突状细胞(dendritic cells,DC)-ILC3 通路由革兰氏阴性菌外膜中存在的鞭毛素或脂多糖(lipopolysaccharide,LPS)激活DC中的TLR-MyD88信号,并通过细胞因子IL-23将细菌信号从 DC 传递到 ILC3,ILC3 通过产生 IL-22 向上皮细胞发出信号[41],激活的 IL-22R 导致 STAT3 的磷酸化而与Rev-erbα启动子结合并抑制其转录。
肠道微生物通过NFIL3 调节身体内的代谢[42]。肠道微生物能够通过组蛋白脱乙酰酶3 来调节宿主代谢的昼夜节律,并且脂质转运蛋白基因CD36的节律性转录也同样依赖于肠道微生物[43]。
2.4 褪黑素减轻肠道炎症 褪黑素作为一种激素分子产物从松果体释放到循环系统中调节免疫系统和昼夜节律,其发挥作用主要存在两种方式:依赖和不依赖于褪黑素受体[44]。研究显示褪黑素也可由松果体以外组织和细胞诱导产生,包括肠黏膜、自然杀伤细胞、肠嗜铬细胞和内皮细胞[45]。此外,线粒体可能是所有真核细胞褪黑素合成的主要部位[46]。
由小鼠睡眠剥夺引起的肠黏膜损伤及肠道微生物群失调与褪黑素受到抑制密切相关[47]。褪黑素可被用作抗氧化剂,通过抑制氧化应激和NF-κB 途径的激活来逆转因睡眠剥夺诱导的小肠黏膜损伤[48]。睡眠剥夺的小鼠肠道中活性氧(reactive oxygen species,ROS)的积累导致小鼠的死亡率上升,在使用褪黑素进行治疗后,小鼠肠道ROS含量降低,存活率显著升高[49]。持续的环加氧酶(cyclooxygenase-2,COX-2)过表达参与了炎症相关结直肠癌的发生[50]。在IL-1β 刺激的人肠上皮细胞炎症反应中,褪黑素能抑制COX-2的表达,但褪黑素对肠上皮细胞炎症反应的抑制作用只有在褪黑素的浓度与治疗睡眠障碍膳食中褪黑素浓度相近时才会发生,生理条件下纳摩尔级别浓度的褪黑素不具备这样的效果[51]。此外,褪黑激素可以通过减少巨噬细胞中炎症小体多蛋白复合物的形成减轻炎症小体相关的血管疾病[52]。
3 总结
虽然钟基因的节律性表达能够在一定程度上通过调控CD4+T 细胞的发育及迁移、固有免疫细胞释放炎性因子以及与肠道菌群等的相互作用来改变炎症免疫微环境,干预炎症疾病的发生发展,但是仍然还有许多值得深入研究的问题:钟基因介导免疫系统干预肠道炎症的具体机制是什么?不同的钟基因在炎症中是如何发挥作用的?在不改变光照周期的条件下,不同光谱是否能通过钟基因抑制IBD 的发展?能否针对钟基因设计相应的治疗方案?随着对钟基因和IBD 更加深入的研究,将会提出更为行之有效的治疗方案。
