黄芩苷通过抑制HMGB-1减少U937巨噬细胞的M1型极化和减轻小鼠的急性肺损伤*
2021-08-04朱路明江丽丽
杨 冰, 朱路明, 江丽丽, 王 菁△, 覃 元
(1武汉市第八医院呼吸科,湖北武汉430010;2武汉大学基础医学院病理生理学教研室,湖北武汉430071)
急性肺损伤(acute lung injury,ALI)是一种炎性肺部疾病,常由感染、败血症或局部缺血/再灌注损伤引起,其特征是由于中性粒细胞浸润和促炎细胞因子和趋化因子分泌,造成肺水肿、炎症、肺泡-毛细血管膜损伤以及富含蛋白质的液体渗入肺泡区域[1]。急性肺损伤作为一种急性炎症疾病,可使位于肺上皮的中性粒细胞迁移以及促炎和细胞毒性介质释放,并导致肺泡巨噬细胞分泌细胞因子,如白细胞介素 1(interleukin-1,IL-1)、IL-6、IL-8、IL-10 和肿瘤坏死因子α(tumor necrosis factor-α,TNF-α),从而刺激炎症发展并最终导致肺纤维化[2-3]。这种炎症过程导肺泡表面活性剂失活并引起I 型和II 型肺泡上皮细胞死亡,增加屏障通透性并降低肺泡液清除率,使大分子进入间隙,引起肺水肿[4]。巨噬细胞作为急性肺损进程的重要参与者,可极化为M1 和M2 两种表型,M1 巨噬细胞为有利于炎症的形态,能产生多种促炎细胞因子[5]。高迁移率族盒蛋白1(high mobility group box protein-1,HMGB-1)是一种脂多糖(lipopolysaccharide,LPS)结合蛋白,介导炎症发生,与急性肺损伤的发展密切相关[6-7]。并且有研究表明,HMGB-1 可以促进巨噬细胞向 M1 表型转化[8]。所以HMGB-1 介导的巨噬细胞极化可能是急性肺损伤的关键病理进程和潜在治疗靶点。
黄芩苷(baicalin;5,6-二羟基-7-O-葡糖醛酸黄酮苷)是从黄芩中提取的黄酮类化合物,用于治疗支气管炎、肾炎、哮喘、特应性皮炎、肝炎等疾病[9]。近年已有许多针对黄芩苷的研究,但是黄芩苷对急性肺损伤的治疗作用机制尚未完全明确[10-11]。黄芩苷有良好的抗炎作用,而巨噬细胞炎症反应在急性肺损伤中发挥巨大作用,有研究表明黄芩苷可以通过抑制 HMGB-1 减轻神经炎症[12-13],故推测其可以通过HMGB-1 减少肺部巨噬细胞的M1 型极化发挥保护作用[14]。
材料和方法
1 实验材料
人单核细胞系U937 购自中国科学院上海生命科学研究院细胞资源中心。昆明小鼠购于南京君科生物工程有限公司(动物合格证号为RAWMX-90021)。RPMI-1640 培养液和新生胎牛血清购自Gibco;佛波醇12-肉豆蔻酸酯13-乙酸酯(phorbol 12-myristate 13-acetate,PMA)购于Sigma;黄芩苷购于上海麦克林公司;LPS 购于 Sigma;HMGB-1 中和抗体(HMGB-1 neutralizing antibody,HMGB-1 Ab)购 于Arigo;HMGB-1 抗体、CD86 抗体和 HRP 标记的Ⅱ抗购于 CST;Trizol RNA 分离试剂购于 Thermo Fisher;逆转录试剂盒与实时荧光定量PCR 试剂盒购于Ta-KaRa;CCK-8 试剂盒购于 AbMole;IL-1β 和 TNF-α ELISA试剂盒购于厦门慧嘉生物。
2 实验方法
2.1 细胞培养 U937 细胞系悬浮培养于含10%胎牛血清的RPMI-1640 培养液中,在37 ℃、5 % CO2恒温培育箱中培养,每2~3 d传代。将U937细胞用50 μg/L PMA 处理24 h 诱导巨噬细胞样分化。细胞分为:(1)对照(control)组:给予等量 PBS;(2)模型(LPS)组:加入 LPS 终浓度 1 mg/L 孵育 6 h;(3)黄芩苷组:用黄芩苷 50 μmol/L 孵育 1 h 后,再加入 LPS 终浓度 1 mg/L 孵育 6 h;(4)HMGB1 中和抗体 10 mg/L孵育1 h后,再加入LPS终浓度1 mg/L孵育6 h.
2.2 Western blot检测蛋白水平 细胞给药处理后,用PBS 缓冲液洗涤细胞3 次,然后用RIPA 缓冲液溶解细胞。裂解液于4 ℃、12 000×g离心15 min,取上清进行蛋白定量得到蛋白样品。样品进行SDSPAGE,转膜于聚偏二氟乙烯(PVDF)膜上,用8%的脱脂奶粉进行封闭2 h,封闭后用稀释后的抗体于4 ℃孵育,随后孵育相应Ⅱ抗。最后用ECL成像系统发光显影。
2.3 RT-qPCR 实验 给药处理后,加入Trizol RNA分离试剂提取细胞RNA 后,提纯RNA,测量RNA 浓度,按照说明书要求进行逆转录反应。实时荧光定量 PCR 的程序为:预变性 95 ℃ 30 s;变性 95 ℃5s,退火/延伸60 ℃ 10 s,45个循环。测定结果用 2-ΔΔCt计算方法处理数据。IL-1β 的上游引物序列为5'-AGCTACGAATCTCCGACCAC-3',下游引物序列为5'-CGTTATCCCATGTGTCGAAGAA-3';TNF-α的上游引物序列为5'-AGCCGATGGGTTGTACCT-3',下游引物序列为5'-TGAGTTGGTCCCCCTTCT-3’;β-actin 的上游引物序列为5'-CTCTTCCAGCCTTCCTTCCT-3',下游引物序列为5'-CAGGGCAGTGATCTCCTTCT-3'。
2.4 流式细胞术 细胞进行给药处理后,弃掉培养基,用PBS 缓冲液清洗后,按照试剂盒说明书进行染色,在流式细胞仪上检测细胞CD86的表达。
2.5 CCK-8 实验检测细胞活力 细胞进行给药处理后,将原细胞上清液弃掉,按照CCK-8 试剂盒要求,加入以培养基:CCK-8 液=10∶1 新配的 CCK-8 溶液,放回孵箱中孵育到颜色深浅合适时结束孵育。使用多模式读取器在波长450 nm 处测量吸光度(A)值,以吸光度计算细胞活力。
2.6 动物实验 雄性昆明小鼠30 只,随机分为3组:(1)对照组:一次性给予3 mg/kg 生理盐水腹膜内注射;(2)模型组:一次性给与3 mg/kg LPS 腹膜内注射;(3)黄芩苷处理组:每天100 mg/kg 黄芩苷灌胃,第10 天给与3 mg/kg LPS 腹膜内注射。48 h 后处死小鼠,并用Hanks 缓冲液灌注小鼠肺后收集肺泡灌洗液。小鼠处死后将肺切下,吸干称重以获得“湿重”,然后将其置于80 ℃的干燥箱中48 h 以获得“干重”。计算肺湿重与干重的比率以评估组织水肿。
2.7 ELISA 实验 将收集好的肺泡灌洗液于4 ℃、3 000 r/min 离心10 min,取上清,按照制造商的说明使用IL-1β和TNF-α的ELISA试剂盒进行测定。
3 统计学处理
采用SPSS 16.0 软件分析实验结果。实验数据表示用均数±标准差(mean±SD)的方式表示。多组间比较采用单因素方差分析(one-way ANOVA),并进一步采用Bonferroni 法进行两两组间数据差异的比较。以P<0.05为差异有统计学意义。
结 果
1 黄芩苷抑制LPS诱导的U937巨噬细胞向M1极化
与对照组相比,U937 巨噬细胞用LPS 处理后,HMGB-1 蛋白表达明显上升(P<0.05),相较于LPS组,用黄芩苷处理后HMGB-1 蛋白表达明显下降(P<0.05),见图1A。与对照组相比,LPS 处理后,U937巨噬细胞的 M1 表型标志物 IL-1β 和 TNF-α 的 mRNA水平明显上升(P<0.01);相较于LPS 组,用黄芩苷处理后M1 表型标志物明显下降(P<0.01),见图1B、C。与对照组相比,用LPS 处理的U937 巨噬细胞CD86表达水平显著上升[(88.5±12.3)%vs(6.5±1.2)%,P<0.05],相较于LPS 组,黄芩苷处理组U937 巨噬细胞 CD86 表达水平显著下降[(72.5±10.4)%vs(88.5±12.3)%,P<0.01],见图1D。

Figure 1.Baicalin inhibited LPS-induced U937 macrophage polarization to M1.A:Western blot was used to detect the expression of HMGB-1 protein in each group;B:RT-qPCR detection of IL-1β mRNA;C:RT-qPCR detection of TNF-α mRNA;D:flow cytometry was used to detect the expression of CD86.Mean±SD. n=3.##P<0.01 vs control group;*P<0.05 vs LPS group.图1 黄芩苷抑制LPS诱导的U937巨噬细胞向M1极化
2 黄芩苷增加LPS诱导的U937细胞活力
使用CCK-8 实验测定细胞活力,与对照组相比,LPS 组的细胞活力明显降低(P<0.01),而黄芩苷处理组的细胞活力相较于LPS 组明显上升(P<0.05),见图2。

Figure 2.Baicalin enhanced the viability of U937 macrophages.Mean±SD. n=3.##P<0.01 vs control group;*P<0.05 vs LPS group.图2 黄芩苷提升U937巨噬细胞细胞活力
3 HMGB1 Ab 抑制 LPS 诱导的 U937 巨噬细胞向M1极化
将HMGB-1 Ab加入炎症模型的U937细胞中,结果表明,与LPS 组相比,HMGB-1 Ab 可以明显降低LPS 造成的M1 表型标志物的mRNA 水平上升(P<0.01),见图3A、B。同时,HMGB-1 Ab 可以明显降低LPS 诱导的 CD86 高表达[(64.7±8.2)%vs(74.1±7.5)%,P<0.05],见图3C。
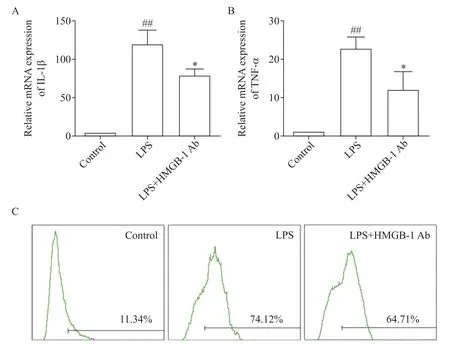
Figure 3.HMGB-1 neutralizing antibody(HMGB-1 Ab)inhibited LPS-induced U937 macrophage polarization to M1.A and B:RT-qPCR was used to detect the mRNA expression of IL-1β and TNF-α,respectively;C:the expression of CD86 was detected by flow cytometry.Mean±SD. n=3.##P<0.01 vs control group;*P<0.05 vs LPS group.图3 HMGB-1中和抗体抑制LPS诱导的U937巨噬细胞向M1极化
4 黄芩苷缓解急性肺损伤模型小鼠的肺部炎症
与对照组相比,模型组的肺湿干重比显著增加(6.8±1.4vs3.7±0.8,P<0.01),而黄芩苷处理组的肺湿干比较模型组明显降低(5.5±1.2vs6.8±1.4,P<0.05),见图4A。与对照组相比,模型组的HMGB-1 和M1 表型标志物明显增多(P<0.05),而黄芩苷处理组与模型组相比明显降低(P<0.05或P<0.01),见图4B~D。

Figure 4.Baicalin attenuated lung inflammation in acute lung injury model mice.A:lung wet/dry(W/D)weight ratio of the mice in each group;B,C and D:the concentrations of HMGB-1,IL-1β and TNF-α in the alveolar lavage fluid were measured by ELISA,respectively.Mean±SD. n=3.##P<0.01 vs control group;*P<0.05,**P<0.01 vs LPS group.图4 黄芩苷减轻急性肺损伤模型小鼠的肺部炎症
讨 论
急性肺损伤是一种严重的呼吸系统疾病,患者治疗预后差,死亡率高。临床主要表现为双侧弥漫性肺浸润,肺水肿,引起低氧血症,肺顺应性降低和有效余气量降低[15-16]。急性肺损伤是由肺部损伤造成的全身性炎症反应发展而成。越来越多的证据表明,巨噬细胞在急性肺损伤发病的过程中发挥了重要的作用,肺泡巨噬细胞和从血液中募集的巨噬细胞都参与其中[17-18]。巨噬细胞在炎症反应发展过程中具有多方面作用。通常,它们在早期发挥促炎作用,而在晚期发挥抗炎作用。按照对环境刺激的反应进行分类,巨噬细胞有两种极化状态:经典激活表型(M1)和交替激活表型(M2),M1 巨噬细胞的特征是高抗原呈递和促炎细胞因子(如IL-1β,IL-12,IL-23 及 TNF-α)的高表达,M1 型巨噬细胞与炎性,清除微生物和肿瘤细胞活性有关[19-20]。在急性肺损伤中,外周血单核细胞被募集到肺泡腔中,分化为具有M1表型的巨噬细胞[21]。过度的炎症反应会导致组织损伤,已有研究表明,消除肺部巨噬细胞或消耗促炎细胞因子可以减轻肺损伤[16]。表明巨噬细胞的表型转化是急性肺损伤治疗中一个潜在靶点。HMGB-1 是一种LPS 结合蛋白,能诱导产生促炎症细胞因子[22]。有研究证明,在自身免疫性心肌炎模型小鼠中,HMGB-1 促进了巨噬细胞向 M1 样表型的极化[8]。推测HMGB-1 介导的巨噬细胞向M1 转化可能是急性肺损伤的治疗靶点。
黄芩作为一味传统中药,是唇形科黄芩属多年生草本植物,其以根入药,味苦、性寒,有清热燥湿、泻火解毒、止血和安胎等功效。主治温热病、上呼吸道感染、肺热咳嗽、湿热黄胆、肺炎、痢疾和咳血等症[23]。而黄芩苷作为从黄芩中分离得到的主要活性成分而受到关注,已有许多关于黄芩苷的研究。有报道黄芩苷对内毒素相关的多组织损伤具有治疗作用,包括心肌功能障碍[24],还可以通过抑制细胞炎症因子表达在神经退行性疾病模型中发挥神经保护作用[25-26],对LPS 引起的肾炎也有治疗作用[27]。黄芩苷可以降低血管平滑肌细胞的 HMGB-1 表达[28],降低神经元细胞HMGB-1 和炎症因子表达发挥抗抑郁作用[29]。这些发现表明黄芩苷是炎症疾病的潜在治疗药物,并且很可能通过抑制HMGB-1 发挥抗炎作用,为了验证黄芩苷治疗急性肺损伤的机制,我们用人巨噬细胞系U937 进行实验。巨噬细胞M1 表型为促炎表型,特征为炎症因子表达上升,如TNF-α、IL-1β和 IL-12 p70[30-31]。CD86 作为巨噬细胞 M1 表型的标志物,可以通过流式细胞术检测细胞CD86的表达来验证细胞表型[32]。使用Western blot 和流式细胞术检测M1 标志物的结果显示,黄芩苷可以抑制LPS 引起的巨噬细胞向M1 表型极化,并降低其诱导的HMGB-1 蛋白水平升高。表明炎症模型下HMGB-1表达增加且巨噬细胞向M1极化,而黄芩苷可以抑制这些现象起到保护作用,说明黄芩苷的抗肺损伤作用与其相关。在炎症模型下,巨噬细胞的细胞活性下降,而加入黄芩苷可以防止这一效果。并且使用HMGB-1 中和抗体时,可以达到和黄芩苷类似的效果,说明黄芩苷是通过HMGB-1 来抑制巨噬细胞向M1 表型转化的。总之,细胞实验证明黄芩苷通过抑制HMGB-1 抑制巨噬细胞向M1 转化,并且有细胞保护作用。动物实验中,黄芩苷灌胃的小鼠的肺泡灌洗液中的HMGB-1 和M1 表型标志物,也是炎症因子的IL-1β 和TNF-α 表达相对于模型组显著减少,在体验证黄芩苷通过抑制HMGB-1 抑制巨噬细胞M1 表型的作用,肺湿干重比的结果也表明黄芩苷对LPS造成的肺水肿有明显保护作用。表明黄芩苷可以抑制LPS 造模带来的HMGB-1 升高和巨噬细胞M1 表型,减少肺组织水肿,从而发挥抗急性肺损伤的作用。
尽管急性肺损伤的发病率仍然很高,但近20 年来对其病理生理学的研究已使死亡率大幅降低。目前治疗的重点是通过呼吸机和药物干预如糖皮质激素来限制其进展,这些措施可以减少在肺内皮和上皮屏障处出现的炎症。但现有的治疗药物仍有缺陷,除机械呼吸外,需要更安全副作用小的药物治疗急性肺损伤。因此,开发一种更安全有效的急性肺损伤治疗方法是紧迫而重要的[17]。本文对治疗急性肺损伤的药物研发和选取提供了新思路,为黄芩苷作为急性肺损伤和其他炎性疾病的药物提供研究基础。
