TLR4/NF-κB信号通路对CBS+/-小鼠非酒精性脂肪性肝病的影响*
2021-08-04熊建团顾铃毓王青青董小艳刘达越徐灵博姜怡邓
熊建团 , 顾铃毓 , 王青青 , 丁 宁 , 董小艳 , 刘达越 ,徐灵博 , 焦 运 ,4, 姜怡邓 △
(1宁夏医科大学基础医学院,2宁夏医科大学临床医学院,3国家卫生健康委代谢性心血管疾病研究重点实验室,宁夏血管损伤与修复研究重点实验室,4宁夏医科大学总医院,宁夏银川750000)
非酒精性脂肪性肝病(nonalcoholic fatty liver disease,NAFLD)是一种慢性代谢性综合征,其特征是非酒精性因素引起的肝细胞内脂肪变性[1],其发病率在我国常见的肝脏疾病中较高[2]。肝脏是同型半胱氨酸(homocysteine,Hcy)合成和代谢的重要调节器官。已有研究表明慢性肝病、肝硬化和肝癌等肝脏疾病患者血浆Hcy浓度显著升高[3],因此Hcy在NAFLD中的作用日益受到重视。Toll 样受体4(Toll-like receptor 4,TLR4)是人类发现的第1个TLR相关蛋白[4]。作为识别细胞表面病原的分子之一,TLR4 被激发后通过一系列信号转导激活核因子κB(nuclear factor-κB,NF-κB),诱导肝细胞坏死、炎症和纤维化[5],但TLR4/NF-κB 信号通路是否在胱硫醚β-合成酶(cystathionine β-synthase,CBS)基因杂合敲除(CBS+/-)小鼠NAFLD的形成过程中发挥作用仍需进一步探索。因此,本研究主要探讨TLR4/NF-κB通路对NAFLD的影响,以期为防治NAFLD提供新的研究思路。
材料和方法
1 材料
Avanti J-30I 型高速低温离心机(Beckman Coulter);超纯水仪(Millipore);相差显微镜(Olympus);FTC-3000型实时荧光定量PCR仪(Funglyn Biotech);电泳仪、电转仪和凝胶成像系统(BIO-RAD)。RPMI-1640 培养基和胎牛血清(Gibco);RNA 提取试剂盒(北京天根技术有限公司);逆转录试剂盒和荧光定量PCR 试剂盒(Thermo Fisher Scientific);抗TLR4 抗体和抗NF-κB 抗体(Abcam);总胆固醇(total cholesterol,TC)及甘油三酯(triglyceride,TG)检测试剂盒(南京建成生物工程研究所);蛋白提取试剂盒(北京天根技术有限公司)。
2 方法
2.1 小鼠的饲养及分组 实验动物购于北京维尚利德公司,随机选取4 周龄CBS基因正常(CBS+/+)小鼠(n=6)及CBS+/-小鼠(n=6)均给予高蛋氨酸饮食。
2.2 小鼠血清TC、TG和Hcy浓度的检测及肝指数的计算 将CBS+/+组和CBS+/-组小鼠禁饮食12 h 后称重,麻醉并眼球取血,静置30 min 后分离血清。将血清样本交予金域医学检验集团股份有限公司,应用全自动生化仪检测血清中TC、TG 和Hcy 水平。随后将小鼠开腹并分离肝脏,用生理盐水清洗肝脏后称重(g),并计算肝指数。肝指数(%)=肝重/体重×100%。
2.3 小鼠肝脏组织TC 及TG 含量的测定 称取肝组织100 mg,用冷的生理盐水漂洗后加入1.9 mL 匀浆介质,冰浴下使用匀浆器(2 000 r/min)匀浆5 min后离心吸取上清即为10%肝匀浆。使用GPO-PAP法检测匀浆中的TC和TG含量。
2.4 HE 及油红O 染色检测肝组织形态的变化 取大小约0.5 cm×0.5 cm×0.5 cm 的肝组织,用10%中性甲醛固定24 h,石蜡包埋,切片机切厚度为5 μm的片子。HE 染色后,光镜下观察肝脏形态学的改变,每张切片观察5 个视野。取肝脏的冰冻切片进行油红O染色,肝细胞核呈紫蓝色,脂滴呈红色。
2.5 RT-qPCR 检测肝脏组织中 TLR4 及 NF-κB 的mRNA 表达 按照总RNA 提取说明书提取肝组织RNA,逆转录为cDNA,通过荧光定量PCR 仪进行扩增。由上海生工生物工程股份有限公司设计引物。TLR4 的上游引物序列为5'-AGACCTGTCCCTGAACCCTAT-3',下游引物序列为5'-CGATGGACTTCTAAACCAGCCA-3',扩增产物 147 bp;NF-κB 的上游引物序列为5'-AACAGAGAGGATTTCGTTTCCG-3',下游引物序列为5'-TTTGACCTGAGGGTAAGACTTCT-3',扩增产物 104 bp;内参照GAPDH 的上游引物序列为5'-GGTTGTCTCCTGCGACTTCA-3',下 游 引 物 序 列 为 5'-TGGTCCAGGGTTTCTTACTCC-3',扩增产物 183 bp。反应条件为:95 ℃预变性10 min;扩增阶段95 ℃变性5 s、60 ℃退火 20 s、72 ℃延长 30 s,50 个循环。采用 2-ΔΔCt法计算目的基因mRNA 的相对表达量,ΔCt=Ct目的基因-CtGAPDH,ΔΔCt=ΔCt待测样品-ΔCt校正样品。
2.6 Western blot 检测 TLR4 和 NF-κB 蛋白的表达水平 取100 mg肝脏组织,剪碎,加入1 mL PMSF 裂解液,用匀浆器在冰上匀浆数秒,4 ℃、12 000 r/min离心10 min。取上清液以BCA 法进行蛋白浓度测定;取等量蛋白与5×上样缓冲液混合煮沸5 min后进行SDS-PAGE(浓缩胶恒压80 V,30 min;分离胶恒压120 V,1 h);4 ℃、恒流0.3 A、2 h 电转移至PVDF 膜;5%脱脂奶粉室温封闭2 h,PBST洗膜;分别加入兔抗人TLR4和NF-κB 抗体(1∶1 000)4 ℃孵育过夜,PBST洗膜;加入对应的Ⅱ抗(1∶5 000)放置4 ℃过夜,PBST洗膜后进行曝光。采用Image Lab 软件对TLR4 和NF-κB及β-actin的灰度值进行分析。
3 统计学处理
计量资料以均数±标准差(mean±SD)表示。两组间均数比较采用t检验;多组间均数间比较采用单因素方差分析(one-way ANOVA),两两比较采用Student-Newman-Keuls法。以P<0.05为差异有统计学意义。
结 果
1 两组小鼠血清Hcy水平的变化
与CBS+/+组小鼠相比,CBS+/-组小鼠血清中Hcy水平升高且差异具有统计学意义(P<0.05),表明高同型半胱氨酸血症动物模型诱导成功,见图1。
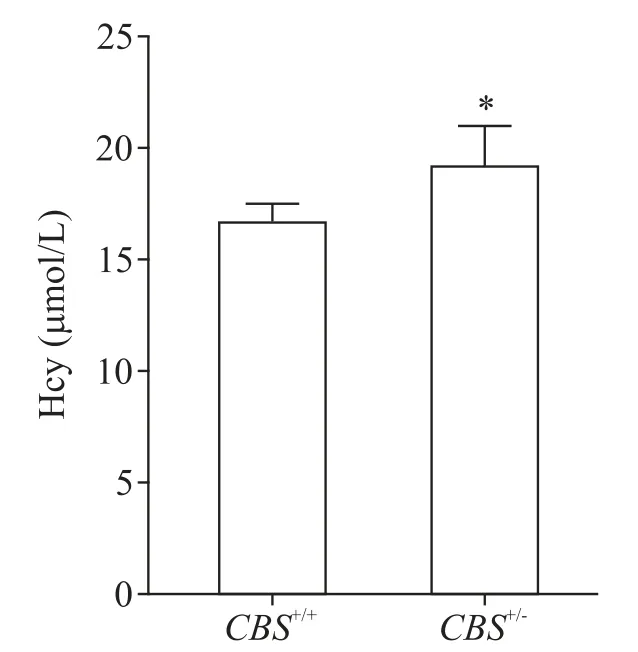
Figure 1.The serum levels of Hcy in CBS+/+ and CBS+/- groups.Mean±SD. n=6. *P<0.05 vs CBS+/+group.图1 CBS+/+组与CBS+/-组小鼠血清Hcy水平的比较
2 两组小鼠肝指数的比较
与CBS+/+组小鼠相比,CBS+/-组小鼠的肝指数显著升高(P<0.05),提示 Hcy 引起肝脏重量增加,见图2。
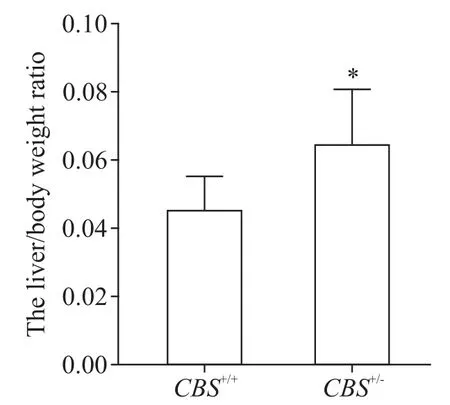
Figure 2.Liver-to-body weight ratio of the mice in CBS+/+and CBS+/-groups.Mean±SD. n=6. *P<0.05 vs CBS+/+group.图2 CBS+/+组与CBS+/-组小鼠肝体比
3 小鼠肝脏组织和血清中TC及TG含量的比较
与CBS+/+组比较,CBS+/-组小鼠肝组织(图3)及血清(图 4)中 TG 和 TC 含量显著升高(P<0.05 或P<0.01),表明Hcy能够提高血脂水平。

Figure 3.The contents of TC and TG in liver tissue.Mean±SD. n=6.**P<0.01 vs CBS+/+group.图3 肝组织中TC和TG含量的比较
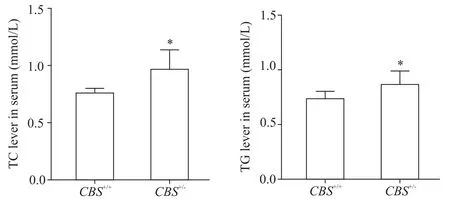
Figure 4.The contents of TC and TG in serum.Mean±SD. n=6.*P<0.05 vs CBS+/+group.图4 血清中TC和TG含量的比较
4 两组小鼠肝脏组织形态变化的比较
将HE 及油红O 染色切片置于低倍镜下观察,结果显示CBS+/+组小鼠肝小叶界限较清楚,细胞分布于中央静脉周围,大小较一致,可见肝窦,无脂肪变性。CBS+/-组小鼠肝细胞脂肪变性明显,细胞质可见大小不等的圆形空泡,偶尔可见重度脂肪变性,且小叶内因炎症细胞浸润,可引起坏死灶融合成片。见图5。
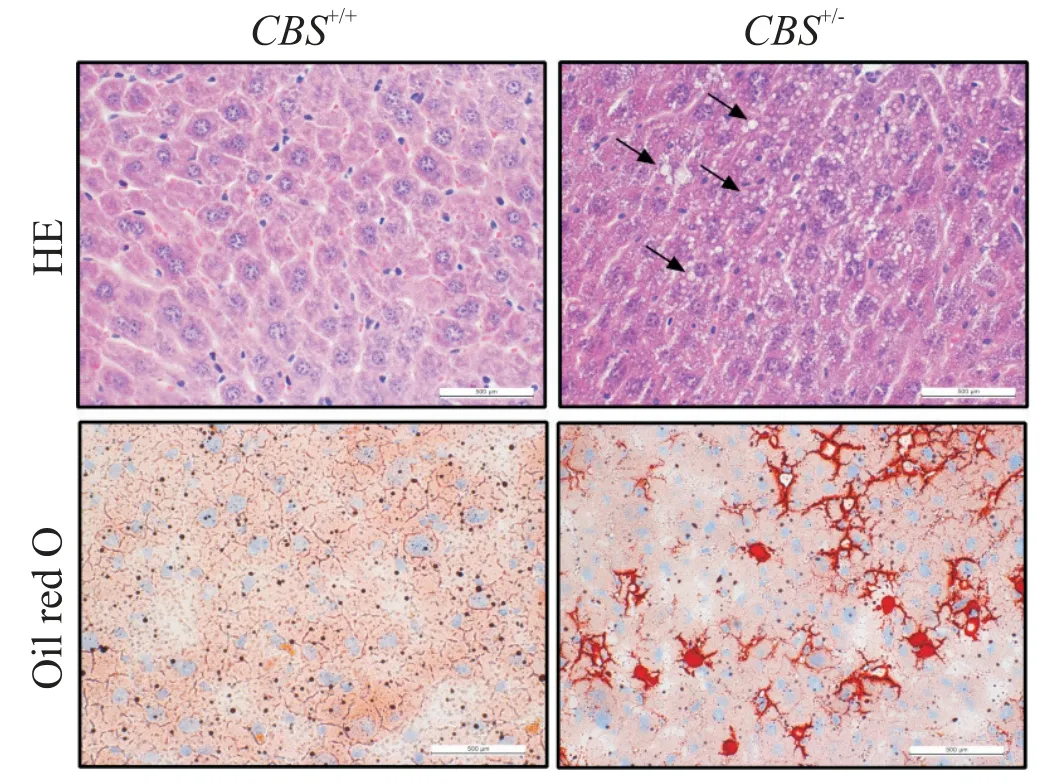
Figure 5.HE and oil red O staining of liver tissue(scale bar=500 μm).The transparent vesicles shown by the black arrows represent lipid droplets,the red represents the cytoplasm,and the blue represents the nucleus in HE staining.Red represents lipid droplets,and blue represents cell nuclei in oil red O staining.图5 肝组织的HE及油红O染色观察
5 两组小鼠肝组织中 TLR4 和 NF-κB 的 mRNA 和蛋白表达水平的比较
与CBS+/+组比较,CBS+/-组小鼠肝组织 TLR4 和NF-κB 的mRNA(图6)及蛋白(图7)表达水平均显著升高(P<0.01)。
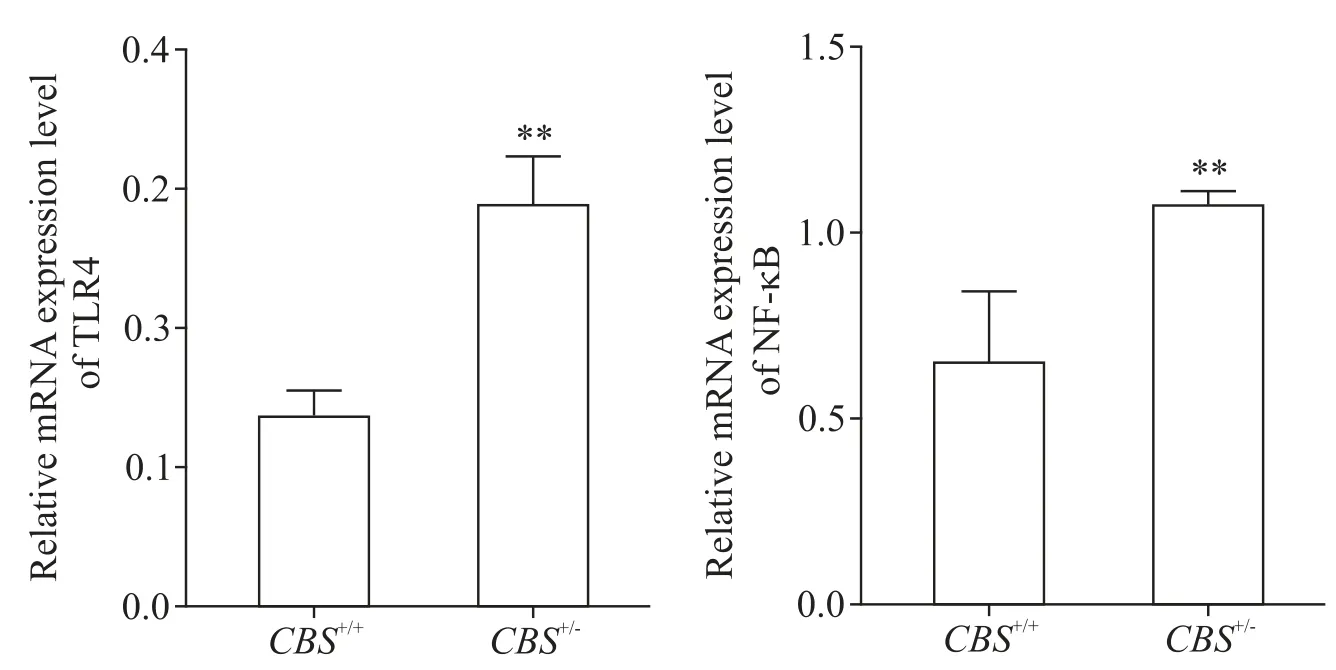
Figure 6.The mRNA expression of TLR4 and NF-κB in the liver tissues.Mean±SD. n=6.**P<0.01 vs CBS+/+group.图6 肝组织中TLR4和NF-κB的mRNA表达
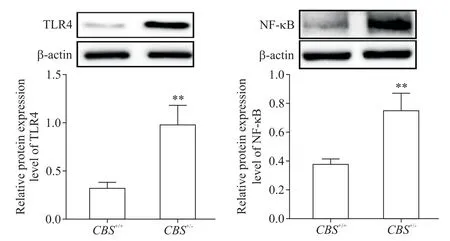
Figure 7.Protein expression of TLR4 and NF-κB in the liver tissues.Mean±SD. n=6.*P<0.01 vs CBS+/+group.图7 肝组织中TLR4和NF-κB的蛋白表达
6 TLR4和NF-κB表达与TC和TG的相关性分析
为进一步验证 TLR4 及 NF-κB 与 NAFLD 发生的相关性,对CBS+/-组小鼠TLR4 蛋白表达与TC 和TG含量进行相关性分析。结果显示,TLR4 蛋白表达与TC 和TG 含量呈正相关(r2=0.623 6,r2=0.707 6),NF-κB蛋白表达与TC和TG含量呈正相关(r2=0.812 3,r2=0.751 2),见图 8。表明 TLR4/NF-κB 信号通路与NAFLD的发生密切相关。
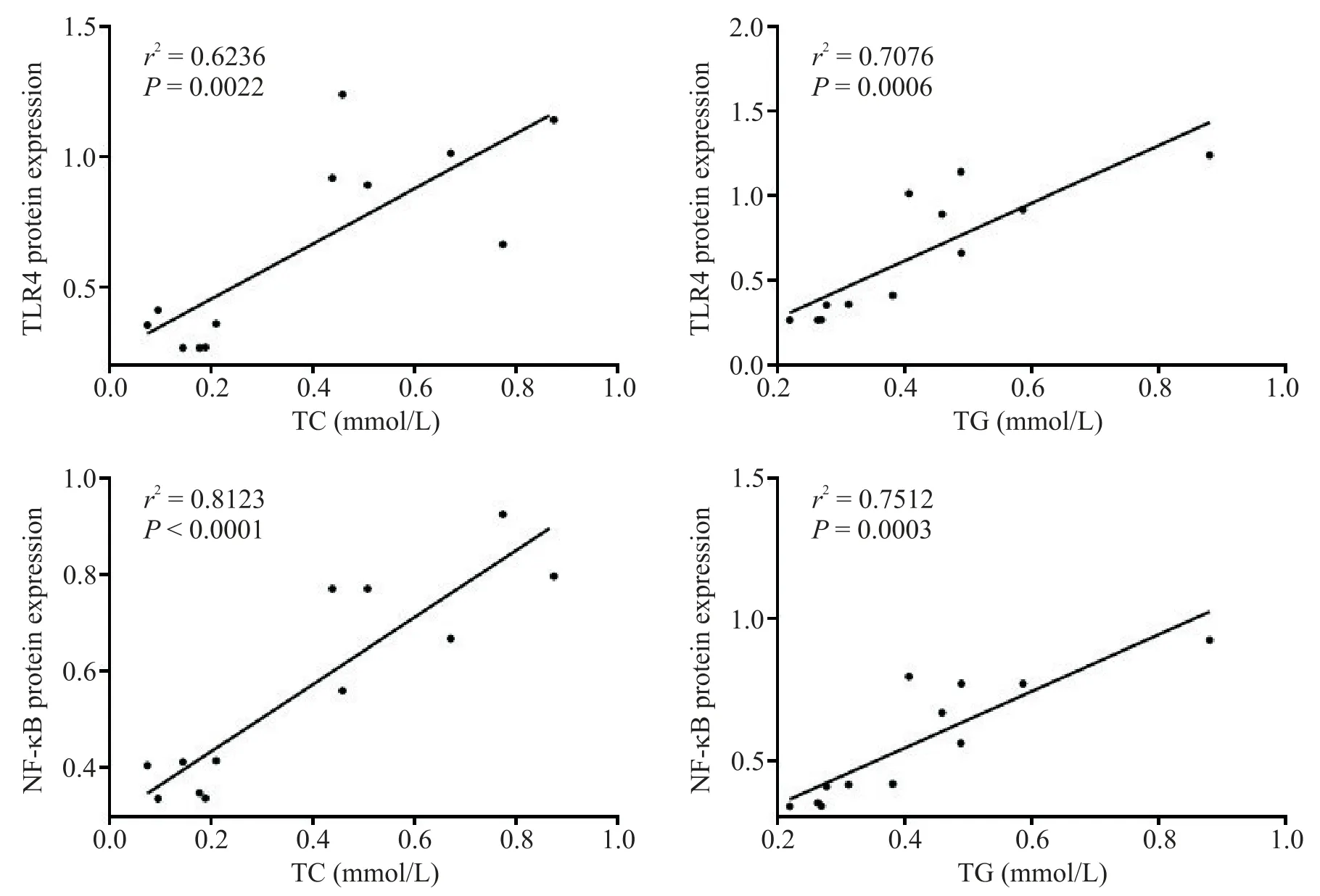
Figure 8.Analysis of the correlation between the protein expression of TLR4/NF-κB and the content of TC/TG in liver tissue.图8 肝组织中TLR4和NF-κB蛋白表达与TC和TG含量的相关性分析
讨 论
随着生活方式和饮食结构不断改变,我国人口肥胖程度不断增加,导致NAFLD 患病率出现快速且大规模增长,而其发生和发展的机制尚不完全清楚[6]。作为一种常见慢性肝脏疾病,NAFLD 包含多种肝脏组织学异常,其特征为炎症产生和组织损伤。NAFLD 起始于甘油三酯在肝细胞中的堆积,进而引起脂肪变性或非酒精性脂肪肝形成,后期可进展为非酒精性脂肪性肝炎,如不进行干预治疗,最终可导致纤维化及肝细胞癌等疾病产生[7]。有研究表明NAFLD 的发生发展与“多重打击”学说中氧化应激,脂质过氧化等多种病理过程有关[8]。
本研究发现CBS+/-小鼠中肝脏与体重比值及TC和TG 含量增加,脂肪变性明显,表明CBS缺乏可引起NAFLD的形成。CBS是一种存在于转硫途径中重要的催化酶,其基因突变使得酶活性降低或缺乏,进一步导致血浆 Hcy 水平升高[9],Hcy 升高可以改变细胞内的脂质代谢并促进肝脂肪积蓄[10]。因此,CBS缺乏可导致肝脏脂肪变性和肝功能障碍,其机制涉及肝脏中毒性同型半胱氨酸的积累或缺乏细胞保护性的胱硫氨酸和H2S的生成等过程[11]。
TLRs 是近年来发现的一类模式识别受体,通过识别病原相关分子,激活天然免疫,最终产生一系列炎症细胞因子释放和启动适应性免疫应答[12]。NF-κB 是TLR4 信号通路的下游效应蛋白,一种普遍存在且重要的核转录因子[13]。通过检测,我们发现CBS缺乏可引起 Hcy 升高,进而激活 TLR4/NF-κB 信号通路,且NF-κB 信号通路与NAFLD 的发生密切相关。在内皮细胞中,Hcy 可通过增加活性氧(reactive oxygen species,ROS)的产生进而促进炎症细胞因子的表达,其机制涉及上调NF-κB[14],同时已有研究表明 ROS 的大量产生能够促进 TLR4 表达升高[15]。因此,我们将继续探索Hcy 引起NAFLD 的发生是否与氧化应激及TLR4/NF-κB信号通路相互作用有关。
综上所述,本研究表明TLR4/NF-κB 信号通路可能在CBS+/-小鼠非酒精性脂肪肝的形成中扮演着重要作用。
