程序性细胞死亡蛋白4调控K562细胞活力和凋亡的研究*
2021-08-04龙馨妍何泽诏张慧慧袁仕善
龙馨妍, 何泽诏, 彭 鹏, 李 涛, 张慧慧, 袁仕善, 张 霞△
(湖南师范大学医学院 1免疫学教研室,2生物化学教研室,湖南长沙410013)
程序性细胞死亡蛋白4(programmed cell death protein 4,PDCD4)是 1995 年 Shibahara 等[1]在小鼠体内发现的一种与细胞凋亡相关的基因,随后在其他动物和人类中被鉴定出来[2]。人类PDCD4基因定位于染色体10q24 处,编码区约1.4 kb,编码469 个氨基酸。PDCD4 蛋白的氨基侧有2 个重要的α-螺旋结构区“MA3”,PDCD4 通过该结构域与翻译起始因子eIF4A分子结合,抑制核糖体复合物的形成和蛋白质的翻译。此外,PDCD4 还可以直接与mRNA 结合以抑制其翻译[3]。PDCD4 作为一种新的肿瘤抑制因子,在很多实体肿瘤中,如乳腺癌、结肠癌、肝癌和肺癌中表现为下调甚至缺失,常预示着肿瘤的恶性程度及不良预后,其发挥抑癌作用主要是通过抑制一组与肿瘤细胞增殖、迁移、侵袭和转移有关的基因的翻译而实现的,而且其在不同组织类型中发挥的作用不尽相同[4-5]。慢性粒细胞白血病(chronic myeloid leukemia,CML)是造血系统肿瘤,其主要特征是9 号染色体上ABL基因和22 号染色体上的BCR基因相互融合形成了BCR-ABL融合基因进而表达BCRABL 蛋白,很多学者都致力于靶向BCR-ABL 及其相关通路的研究[6]。我们前期研究显示PDCD4 在慢性粒细胞白血病中表达显著下调,而且PDCD4 的表达和BCR/ABL 表达成负相关,PDCD4 的表达上调伴随着细胞增殖抑制[7],另有研究表明慢性淋巴细胞白血病中也存在PDCD4 的表达下调[8],这些结果都提示我们PDCD4 除了在实体肿瘤中发挥作用,同时也能影响血液肿瘤,然而PDCD4 在血液肿瘤中具体的作用和机制仍不清楚。
本研究通过在人慢性粒细胞白血病细胞系K562 中过表达 PDCD4,研究 PDCD4 对 K562 细胞的活力、周期和凋亡的作用,并进一步通过转录组测序(RNA sequencing,RNA-seq)检 测 确 定 PDCD4 在K562细胞中调控的下游基因,为深入研究PDCD4对K562作用的分子机制提供实验依据。
材料和方法
1 细胞和实验主要材料
人慢性粒细胞白血病细胞系K562 由山东大学附属第二医院血液病实验室馈赠,PDCD4 过表达慢病毒和对照慢病毒[均携带绿色荧光蛋白(green fluorescent protein,GFP)]购自上海吉凯基因。RPMI -1640 培养液和胎牛血清(Gibco);总 RNA 提取试剂Trizol(Invitrogen);逆转录试剂盒和实时荧光定量PCR 检测试剂盒(Gene Copoeia);CCK-8 试剂盒(Biosharp);细胞周期检测试剂盒和细胞凋亡检测试剂盒(江苏凯基生物技术股份有限公司);彩虹蛋白Marker 和BCA 蛋白检测试剂盒(Thermo Fisher Scientific);PDCD4 单抗和 β-actin 单抗(Cell Signaling Technology)。
2 方法
2.1 K562细胞培养 K562细胞培养于含10%胎牛血清的RPMI-1640 培养液中,并将其置于37 ℃、5%CO2的孵育箱中,根据细胞培养情况进行换液及传代处理,取处于生长对数期的细胞进行后续实验。
2.2 构建稳定的过表达细胞系 取对数生长的K562细胞接种于24孔板,每孔5×104个细胞,分别感染PDCD4 过表达慢病毒和空载体慢病毒,MOI 设置为30,72 h后用荧光显微镜确定感染效率,加入终浓度为2.5 mg/L 的嘌呤霉素(purornycin,Puro)进行筛选 5~7 d,得 到阳性克隆 PDCD4 过表达(K562-PDCD4)组和空载体对照(K562-MOCK)组并进行扩增培养。
2.3 RT-qPCR 收集 K562、K562-MOCK 和 K562-PDCD4 3 组细胞各 1×106个,采用 Trizol 一步法抽提细胞总RNA,用核酸蛋白定量仪测定RNA 纯度和浓度,按照逆转录试剂盒说明书进行逆转录反应,采用SYBR Green 实时荧光定量PCR 方法检测目的基因mRNA 的表达。引物由Invitrogen 设计合成,详细信息见表1。反应体系为20 μL,反应条件为:95 ℃10 min;95 ℃ 10 s,60 ℃ 20 s,72 ℃ 15 s,共计 40 个循环。每个样本设3 个复孔,以2-ΔΔCt表示目的基因在实验组与对照组中表达的倍比关系。

表1 RT-qPCR引物序列信息Table 1.The sequence of primers for RT-qPCR
2.4 Western blot 收集上述3 组细胞各1×106个,加入200 μL RIPA细胞裂解液置于冰上裂解,13 400×g离心5 min,收集上清液,采用BCA 蛋白定量试剂盒测定蛋白浓度。取30 μg蛋白样品加入上样缓冲液,煮沸 10 min 进行变性,12% SDS-PAGE 分离后,采用湿转的方法将蛋白转移至PVDF 膜;用含5%脱脂奶粉的TBST 封闭1 h;再将膜分别浸入1∶2 000 稀释的兔抗人PDCD4 单克隆抗体和1∶2 000 稀释的兔抗人β-actin多克隆抗体中,4 ℃孵育过夜,TBST洗膜3次,每次10 min;最后在1∶2 000 稀释的羊抗兔Ⅱ抗中室温孵育 1 h;TBST 洗 3 次,每次 10 min;滴加 ECL 化学发光液显影。
2.5 CCK-8 实验 取上述各组处于对数生长期的细胞制成单细胞悬液,以每孔5 000个的密度接种于96 孔板中,共设4 个时点(0、24、48 和72 h,细胞接种当天为0 h),每个时点设3 个复孔。置于37 ℃、5%CO2培养箱中培养至各时点后,加入CCK-8 溶液(每孔10 μL)继续培养,2 h后用酶标仪检测450 nm处吸光度(A450)。根据各组细胞相对活力,绘制细胞生长曲线。
2.6 细胞周期 取上述各组对数生长期细胞1×106个,PBS 洗涤 1 遍,弃掉上清后,加入 500 μL 预冷的70% 乙醇,4 ℃固定过夜,PBS 洗涤1 遍,加入500 μL PI/RNase A 工作液(PI∶RNase A=9∶1),室温避光30~60 min,细胞悬液用200 目筛网过滤一次,使用流式细胞仪记录激发波长488 nm 处红色荧光,检测细胞DNA含量。应用FlowJo软件分析细胞周期数据。
2.7 细胞凋亡 取上述各组处于对数生长期的细胞,将细胞密度调至5×108/L接种于6孔板中,各孔加入终浓度为2.5 μmol/L 阿糖胞苷(cytosine arabinoside,Ara-C)预处理48 h 后,离心收集各组细胞,PBS洗涤2遍,弃掉上清,加入500 μL的Binding Buffer 重悬细胞,加入5μL Annexin V-APC 和5μL 7-AAD 染液混匀;室温、避光、反应5~15 min,进行流式细胞仪的观察和检测。应用FlowJo 软件分析细胞凋亡数据。
2.8 RNA-seq 实 验 将 K562-MOCK 组 和 K562-PDCD4组的细胞样本送到深圳华大基因股份有限公司的基因组服务中心进行分析,用Trizol一步法提取两组细胞中的总RNA,构建质量合格的DNA 文库后,使用BGISEQ 平台进行测序。每组检测3 个样本,取3 个样本数据的平均值对结果进行分析。为了验证RNA-seq的准确性,随机挑选6个差异基因进行RT-qPCR检测以验证基因芯片结果。引物的序列信息见表1。
3 统计学处理
采用SPSS 18.0 软件进行统计分析。所有的实验均采用独立重复3 次的数据,用均数±标准差(mean±SD)表示,3 组间数据比较采用单因素方差分析,两组间数据的比较采用独立样本t检验,以P<0.05为差异有统计学意义。
结 果
1 稳定过表达PDCD4 的K562 细胞系的构建及鉴定
慢病毒感染K562 细胞72 h 后,在荧光显微镜下观察显示,K562-PDCD4 组和 K562-MOCK 组均可见绿色荧光,而空白对照K562组未见荧光(图1A)。筛选得到稳定表达细胞系后,流式细胞仪检测到病毒表达蛋白GFP 的阳性率达到95%以上(图1B);RT-qPCR 和 Western blot 结 果 显 示 ,K562-PDCD4 组PDCD4 mRNA 水平和蛋白水平均显著升高(图1C、1D)。上述实验结果证明成功构建了稳定过表达PDCD4 的K562 细胞系,可用于下一步的细胞功能分析。

Figure 1.Expression of PDCD4 in the K562 cells infected by lentivirus.A:GFP positive cells which meant successful infection of the lentivirus were observed under fluorescence microscope(scale bar=50 μm).Almost all the cells of K562-MOCK and K562-PDCD4 groups showed green fluorescence,while no fluorescence was observed in K562 group.B:the proportion of GFP positive cells detected by flow cytometry(K562:0.23%;K562-MOCK:98.8%,K562-PDCD4:98.2%).C:the mRNA level of PDCD4 detected by RT-qPCR;D:the protein level of PDCD4 detected by Western blot.Mean±SD. n=3.*P<0.05 vs K562-MOCK group.图1 慢病毒感染的K562细胞中PDCD4的表达
2 过表达PDCD4对K562细胞活力的影响
CCK-8 实验检测过表达 PDCD4 后 K562 细胞的活力变化情况。结果显示,培养24 h后,K562、K562-MOCK 和K562-PDCD4 3 组细胞的活力没有明显差异,但在培养 48 h 和 72 h 后,K562-PDCD4 组的细胞活力比K562 组和K562-MOCK 组明显减若,有显著差异(P<0.05),见图2。

Figure 2.The growth curves of the K562 cells after over-expression of PDCD4.CCK-8 assay was used to detect the viability of cells.Mean±SD. n=3.*P<0.05 vs K562-MOCK group.图2 过表达PDCD4后K562细胞生长曲线图
3 过表达PDCD4对K562细胞周期的影响
用PI 对细胞进行染色,运用流式细胞仪检测过表达PDCD4 后K562 细胞周期的变化情况。FlowJo软件分析结果显示,与K562 组和K562-MOCK 组相比,K562-PDCD4 组 S 期的细胞比例下降、G2/M 期细胞比例增加(P<0.05),见图3。

Figure 3.Effects of PDCD4 over-expression on cell cycle of K562 cells.Mean±SD. n=3.*P<0.05 vs K562-MOCK group.图3 过表达PDCD4对K562细胞周期的影响
4 过表达PDCD4对K562细胞凋亡的影响
采用Ara-C 诱导细胞凋亡,Annexin V-APC/7-AAD 染色检测过表达PDCD4 后K562 细胞凋亡的变化情况。结果显示,与K562 组和K562-MOCK 组相比,K562-PDCD4 组细胞的早期凋亡率没有明显变化,但是总凋亡率增加且有显著差异(P<0.05),见图4。
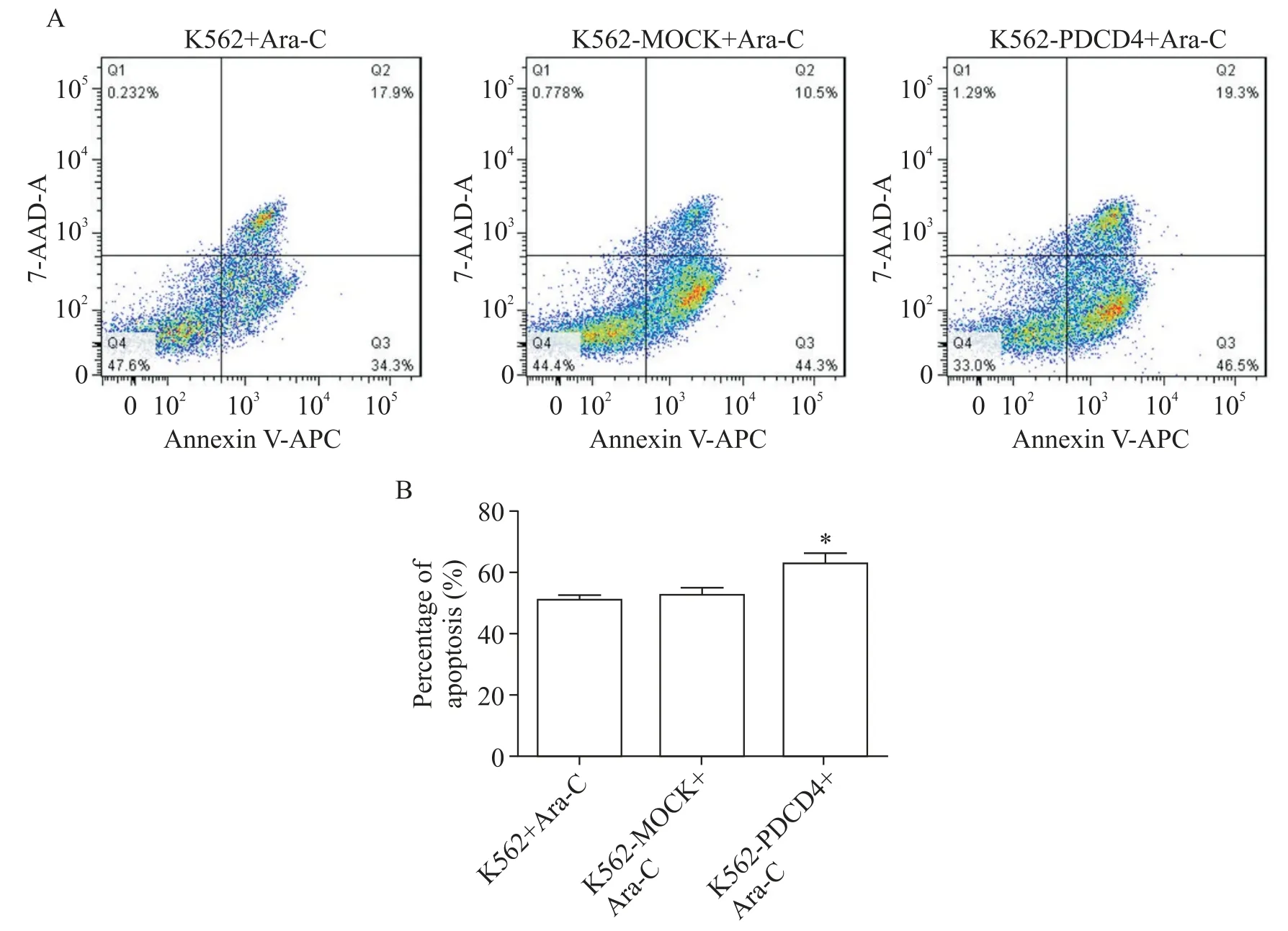
Figure 4.Effects of PDCD4 over-expression on apoptosis of Ara-C-stimulated K562 cells.Mean±SD. n=3.*P<0.05 vs K562-MOCK+Arac-C group.图4 过表达PDCD4对K562细胞凋亡的影响
5 PDCD4过表达对K562细胞基因表达谱的影响
收集K562-MOCK和K562-PDCD4两组细胞的总RNA,经鉴定质量合格后进行RNA 测序分析,每组选取3 个样本取平均值,进行差异表达基因筛选。结果显示,与K562-MOCK 组比较,K562-PDCD4组有394 种基因有明显差异表达,其中16 种基因的水平上调,378 种基因的水平下调。根据KEGG pathway富集分析找出差异表达基因中富集的信号通路,表明这些基因功能涉及多个方面,包括新陈代谢、细胞周期调控、细胞信号转导、凋亡和细胞自噬等,见图5、6 和表 2。选取其中 6 个基因进行 RT-qPCR 验证,其中 2 个表达上调的基因:TENM4和MAP3K7CL,以及 4 个表达下调的基因:PIK3CA、TRPM7、CCDC186和RANBP3L。结果显示,这6 个差异基因的相对表达量与测序结果趋势一致,验证了RNA-seq 结果的可靠性,见图7。

Figure 5.Cluster map of the differentially expressed genes.The horizontal axis is the log2(expression value + 1)of the sample,and the vertical axis is the gene.The redder,the higher expression,and the bluer,the lower expression. n=3.图5 差异基因表达聚类图
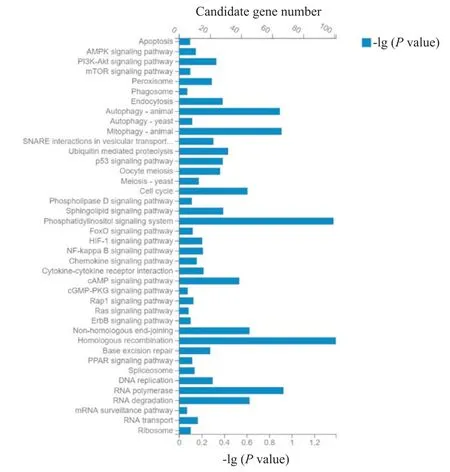
Figure 6.KEGG pathway enrichment histogram of the differentially expressed genes.The horizontal axis:the blue represents the -lg(P value)of the sample;the orange represents the number of candidate gene.The vertical axis is the signal pathway.图6 差异基因KEGG pathway富集柱状图
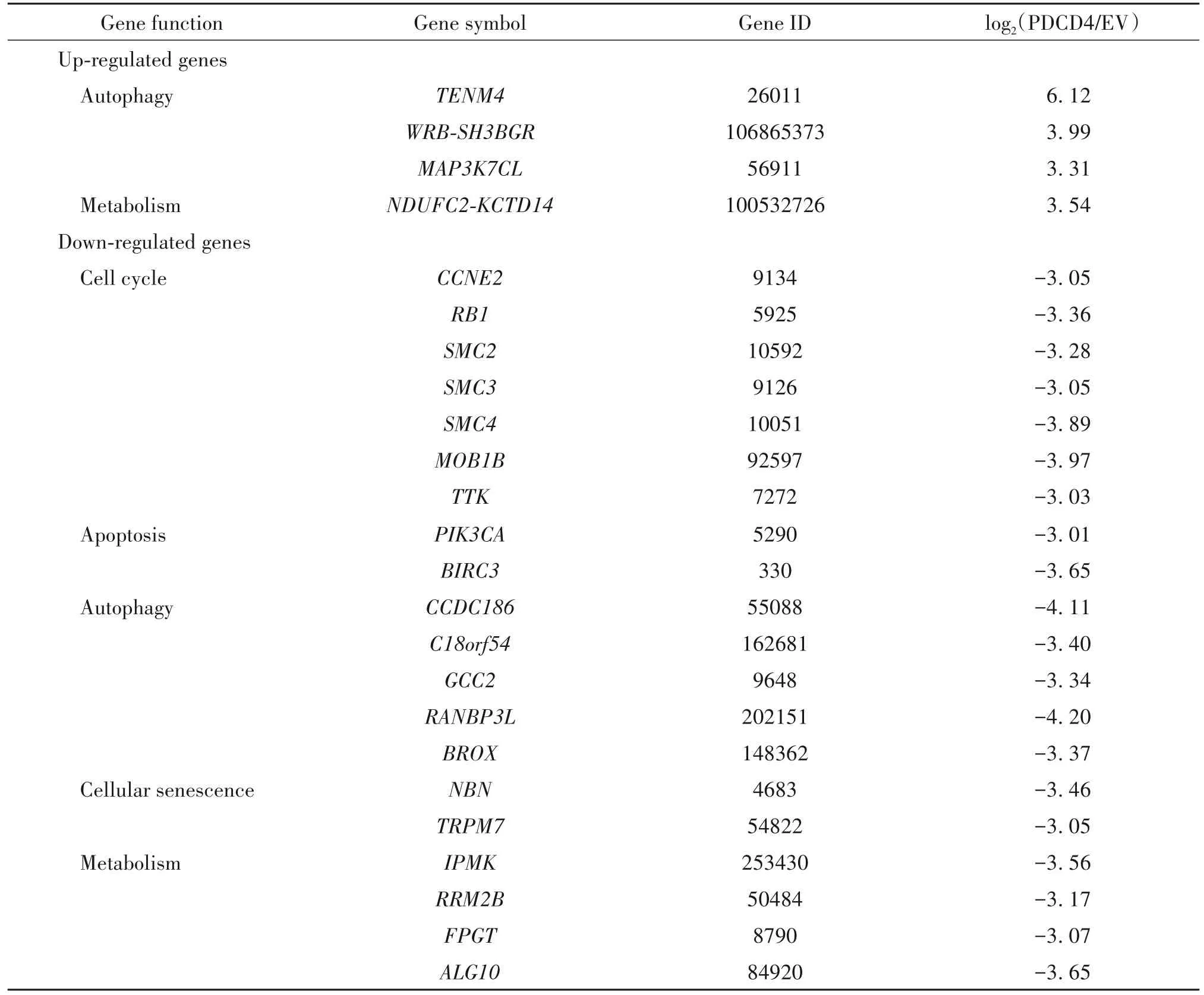
表2 部分上调或下调基因Table 2.Partially up-regulated or down-regulated genes

Figure 7.The mRNA levels of differentially expressed genes.Mean±SD. n=3.*P<0.05 group vs K562-MOCK group.图7 RT-qPCR验证RNA-seq测序结果
讨 论
PDCD4 是一种新的肿瘤抑制因子,具有抑制细胞生长、肿瘤侵袭、转移和诱导细胞凋亡等功能,在多种实体肿瘤中表达下调,但PDCD4 在血液肿瘤中的研究报道较少。我们在前期研究中证实PDCD4在慢性粒细胞白血病中表达降低,且和融合基因BCR/ABL的表达呈负相关,提示 PDCD4 在 CML 中发挥作用。本研究通过慢病毒表达系统在人类慢性粒细胞白血病细胞系K562 细胞中过表达PDCD4,显示PDCD4 可以明显抑制其细胞活力,诱导细胞周期阻滞并促进细胞凋亡,并且通过RNA-seq 分析了差异表达基因,为进一步研究其作用机制提供了依据。
PDCD4在肿瘤中的表达普遍降低并且受多方面因素的调控,其中miR-21 可以独立调控PDCD4 的表达[9-10]。目前,在多种肿瘤中证实miR-21可以通过下调PDCD4 的表达促进肿瘤细胞转化,影响肿瘤细胞的增殖和侵袭[11-12]。在血液肿瘤中也有研究表明反义抑制miR-21 上调PDCD4 水平可有助于CML 的治疗[13],并且采用miR-21 拮抗剂可以通过诱导凋亡增强K562 细胞对三氧化二砷(一种用作治疗白血病的中药)的敏感性[14]。这些结果都提示我们PDCD4作为一个抑癌基因,不仅仅对实体肿瘤有抑制作用,对血液肿瘤同样也发挥作用。最近有报道称转录因子STAT5 的磷酸化,可以直接或间接由BCR-ABL1 和FLT3-ITD(AML)驱动,从而使miR-21 的表达上调,表明酪氨酸激酶-STAT5-miR-21-PDCD4 调节轴在CML 和 AML 的进展和恶性增殖中发挥重要作用[15]。然而,PDCD4 对CML 存在哪些作用,目前未见有直接的研究报道。因此,我们在CML 代表性细胞系K562 中过表达 PDCD4,研究 PDCD4 对 K562 细胞的作用及其可能的机制。
首先,我们通过CCK-8 实验证明PDCD4 可以抑制K562 细胞的活力,这个结果和实体肿瘤中的研究结果是一致的,在很多肿瘤实验中都显示了PDCD4可以抑制肿瘤细胞增殖,包括乳腺癌[16],鼻咽癌[17]和胶质瘤[18]等;其次,我们显示 PDCD4 可以改变 K562的细胞周期,表现为G2/M 期阻滞。这个结果和其他实体肿瘤的研究有些不同,比如在非小细胞肺癌中,PDCD4 通过抑制PI3K/AKT 通路及其下游的细胞周期蛋白 CCND1 和激酶 CDK4 从而诱导 G1期阻滞[19];而我们之前的研究显示PDCD4 对卵巢癌细胞的周期调控则是诱导S 期阻滞[20]。在本研究中,我们证实PDCD4 可以诱导K562 细胞的G2/M 期阻滞,也有研究表明异紫堇定碱可通过PDCD4 诱导G2期阻滞从而诱导肝癌细胞凋亡[21]的,但是具体的作用机制不清楚。最近有研究表明PDCD4 可在端粒酶永生化的人类上皮细胞系中抑制p53基因活性,阻止p53
激活 G1/S 检查点[22]。在肝癌细胞中PDCD4敲低会抑制细胞生长以及诱导视网膜母细胞瘤蛋白(retinoblastoma protein,Rb)磷酸化,这个过程是通过下调Rb自身、下调磷酸化Rb的细胞周期蛋白依赖性激酶(cyclin-dependent kinases,CDKs)的表达以及上调CDK 抑制剂 p21 的表达来完成的[23]。因此,我们推论PDCD4 很可能是通过直接或间接作用于细胞周期蛋白或激酶来发挥作用的,相关的靶点还需要进一步确证。
由于很多抑癌基因可以使细胞周期阻滞在G2/M期并促进细胞凋亡[24],因此,我们进一步检测了PDCD4 对K562 细胞凋亡的影响,结果表明PDCD4可以促进阿糖胞苷诱导的细胞凋亡。PDCD4是在细胞凋亡时发现的表达上调基因,因此有很多关于PDCD4 促进细胞凋亡的研究。已有研究表明PDCD4蛋白在胞核内积累,激活Bcl-2蛋白家族的促凋亡成员Bax 和caspases-8-9 和-3,诱导肝癌细胞凋亡[25]。我们也在卵巢癌中发现PDCD4 可以促进顺铂诱导的细胞凋亡,主要是通过抑制凋亡抑制因子c-FLIP 从而增强 caspases-8 的活性来实现的[26]。然而,最近有研究指出PDCD4 通过抑制proCASP3mRNA 表达而在 HeLa 细胞中起抗凋亡作用[27],这表明PDCD4 的促凋亡作用仅局限于某些细胞类型。很早就有学者提出,PDCD4 的作用具有细胞特异性[28],在不同的细胞类型中,PDCD4发挥的作用不尽相同,甚至还出现相反的情况,因此我们研究PDCD4在K562 细胞系中的作用机制就更加重要,血液肿瘤和实体肿瘤细胞的恶性行为存在一定的差异,基因表达谱也不同。
在本研究中,我们通过转录组测序分析K562-PDCD4和对照K562-MOCK 两种细胞基因表达差异,初步筛选PDCD4在K562细胞中下游潜在的靶基因,为后续的分子机制研究奠定基础。我们的结果显示,与对照组相比,过表达PDCD4 的K562 细胞有394 种差异表达基因,其中表达上调的有16 种,表达下调的有378 种。这可能和PDCD4 的作用机制有关,目前认为PDCD4 是个翻译抑制因子,其主要通过抑制基因的翻译来调控基因的表达从而在不同的细胞种类中发挥不同的作用,因此下调基因占大部分。我们进一步分析显示这些差异表达的基因与新陈代谢、细胞周期调控、细胞信号转导、凋亡和细胞自噬等相关,提示PDCD4在K562细胞中可能通过参与调节这些信号转导通路而发挥作用。除了细胞周期和凋亡,这些基因中很多和自噬相关,而我们前期实体肿瘤细胞实验也显示PDCD4 可以通过直接抑制自噬相关蛋白ATG5 的翻译从而发挥很强的自噬抑制作用[29]。新近研究显示免疫反应、造血干细胞分化和肿瘤细胞的耐药性都和自噬相关。在血液肿瘤中,调节自噬可能成为一个在靶向治疗领域有前途的研究方向[30]。因此,PDCD4 是否能调节 K562 细胞的自噬是我们将要解决的一个问题。此外,基因测序还提示了很多PDCD4 调控的下游信号转导通路,为进一步的机制研究提供了方向。
综上所述,本研究初步探讨了PDCD4对K562细胞的作用,在后续工作中,我们将根据测序的结果继续深入研究PDCD4 在K562 细胞中具体的分子作用机制,或进一步进行体内实验以更系统的阐述PDCD4 在髓系白血病CML 中的作用,期望找到更好的靶点,为CML 的发生发展以及防治措施的研发提供初步的参考资料。
