同轴2.2 mm及3.0 mm小切口超声乳化手术治疗白内障效果分析
2021-08-04陈金赖铭莹
陈金,赖铭莹
白内障作为眼科第一致盲性疾病,中国白内障致盲率占据全球总数的46.93%。年龄相关性白内障占白内障人群中很大比重,随着人口老龄化加重,白内障人数也呈上升趋势[1]。现阶段,超声乳化术是治疗白内障患者的首选术式,随着手术方式的多样化,如何通过更小切口、更小损伤达到更好手术效果已经成为临床治疗白内障的重要要求[2]。白内障超声乳化手术中的角膜切口制作是非常重要的一个步骤,会影响到角膜甚至全眼的光学质量。切口选择由过去传统主流2.8 mm、3.0 mm到目前2.2 mm、1.8 mm等,切口的日趋缩小使得患者在术后早期有较好的角膜屈光稳定性,有助于患者早期视力的恢复[3]。为此,本资料回顾我院收治的280例白内障患者,分析同轴2.2 mm与3.0 mm小切口超声乳化手术治疗白内障患者的临床效果,报告如下。
1 资料与方法
1.1 一般资料 本文通过对2017年2月—2020年2月期间我院收治的280例白内障患者病例进行回顾性分析,根据不同手术方式分为对照组和观察组。对照组(140例,146眼)采用3.0 mm同轴小切口超声乳化手术治疗,观察组(140例,148眼)采用2.2 mm同轴小切口超声乳化手术治疗。对照组男73例(76眼),女67例(70眼);年龄50~86(72.56±5.37)岁;术前视力:21眼:<0.1,57眼:0.12~0.3,37眼:0.4~0.5,31眼:>0.5 。观察组男71例(74眼),女69例(74眼);年龄53~85(73.47±5.28)岁;术前视力:23眼:<0.1,60眼:0.12~0.3,39眼:0.4~0.5,26眼:>0.5。纳入标准:经角膜地形图检查显示角膜散光<2.00D;晶状体核为Ⅱ~Ⅲ级。排除标准:伴有葡萄膜炎、角膜炎、青光眼等眼部基础疾病者;合并高血压、糖尿病并有相关眼底疾病者;有陈旧性眼外伤病史及眼部手术史者;高度近视患者。2组一般资料比较差异无统计学意义(P>0.05),具有可比性。本研究获得医院伦理委员会批准。
1.2 方法
1.2.1 术前检查 术前常规检查,记录患眼裸眼视力、角膜曲率、裂隙灯、眼科A/B超、眼底照相、角膜内皮细胞等;人工晶状体度数使用IOLMASTER500(德国CARL ZEISS)检查并采用SRK-T人工晶状体计算公式计算。
1.2.2 手术方式 2组患者术前1小时均采用复方托吡卡胺滴眼液点眼施以扩瞳,术前15 min开始施行表面麻醉,使用盐酸丙美卡因滴眼液(美国ALCON)滴眼3次。常规消毒、铺巾、贴膜,用开睑器开眼睑。2组患者均在1~2点方位用一次性1.5 mm穿刺刀(日本MANI)做侧切口,从侧切口注入透明质酸钠(上海其胜)。对照组用一次性3.0 mm刀(日本MANI)于10~11点位做主切口;观察组用一次性2.2 mm刀(日本MANI)于10~11点位做主切口。做连续环形撕囊5~6 mm。待水分层、分离后,采用劈核钩行以拦截劈核,并用超声软化模式分解核块并吸除,用IA模式注吸残留皮质;之后囊袋内均注入适量的透明质酸钠(上海其胜),用推注器将人工晶状体植入囊袋内,后吸除多余的透明质酸钠,封闭切口并检查无渗漏,最后涂抹妥布霉素地塞米松眼膏于结膜囊内,包扎术眼。
1.3 观察指标 (1)术后角膜水肿评价及分级:裂隙灯下比较2组术后第1天角膜水肿的情况,按照角膜水肿部、范围以及对角膜的透明度影响程度可分为Ⅰ~Ⅳ级,Ⅰ级为角膜内皮呈线状或者片状混沌,Ⅱ级为角膜基质表现为弥漫性水肿,Ⅲ级为角膜后弹力层以及内皮出现褶皱,Ⅳ级为全角膜水肿。(2)裸眼视力:记录2组患者术前、术后1周、1、3个月的裸眼视力。(3)验光数据:记录2组患者术前、术后1周、1、3个月的验光数据,特别关注散光的情况。

2 结果
2.1 2组患者术后1天角膜水肿的情况比较 术后,观察组角膜水肿发生率低于对照组,差异有统计学意义(P<0.05)。见表1。

表1 2组患者术后1天角膜水肿情况比较
2.2 2组患者角膜散光情况比较 术前,2组角膜散光比较差异无统计学意义(P>0.05);术后1周,观察组的散光改变小于对照组(P<0.05);但在术后1、3个月,2组的散光水平均趋于稳定,差异无统计学意义(P>0.05)。见表2。
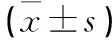
表2 2组患者角膜散光情况比较
2.3 2组患者裸眼视力比较 术后,观察组术后1天、1周、1个月的裸眼视力均优于对照组(P<0.05);术后3个月的裸眼视力比较无统计学意义(P>0.05)。见表3。

表3 2组患者裸眼视力比较
3 讨论
现代白内障手术趋势已经由过去单纯复明手术转变为屈光手术,屈光白内障手术已经成为白内障手术主流趋势。大部分患者从追求单纯视力提高转变为追求术后视觉质量提高,对手术细节及要求提高,包括手术方式选择、人工晶体选择等[4]。在手术方式选择上,对超声乳化术改进方向应致力于以最小损伤达到最优疗效以及最佳视力水平。传统3.0 mm同轴小切口超声乳化手术,术中前房稳定性略差,极易引发角膜水肿;2.2 mm同轴小切口超声乳化手术具有切口小、术中密闭性强,前房稳定等优势,随着手术切口逐渐减小,白内障手术也进一步进入超微创技术时代[5-6]。
角膜内皮细胞为维持眼角膜透明性的重要因素,因此内皮损伤会导致角膜水肿,引发视力下降。术中损伤角膜内皮细胞的因素较多,临床研究[7]发现:超声能量等对角膜内皮细胞刺激是形成角膜水肿的重要原因,超声能量会破坏角膜内皮细胞完整性,角膜内皮细胞损伤程度与超声时间、超声能量、刺入针头角度等呈正相关性。张瑞帆等[8]对2.2 mm及3.0 mm切口白内障超声乳化术后患者角膜内皮细胞计数、角膜内皮细胞六边形百分率和中央角膜厚度进行观察,发现微切口组即2.2 mm组对角膜内皮细胞影响更小,安全性更高。本资料通过观察患者术后角膜水肿情况,发现两组同轴小切口超声乳化手术患者术后角膜水肿发生率,2.2 mm切口观察组少于3.0 mm切口对照组。
同时白内障患者术后散光情况与其手术切口大小存在着直接关联[9]。赵星星等[10]报道,对60组60眼白内障患者进行前瞻性对照研究,术后1、7天2.2 mm组手术源性散光低于3.0 mm组,而术后90 d 2组间无明显差异。本资料显示术后1周,观察组手术源性散光小于对照组;术后1、3个月,2组的散光水平均趋于稳定,无明显差异,与众多报道一致。相关文献[11]报道,白内障手术切口越小,造成散光则越小,且切口减少0.5 mm,散光则减少0.25 D。当角膜水肿以及角膜内皮细胞损伤程度无显著区别时,角膜散光程度则是影响术后早期视力的重要因素。术后1~3个月随着透明角膜切口逐渐愈合,散光情况趋于平稳。
林英杰等[12]报道,将56例78眼白内障患者进行白内障超声乳化术,术后观察裸眼视力,术后1个月2.2 mm切口组优于3.0 mm切口组。本资料显示2.2 mm观察组术后1天、1周、1个月的裸眼视力均优于3.0 mm对照组,3个月后切口处角膜各层基本恢复,即使3.0 mm切口对照组组裸眼视力也有提升,2组不具有明显差异。因此发现选择不同大小手术切口,视力恢复情况也略有不同,2.2 mm切口术后可更早获得最佳裸眼视力。
综上所述,相比于传统3.0 mm同轴小切口超声乳化手术,2.2 mm同轴小切口超声乳化手术可以显著减轻白内障患者术后角膜水肿程度及手术源性散光,并有利于术后裸眼视力较快恢复,值得推广。
