亚硒酸钠对肺癌细胞生物学行为的影响及其相关机制研究
2021-08-04范理宏
许 晓,李 明,范理宏
硒是地壳中普遍存在的一种非均匀分布的金属,在人体生长发育过程中发挥着十分重要的作用。同时有大量研究显示硒具有抗癌、抗氧化、增强人体免疫力、调节蛋白质合成的功能,在人体的发病机制与稳态中扮演着重要角色,它与威胁人类健康和生命的多种疾病,如癌症、心血管疾病、多囊卵巢综合征等密切相关。与此同时还有研究表明硒可以减轻伊立替康、环磷酰胺等放化疗药物的毒性作用,改善患者预后。亚硒酸钠是最常见的无机硒的存在形式,有研究表明它可以影响肝癌、乳腺癌、膀胱癌等多种癌细胞的增殖、凋亡和迁移。肺癌是对人群健康和生命威胁最大的恶性肿瘤,但关于亚硒酸钠抗肺癌的研究较少且具体机制不明确。该研究通过体外实验,研究亚硒酸钠对肺癌A549细胞系增殖、迁移的抑制作用以及初步验证亚硒酸钠促进凋亡的具体作用机制。
1 材料与方法
1
.1 试剂与仪器
亚硒酸钠(sodium selenite)购自美国Sigma-Aldrich公司;NF-κB抑制剂(BAY11-7082)购自美国MCE公司;RPMI 1640 培养基购自美国Gibco 公司;Annexin V-FITC/PI凋亡试剂盒购自美国Thermo Fisher Scientific公司;NF-κB激活-核转运检测试剂盒和IkBα、p-IkBα、Bax、Bcl-2抗体均购自上海碧云天生物公司;NF-κB、p-NF-κB、β-actin抗体均购自美国Cell Signaling 公司。由上海生物工程技术服务有限公司设计合成Bcl-2、Bax引物;mRNA提取试剂盒、逆转录试剂盒、SYBR Green qPCR Master Mix均购自美国EZBioscience公司;蛋白裂解液(RIPALysis Buffer)、BCA 蛋白定量试剂盒、CCK-8试剂盒均购自上海翊圣生物有限公司。1
.2 细胞培养
肺癌A549细胞购自上海中国科学院细胞培养库,在含有10%胎牛血清和1%青霉素-链霉素的RPMI 1640培养基中培养并置于37 ℃、5% CO的恒温培养箱中培养,2 d更换1 次培养基。1.3 CCK-8细胞增殖实验
将肺癌A549细胞按照4 000~5 000个/孔的浓度铺于96孔板中,待细胞完全贴壁且细胞汇合度达70%~80%后,弃去96孔板内培养基,用含有10%胎牛血清、双抗的RPMI 1640完全培养基稀释亚硒酸钠,初始浓度为5 782.35 μmol/L,依次进18次的倍比稀释,将倍比稀释的亚硒酸钠依次按照浓度梯度,由低到高的顺序分别加入96空板中。培养24 h后,弃去96孔板内培养基,每孔内加入100 μl不含RPMI 1640培养基和10 μl CCK-8,孵育1~2 h后,用酶标仪检测各孔的A值,将所得吸光度按照如下计算公式进行计算:增殖抑制率=(对照组A-实验组A)/(对照组A-空白组A)×100%,实验重复3次。1
.4 流式细胞术
将肺癌A549细胞按照4~5×10个/孔的浓度接种于6孔板中,用亚硒酸钠(14 μmol/L)培养24 h后,待细胞完全贴壁且细胞汇合度达70%~80%后,用PBS清洗细胞2次,10%胰蛋白酶消化2~3 min后,收集细胞,800 r/min离心3 min吸除上清液,加入buffer,轻轻重悬细胞,加入用50 μl buffer稀释的2.5 μl AnnexinV-FITC染料,37 ℃避光染色孵育15~20 min,再加入用250 μl buffer稀释的5 μl碘化丙啶(PI)染料,37 ℃避光染色孵育10 min,最后通过流式细胞仪PI和FITC通道对照组和亚硒酸钠组细胞凋亡率进行检测,实验重复3次。1
.5 划痕实验
取对数生长期的肺癌A549细胞按照4~5×10个/孔的浓度铺于6孔板中,在恒温培养箱中培养24 h,待细胞融合达100%后,用200 μl枪头分别在6孔板内进行划痕,并拍照记录然后用不含胎牛血清RPMI 1640培养基和不含胎牛血清RPMI 1640培养基溶解的亚硒酸钠(14 μmol/L)培养肺癌A549细胞24 h后,拍照记录划痕愈合情况,比较2次结果,实验重复3次。1.6 总RNA的提取和qPCR 用亚硒酸钠和BAY11-7082干预肺癌A549细胞
24 h,收集细胞,按照试剂盒说明书,提取RNA,逆转录cDNA,进行qPCR检测,以GAPDH为内参,引物序列分别为:Bax上游引物GGAGATGAACTGGACAGCAATA,下游引物GAAGTTGCCATCAGCAAAC;Bcl-2上游引物GTGGATGACTGAGTACCTGAAC,下游引物GAG ACAGCCAGGAGAAATCAA。按照说明书设置反应程序,目标基因的表达水平用2比较法进行评估,实验重复3次。1.7 Western blot实验
细胞经过药物处理以后,用PBS清洗3遍,6孔板中每孔加入80 μl含PMSF的裂解液,冰上裂解40~60 min后,用刮棒刮取蛋白收入EP管中,4 ℃、12 000 r/min离心10 min,取上清液。用BCA试剂盒对所提取的蛋白进行定量,定量结束以后加入Loading buffer 100 ℃ 加热10 min(样品放入-20 ℃储存)。取20 μg进行上样,以80 V恒定电压SDS-PAGE电泳80~90 min,以250 mA恒定电流转膜80 min,2% BSA封闭1 h,加入对应的一抗:NF-κB、p-NF-κB、β-actin、Bcl-2、Bax,4 ℃过夜,PBST清洗3次,每次约15 min,加入相应的二抗常温孵育1 h,PBST清洗3次,每次约15 min。使用ECL印迹检测试剂显影拍照,实验重复3次。1
.8 免疫荧光
将肺癌A549细胞分为对照组、14 μmol/L亚硒酸钠组、10 μmol/L BAY11-7082组以及14 μmol/L亚硒酸钠+10 μmol/L BAY11-7082组细胞,经过药物处理24 h后,吸除培养液,用PBS洗3次,按照试剂盒说明书进行固定,染色封闭液,4 ℃孵育过夜NF-κB抗体,室温孵育抗兔Cy3 1 h,细胞核染色液(DAPI),室温下染色5 min,封片,置于荧光显微镜下观察。
2 结果
2.1 亚硒酸钠抑制肺癌A549细胞的增殖
将浓度5 782.35 μmol/L的亚硒酸钠作为起始浓度,进行倍比稀释,一共稀释19个浓度梯度,干预24 h以后,CCK-8结果显示随着药物浓度的不断增加,其抑制效率也会随之不断增加,同时通过计算得出肺癌A549细胞24 h亚硒酸钠的IC值约为14 μmol/L。见表1。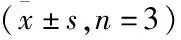
表1 亚硒酸钠的浓度对肺癌A549细胞增殖能力的影响
2.2 亚硒酸钠抑制肺癌A549细胞迁移能力
将经划痕、拍照处理后的肺癌A549细胞分为对照组和14 μmol/L亚硒酸钠组,处理24 h后,结果显示,与对照组相比用14 μmol/L的亚硒酸钠处理后的肺癌A549细胞的迁移的能力明显受到抑制。见图1。
图1 亚硒酸钠对与肺癌A549细胞迁移能力的影响 ×200
2.3 亚硒酸钠促进肺癌A549细胞的凋亡
将A549细胞分为2组,一组不做任何处理(对照组),另外一组用14 μmol/L亚硒酸钠干预24 h以后,流式细胞仪凋亡分析结果显示,与对照组相比用14 μmol/L的亚硒酸钠处理后的肺癌A549细胞的凋亡明显增加,对照组细胞凋亡率为(7.08±5.32)%,14 μmol/L亚硒酸钠组细胞凋亡率为(26.16±1.41)%(图2)(P
<0.05,t
=6.004);与此同时,用6、14、28 μmol/L不同浓度亚硒酸钠处理肺癌A549细胞24 h后,Western blot结果显示,6、14、28 μmol/L 亚硒酸钠组Bcl-2蛋白的表达水平与对照组相比均下降且随亚硒酸钠浓度增加而逐渐下调,而Bax蛋白的表达水平与对照组相比均上调且随亚硒酸钠浓度增加而逐渐上调;qPCR结果也显示,肺癌A549细胞的Bcl-2 mRNA表达水平随亚硒酸钠浓度增加而逐渐下调(P
<0.05,t
=6.675、17.530、45.870),而Bax mRNA表达水平随亚硒酸钠浓度增加而逐渐上调(图3)(P
<0.05,t
=16.56、16.94、157.70)。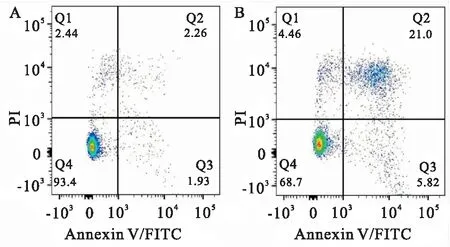
图2 亚硒酸钠干预后细胞的凋亡情况
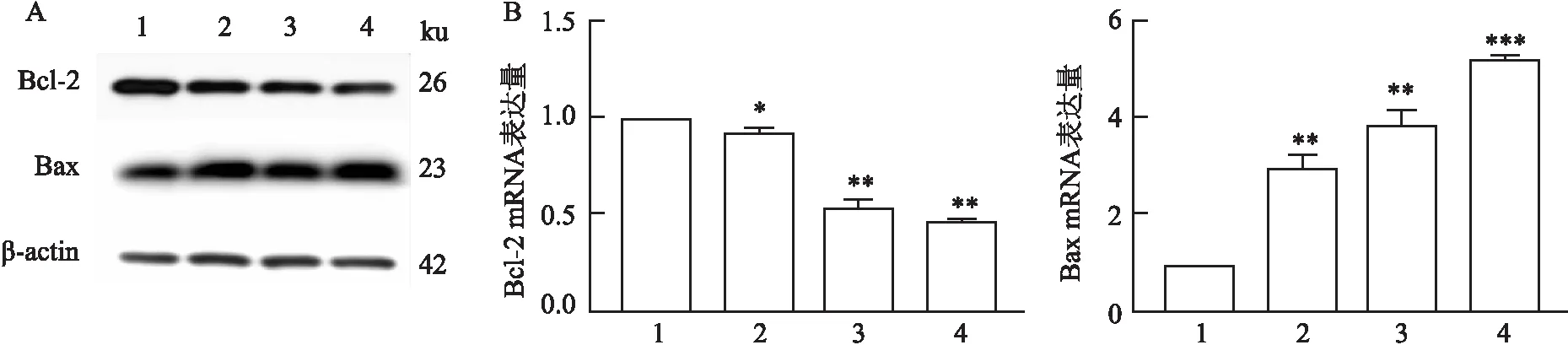
图3 Western blot和qPCR 检测凋亡相关因子Bcl-2和Bax的蛋白及mRNA的表达水平
2.4 亚硒酸钠抑制肺癌A549细胞NF-κB的信号通路活化
亚硒酸钠对NF-κB信号通路的影响如图4所示,经过亚硒酸钠处理的A549细胞,其p-NF-κB、p-IkBα蛋白的表达明显下降,蛋白的表达量与亚硒酸钠浓度呈负相关。免疫荧光结果显示,对照组核内荧光明显强于14 μmol/L亚硒酸钠组、10 μmol/L BAY11-7082(NF-κB抑制剂)组以及14 μmol/L亚硒酸钠+10 mol/L BAY11-7082组,与10 μmol/L BAY11-7082组相比,14 μmol/L亚硒酸钠组的核内荧光强度与之相近,且二者联合使用荧光强度最弱(图5),这说明亚硒酸钠可能抑制肺癌A549细胞NF-κB的信号通路活化。与此同时,qPCR结果显示与对照组相比,14 μmol/L亚硒酸钠组、10 μmol/L BAY11-7082组以及14 μmol/L亚硒酸钠+10 μmol/L BAY11-7082组的Bax mRNA的表达量均增加(P
<0.05,t
=83.77、10.99、48.64),而Bcl-2 mRNA的表达量均下降(P
<0.05,t
=625.5、185.7、275.5)(图6),上述结果提示亚硒酸钠可通过抑制NF-κB信号通路活化促进肺癌A549细胞的凋亡。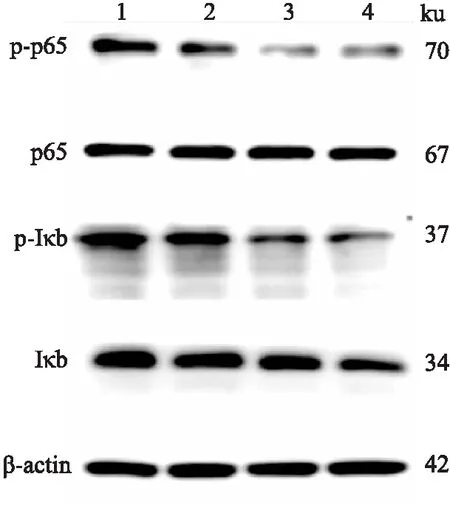
图4 Western blot 检测p65(NF-κB)、p-p65(pNF-κB)、IkBα、p-IkBα的蛋白表达水平
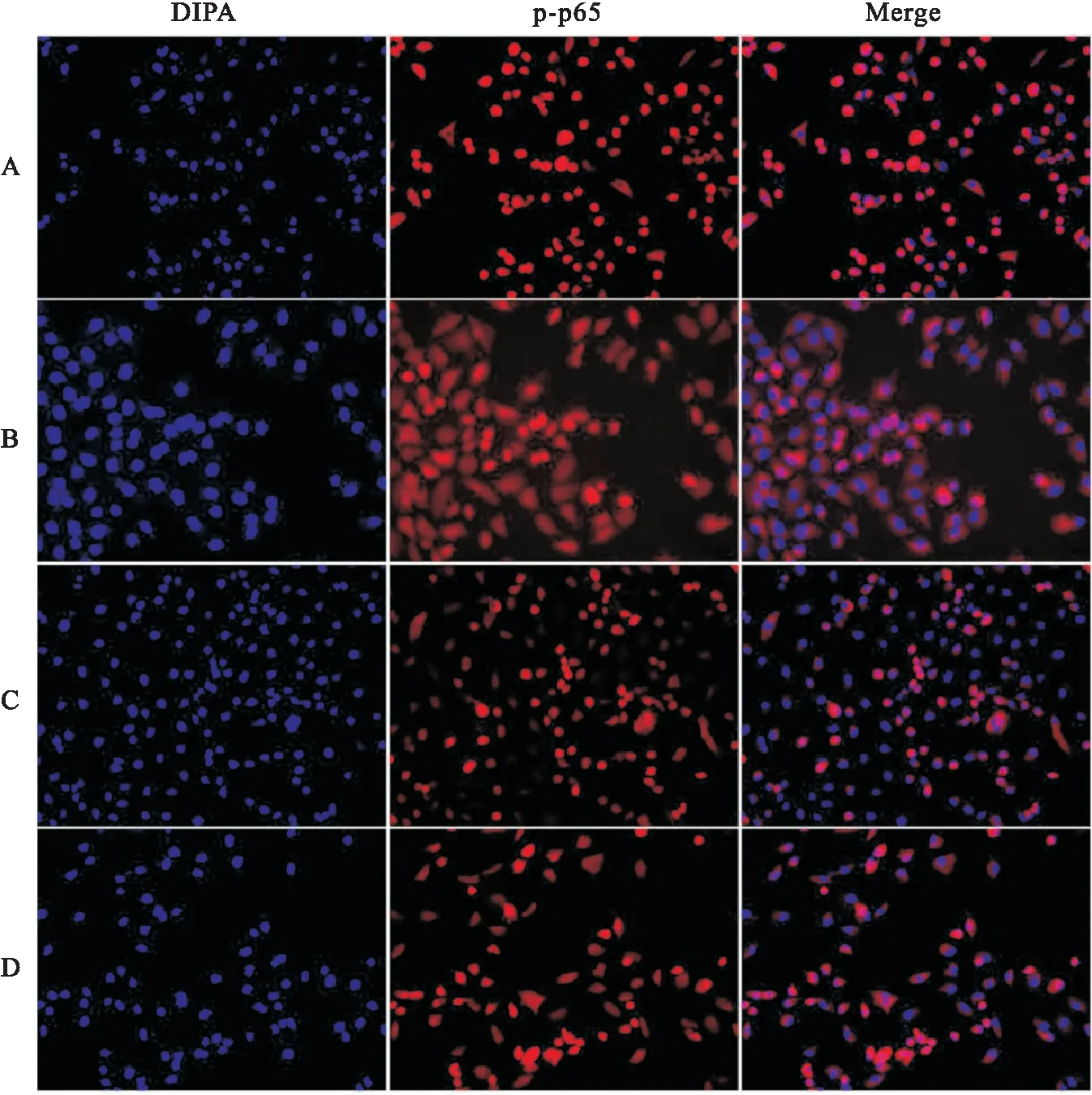
图5 免疫荧光观察p-p65的表达 ×200
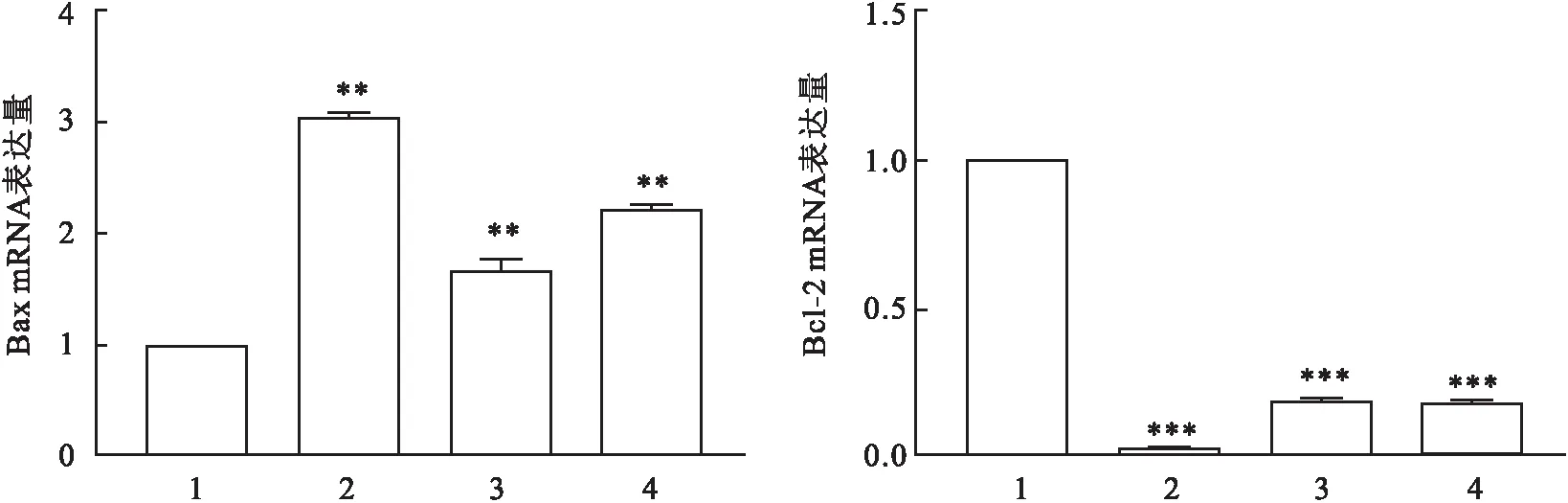
图6 qPCR比较BAY11-7082和亚硒酸钠对肺癌A549细胞凋亡的作用
3 讨论
该研究通过细胞增殖实验、Western blot、qPCR和细胞免疫荧光等实验表明亚硒酸钠可以抑制肺癌A549细胞的增殖和迁移,同时还表明亚硒酸钠促进肺癌A549细胞的凋亡的具体机制与NF-κB信号通路的活化相关。
亚硒酸钠作为无机硒的一种,它具有广泛的抗肿瘤的作用。有研究表明,亚硒酸盐可以通过降低线粒体膜电位(MMP)、增加超氧化物的产生、减少ATP合成、破坏溶酶体膜和激活自噬的方式,实现促进肿瘤细胞凋亡的目的。还有研究表明,在鼻咽癌细胞的研究中,亚硒酸钠可以增加Bax的表达,减少Bcl-2的表达,降低了MMP的表达,诱导Bax从细胞质转位到线粒体,增加Caspase-3活性,进而达到抗增殖和诱导凋亡作用,且亚硒酸钠抑制肿瘤细胞增殖和促进其凋亡的作用具有剂量和时间依赖性。与此同时,CCK-8的结果表明,亚硒酸钠可以抑制肺癌A549细胞的增殖,并且伴随亚硒酸钠浓度的不断上升其抑制作用也逐渐加强;通过划痕实验发现亚硒酸钠抑制肺癌细胞的迁移;通过流式细胞术、Western blot和qPCR实验,结果显示亚硒酸钠具有促进肺癌A549细胞凋亡的作用。综上所述,亚硒酸钠可以抑制肺癌A549细胞增殖和迁移以及诱导肺癌A549细胞的凋亡。
NF-κB是一类由p50、p52、NF-κB、c-Rel和RelB两两组合形成二聚体核转录因子,其中p50和NF-κB所构成的异源二聚体是NF-κB经典信号通路的重要组成部分,它能特异性结合免疫球蛋白κ轻链基因的上游增强子序列并激活基因转录。NF-κB转录因子正常情况下会与IkBα 结合成三聚体并以无活性的形式存在于细胞质中,当细胞受到如炎症因子、脂多糖等因子刺激后会使IkK复合物激活,此时IkBα 会发生磷酸化并迅速降解,使NF-κB核转录因子活化并发生转位,进入细胞核中发挥调控基因表达的作用。NF-κB信号通路作为调节免疫发育、免疫反应、炎症的关键通路,近年来的大量文献显示NF-κB信号通路参与干扰肿瘤发生发展的不同阶段。在关于肺癌A549和乳腺肿瘤细胞与人脑微血管内皮细胞(HBMECs)相互作用研究中表明,特定的硒化合物能够通过下调NF-κB来抑制肿瘤细胞与脑内皮细胞的黏附和跨内皮细胞的迁移,从而使肿瘤细胞的转移能力受到抑制。在关于乳腺癌的研究中表明亚硒酸钠可以通过瞬态增加细胞内活性氧(ROS),抑制NF-κB信号通路的活化,Bax表达上升,Bcl-2 的表达下降,激活Caspase 9和Caspase 3,促进乳腺癌细胞的凋亡。与此同时,有文献报道肺癌细胞的生成和增殖与NF-κB信号通路活化密切相关,在具有高NF-κB活性的小鼠肺腺癌细胞系中,硼替佐米与Bay-117082(NF-κB抑制剂)通过抑制NF-κB的磷酸化和入核,诱导癌细胞凋亡。因此,抑制NF-κB信号通路的活化被认为可能是治疗肺癌A549的有利途径。该研究表明,亚硒酸钠可使肺癌A549细胞中p-NF-κB和p-IkBα 的表达下降,同时伴着亚硒酸钠浓度的不断增加,p-NF-κB和p-IkBα 表达逐渐降低;免疫荧光结果提示亚硒酸钠可以抑制NF-κB的入核。从上述结果分析亚硒酸钠可以抑制肺癌A549细胞NF-κB的磷酸化,进而影响NF-κB的入核,干扰相关基因表达。
