沉默APE-1对肝癌细胞Hep 3B转录组表达谱及TNF信号通路的影响
2021-08-04孙志鹏许光中阿民布和彭吉润张能维
孙志鹏,许光中,阿民布和,樊 庆,彭吉润,张能维
在全球范围内,肝细胞癌(hepatocellular carcinoma, HCC)的发病率、病死率一直居高不下。中国肿瘤登记中心最新公布的癌症统计数据显示:2015年新发恶性肿瘤约429万例,死亡人数约281万;其中肝癌新发病例约46.61万,死亡人数约42.21万例。HCC的发生、进展和转移是多种遗传,表观遗传和信号通路的失调,与肿瘤微环境相互作用的综合作用结果。脱嘌呤脱嘧啶核酸内切酶-1(apurinic-apyrimidinic endonuclease 1,APE-1)是一种可以发挥DNA修复功能和氧化还原功能的蛋白,可调节肿瘤相关途径的多种转录因子。前期研究表明,APE-1在肝癌组织和细胞中高表达,且其高表达与TNM分期、组织病理分级存在差异。沉默APE-1表达可降低肝癌细胞Hep 3B的增殖活性,提高细胞凋亡率。该研究旨在研究沉默APE-1对肝癌细胞Hep 3B转录组表达谱及TNF信号通路的影响。
1 材料与方法
1
.1 材料
1
.1
.1
组织样本及实验细胞 选取2017—2018年在首都医科大学附属北京世纪坛医院(北京大学第九临床医学院),胃肠肝胆肿瘤外科行肝细胞肝癌手术患者,共计10例,取肝癌组织(非坏死区肿瘤组织)及癌旁组织(距肿瘤边缘2 cm肝硬化组织约0.5 cm×0.5 cm×0.5 cm)。所有新鲜组织获取后立即转入液氮保存。沉默APE-1表达的肝癌Hep 3B稳定细胞株及其对照由实验室构建后保存。1
.1
.2
主要试剂 总RNA抽提试剂TRIzol、反转录RT-PCR Kit试剂盒、mRNA SYBR Green荧光定量PCR试剂购自美国Thermo Scientific公司;SP-0023-SP免疫组化检测试剂盒购自北京索莱宝公司;TNFAIP3(ab92324,免疫组化稀释比例1∶100)和MAP2K6(ab200831,免疫组化稀释比例1∶100)抗体购自英国Abcam公司。1
.2 方法
1
.2
.1
转录组高通量测序 针对实验组APE-1沉默表达的Hep 3B细胞,对照组转染空白质粒的Hep 3B细胞,提取总RNA,检测合格后反转录,构建cDNA文库。基于Illumina Hiseq 2500进行上机测序,获取转录组测序数据后,进行生物信息学分析。转录组高通量测序及分析由华大基因科技有限公司代做。1
.2
.2
RT-PCR检测TNFAIP3、MAP2K6基因在细胞中表达变化 收集2组稳转细胞,TRIzol法提取总RNA,按逆转录试剂盒说明将总RNA逆转录为cDNA。以cDNA为模板,按荧光定量PCR试剂盒说明进行PCR扩增。TNFAIP3引物序列为:上游引物5′-CTGCCAGCGAGCGAGC-3′,下游引物5′-TGCTCTCCAACACCTCTCC-3′;MAP2K6引物序列为:上游引物5′-CAAAACTAGCTACAGAAGAGAAGCA-3′,下游引物5′-TTCGCTTCTTGCCTTTCGAC-3′;GAPDH引物序列为:上游引物5′-TGAAGGTCGGAGTCAACGG-3′,下游引物5′-TCCTGGAAGATGGTGATGGG-3′。PCR反应体系共25 μl:SYBR Premix Ex Taq 12.5 μl,上下游引物各1 μl,cDNA模板2 μl,ddHO 8.5 μl;反应条件:95 ℃ 30 s,95 ℃ 5 s,60 ℃ 20 s,共40个循环。以GAPDH为内参,采用2法计算目的基因相对表达量。实验重复3次,取平均值。1
.2
.3
免疫组化检测TNFAIP3、MAP2K6在肝癌/癌旁组织中表达 组织经过切片、水化、抗原修复,分别滴加一抗和二抗,DAB显色,中性树胶封片。光学显微镜拍照,采用IPP软件对图片进行积分光密度(integrated option density,IOD)。1
.2
.4
基因表达相关性分析 基于TCGA数据库中374例肝癌患者数据,通过starbase 软件(http://starbase.sysu.edu.cn/panGeneCoExp.php)分析APE-1和TNFAIP3,APE-1和MAP2K6表达相关性。
2 结果
2.1 沉默APE-1后对肝癌细胞Hep 3B基因表达谱变化的影响
基于差异分析结果,筛选FDR<0.05且|logFC|>1的基因为差异基因,共获得123个差异基因。其中,沉默APE-1后,肝癌细胞Hep 3B中84个基因表达上调,39个基因表达下调见图1A。差异比较火山图、热图见图1B、C。差异变化前10位的基因为APE-1、CEMIP、MAP2K6、TAF11L11、CNGB1、COL5A3、OTULINL、DNAJC12、FOLR1、ACKR3。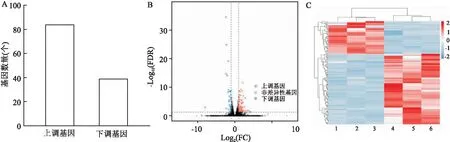
图1 沉默APE-1后导致肝癌细胞Hep 3B基因表达谱变化
2
.2 差异基因的功能富集分析
GO富集分析结果表明,沉默APE-1后差异表达基因主要参与的分子功能包括蛋白质标签、结构分子活性、化学驱除活性、运输活动、翻译调节器活动、催化活性、电子载体活性、蛋白质结合、分子功能调节、分子转换活性、转录因子活性、核酸结合转录因子活性、信号传感器活动等;参与的细胞组分包括突触、细胞连接、细胞外基质成分、膜、细胞外区域部分、细胞器、超分子纤维、大分子复合物、膜封闭腔等,参与的生物过程包括发育过程、信号传导、生物调节、分子定位、细胞成分的组织或生物发生、突触传递中涉及的突触前过程、生物黏附、对刺激的反应、代谢过程、生殖过程、生物过程的负调控、运动、免疫系统过程、微生物过程等。见图2。KEGG富集分析结果表明,沉默APE-1后差异表达基因主要参与的信号通路包括TNF信号通路、肌萎缩性侧索硬化症(amyotrophic lateral sclerosis, LS)、突触小泡循环、近端小管碳酸氢盐回收、甘氨酸、丝氨酸和苏氨酸的代谢、新霉素、卡那霉素和庆大霉素的生物合成、碳水化合物的消化吸收、癌症中的转录失调、内分泌和其他因子调节的钙重吸收、精氨酸和脯氨酸代谢、N-聚糖生物合成等,见图3A。疾病本体(disease ontology, DO)富集分析结果表明,沉默APE-1后差异表达基因主要参与的疾病包括乳腺良性肿瘤、胸良性肿瘤、乳腺囊肿、婴儿猝死综合症、卵巢透明细胞腺癌、卵巢腺癌、胃腺癌、肌萎缩性侧索硬化非典型抑郁症等,见图3B。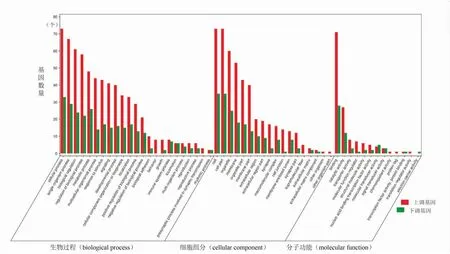
图2 差异基因的GO功能富集分析
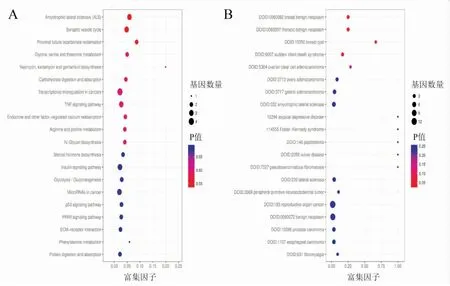
图3 差异基因的KEGG、DO功能富集分析
2
.3 互作网络分析
差异基因蛋白互作网络的分析结果表明,APE-1和EGR1、MYH14、PRKAR2B、BSN、AC118754.1、UBC、LGSN、IGFBP3、HMGA2等基因组成核心蛋白互作网络,见图4。
图4 差异基因互作网络分析
2.4 TNF信号通路表达差异
在实验组和对照组细胞中检测基因表达,结果表明TNFAIP3、MAP2K6在沉默APE-1的肝癌细胞Hep 3B中低表达(P
<0.05),见图5A。组织中免疫组化结果表明TNFAIP3、MAP2K6在肝癌组织中高表达(P
<0.05,t
=3.407,t
=3.388),见图5B。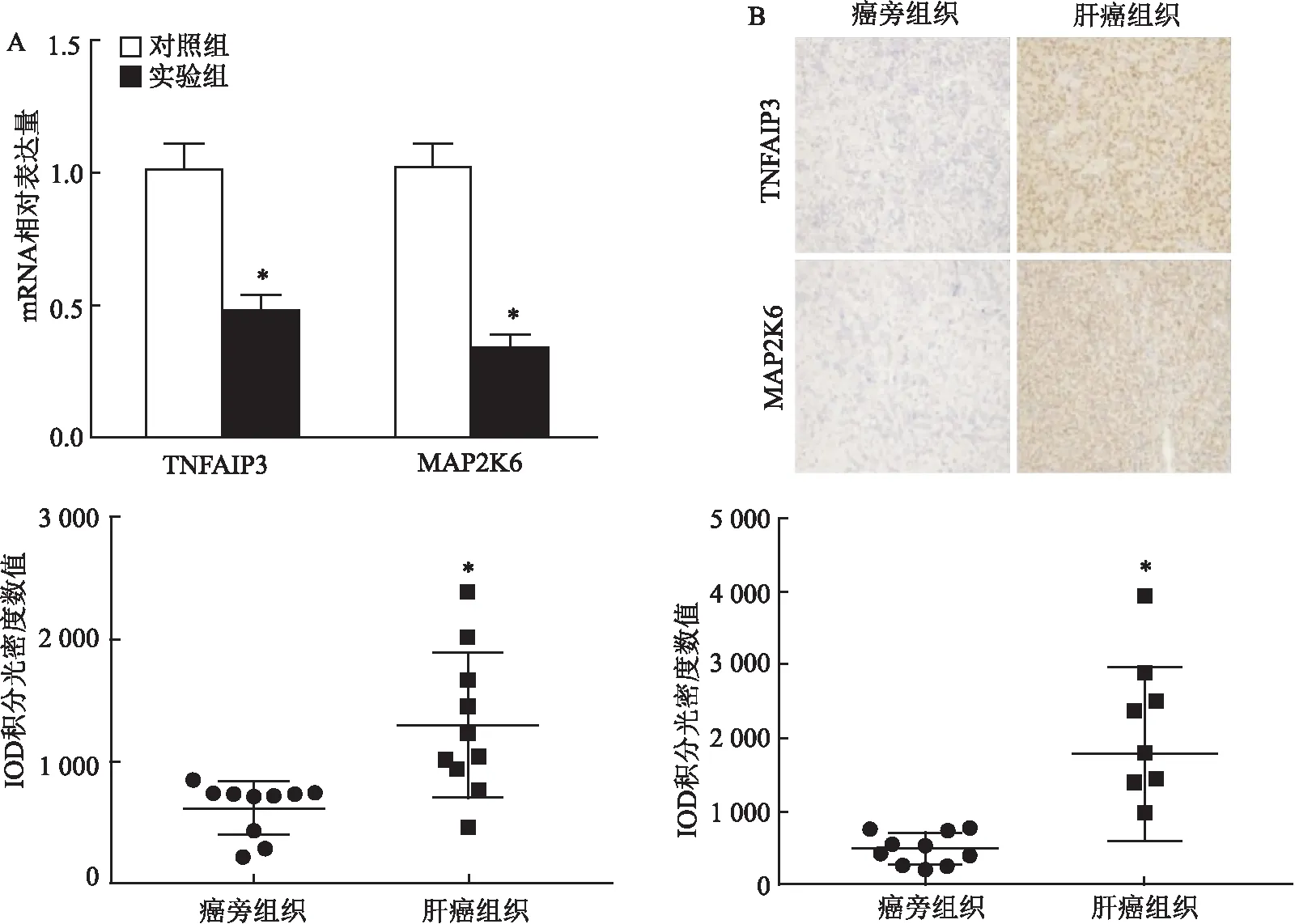
图5 TNF信号通路基因TNFAIP3、MAP2K6在不同情况下的表达差异
2.5 APE-1和TNFAIP3、APE-1和MAP2K6表达
相关性分析
基于TCGA数据库可视化软件starBase中374例肝癌患者数据,分析表达相关性。结果表明,APE-1和TNFAIP3,APE-1和MAP2K6表达均呈正相关(P
<0.001),见图6。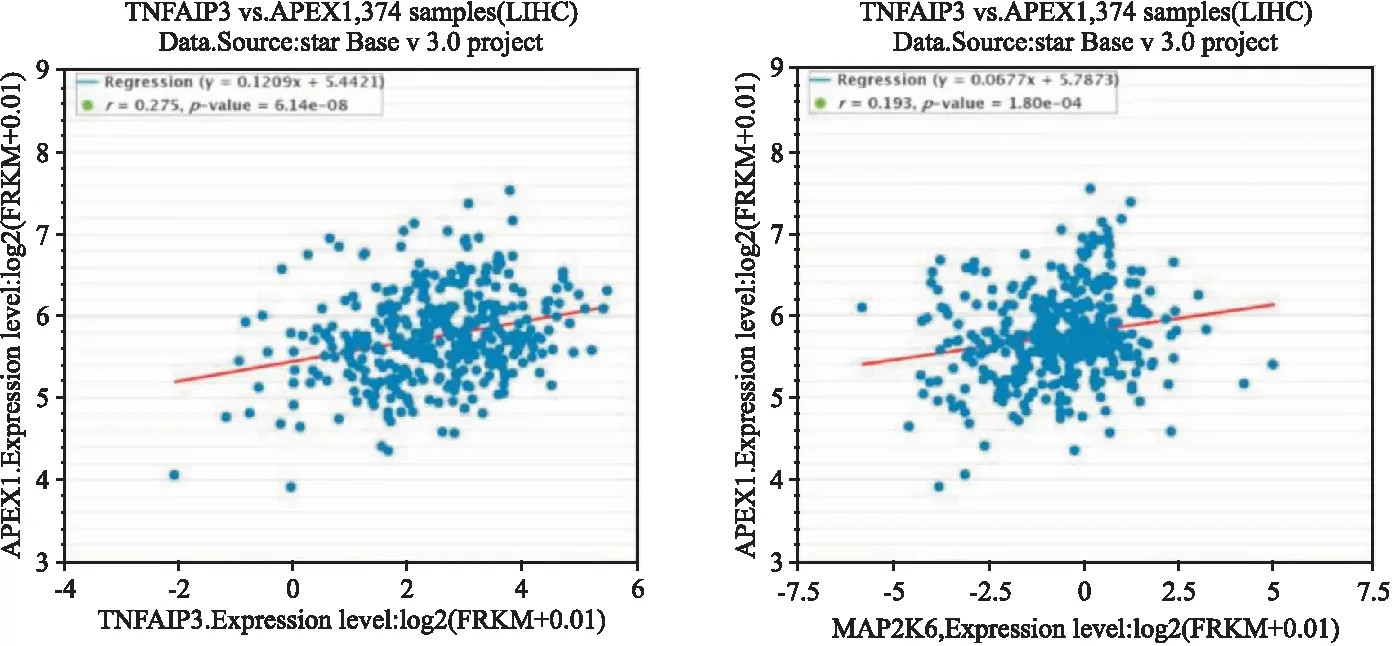
图6 APE-1和TNFAIP3、APE-1和MAP2K6肝癌中表达相关性分析
3 讨论
HCC发病率、病死率居高不下,缺乏特异性肿瘤分子标记物及治疗靶点是重要原因之一;发现HCC相关致病基因,并在研究其作用机制基础上寻找治疗新靶点是肿瘤生物学的重要内容。近年来,氧化还原因子APE-1在肿瘤发展中的作用越来越受到人们的重视。多项研究表明APE-1在前列腺癌、透明细胞肾细胞癌、横纹肌肉瘤、乳腺癌、非小细胞肺癌、卵巢浆液性癌、胃癌、食管鳞状细胞癌、膀胱癌中存在差异表达。Kim et al检测血清APE-1的表达寻找透明细胞肾细胞癌(clear cell renal cell carcinomas, ccRCC),HCC以及近端和远端胆管癌(cholangio carcinoma, CC)的生物标志物,发现胞质APE-1表达增加导致HCC和CC病例的无病生存期缩短,暗示APE-1表达水平可能是ccRCC、HCC和CC的潜在诊断生物标志物,也可用于预测HCC或CC患者的复发。McIlwain et al在前列腺癌(prostate cancer, PC)中研究表明,PC标本中的survivin和APE-1高表达,并且小分子抑制剂APX3330和第二代抑制剂APX2009对APE-1氧化还原特异性抑制作用可以降低PC细胞增殖并诱导细胞周期停滞,抑制APE-1可降低NF-κB转录活性。
在肝癌中,该课题组前期研究结果显示APE-1在肝癌组织和细胞中表达升高,其表达与TNM分期、组织病理分级存在差异。沉默APE-1表达可降低肝癌细胞Hep 3B细胞增殖活性,提高细胞凋亡率。APE-1在肝癌细胞中表现出了较强的抗肿瘤潜能。
通过高通量测序技术检测沉默APE-1表达对肝癌细胞Hep 3B转录组的影响。结果表明沉默APE-1表达导致肝癌细胞Hep 3B中123个基因表达发生变化,差异最明显的前10位基因分别为APE-1、CEMIP、MAP2K6、TAF11L11、CNGB1、COL5A3、OTULINL、DNAJC12、FOLR1、ACKR3。差异基因功能富集结果表明其主要参与TNF信号传导、肿瘤转录失调通路。
肿瘤坏死因子(tumor necrosis factor, TNF)是一种可以直接杀伤肿瘤细胞,对正常细胞没有明显的细胞毒性的细胞因子,是细胞凋亡以及炎症和免疫的主要介质,它与多种人类疾病的发病机制有关,包括癌症、败血症、糖尿病、骨质疏松症、多发性硬化症、类风湿关节炎和炎症性肠病。
TNF与TNF-R1的相互作用激活多种信号转导途径,包括NF-kB和MAPK途径。针对TNF信号转导通路中的关键性差异表达蛋白TNFAIP3、MAP2K6,通过免疫组化方法验证在临床肝癌组织样本中均高表达。进而基于癌症和肿瘤基因图谱计划(the cancer genome atlas,TCGA)肿瘤标本数据库中374例肝癌患者数据,分析APE-1和TNFAIP3,APE-1和MAP2K6表达相关性,结果表明APE-1和TNFAIP3,APE-1和MAP2K6表达均呈正相关(P
<0.001),暗示APE-1可能通过影响TNF信号转导发挥作用。此外,转录组分析结果还表明差异基因参与N-聚糖生物合成、碳水化合物的消化吸收、近端小管碳酸氢盐回收、甘氨酸、丝氨酸和苏氨酸的代谢等。研究表明糖代谢与免疫治疗逃逸相关,而APE-1在肝脏中也发挥着免疫逃逸的功能。笔者通过建立大鼠原位肝移植模型,发现APE-1蛋白的过表达可以增强移植物免疫逃逸。这些结果提示APE-1沉默可能抑制肿瘤细胞的免疫逃逸,促进肿瘤细胞免疫应答反应。提示免疫治疗可能是治疗肝癌的有效手段。然而肿瘤免疫应答过程比较复杂,肝癌中APE-1差异表达对免疫治疗的影响还需要更详细的机制研究。
综上所述,该研究通过沉默APE-1对肝癌细胞Hep 3B转录组表达谱的分析,提示APE-1是肝癌发生发展中关键的抗肿瘤基因,其可能通过影响TNF信号通路发挥作用。
