miR-513a-3p在结肠癌中高表达并诱导细胞生长和迁移的机制研究
2021-08-04缪作华刘素云
缪作华,刘素云,李 丹
结肠癌(colorectal cancer,CRC)是全球第三大常见癌症,也是常见的癌症相关死因之一。既往研究表明,肿瘤抑制基因的失活和致癌基因的激活均有可能导致CRC发病,这些功能基因被很多分子调控,比如多种MicroRNAs(miRNAs)在CRC发病中发挥着重要的作用。miRNAs是一种长度在19~24个核苷酸之间小型的非编码RNA,通过与靶蛋白mRNA3′端非编码区(3′-UTR)结合,导致靶蛋白翻译抑制,靶蛋白可影响细胞的生物学作用,因而miRNAs在细胞生长、增殖、凋亡和分化等多种生物学过程中发挥着重要作用。miR-513a-3p作为miRNAs中一员,被证实介导了多种肿瘤增殖。关于CRC与miR-513a-3p相关报道较为少见,其作用机制也尚未明确。因此,该研究通过观察CRC患者癌组织与肺癌组织miR-513a-3p的差异,证实CRC发病与miR-513a-3p异常表达的关系,再用人CRC细胞株HT-29和SW480细胞进行体外实验,初步探究miR-513a-3p对CRC细胞生长和迁移的诱导机制。
1 材料与方法
1
.1 病例资料
收集2018年10月—2019年4月在该院确诊为CRC患者的CRC组织及癌旁正常组织30例作为研究对象,男女比例为17∶13,年龄为(58.32±12.47)岁。入选条件:术前未接受放射性治疗、化疗或者药物治疗。手术切除CRC变组织和临近非癌变组织,各选取1~2 cm漂洗干净后放置于4%多聚甲醛中固定,其余部分液氮中速冻留用。实验中所涉及的患者均经本人或家属同意,并签署知情同意书,且经医院伦理委员会审核后实行研究。1
.2 试剂与仪器
人CRC细胞株HT-29(HTB-38)和SW480(cl-228)购自美国菌种保藏中心ATCC;miR-454-3p探针由上海吉玛制药技术有限公司构建;10%胎牛血清购自上海前尘生物科技有限公司;胃蛋白酶购自深圳市文乐生物科技有限公司;NTE缓冲液购自北京沃凯生物科技有限公司;SCS缓冲购自液深圳市文乐生物科技有限公司;地高辛抗体购自北京拜尔迪生物技术有限公司;DAB显色剂购自北京绿源大德生物科技有限公司;TRIzol试剂盒购自北京中成谨念科技有限公司;反转录试剂盒购自武汉科尔普生物科技有限公司;SYBR Green PCR 混合试剂盒购自成都柏诺科技有限公司。1
.3 实验方法
1
.3
.1
细胞培养 培养在含10%胎牛血清(FBS, Gibco,10099141)和1%双抗(Gibico,1566407)的DMEM(Hyclone, 8118174)高糖完全培养基中,放置于37 ℃,5% CO培养箱内培养,每2~3 d传代并更换培养液。1
.3
.2
miR-513a-3p表达的检测 ① 原位杂交检测miR-513a-3p在组织中的表达水平。将组织从4%多聚甲醛中拿出,进行常规脱水、浸蜡和石蜡包埋后,6 μm切片,二甲苯脱蜡处理,然后用高浓度到低浓度的乙醇水化,放入30%过氧化氢和蒸馏水1∶10 混合液中(25 ℃,5~10 min)灭活内源性酶,滴加3%枸橼酸新鲜稀释的胃蛋白酶,37 ℃消化15 min,1%多聚甲醛/0.1 mol/L的PBS,含有1/1 000 DEPC,室温后固定10 min,洗净后42 ℃预杂交2~4 h,随后滴加30 μl 探针杂交液。42 ℃ 湿盒孵育过夜,SSC振荡漂洗、NTE缓冲液漂洗。37 ℃封闭30 min,滴加地高辛抗体37 ℃封闭60~120 min,随后SABC、生物素化过氧化物酶分别处理,DAB显色,显色后冲洗,乙醇脱水,透明后封片。② miR-513a-3p相对表达水平的检测。取冻存的组织(或者细胞)标本,严格按照TRIzol试剂盒的说明书提取组织中总RNA,再根据反转录试剂盒说明书将RNA反转录为cDNA,最后把其作为模板通过qRT-PCR检测miR-513a-3p的表达水平,上海生工生物工程(上海)股份有限公司协助完成引物设计和合成,严格按照SYBR Green PCR 混合试剂盒操作要求进行定量操作。miR-513a-3p正向和反向引物分别是5′-TAAATTTCACCTTTCTGAGAAGG-3′和5′-GCGAGCACAGAATTAATACGAC-3′;U6作为内参,它的正向和反向引物分别为5′-CTCGCTTCGGCAGCAA-3′和5′-AACGCTTCACGATTTGCGT-3′。使用2法进行定量计算,实验重复3次。1
.3
.3
人CRC细胞株HT-29和SW480细胞转染miR-513a-3p 将细胞株分别接种于96孔板中,37 ℃,5% CO培养箱内培养24 h,细胞密度达到50%~70%时参照Lipofectamine 2000 试剂(Invitrogen)说明书将miR-513a-3p 模拟物(miR-513a-3p mimics)(促进表达组)及阴性对照(miR-513a-3p NC)(阴性对照组)转染于细胞株。1
.3
.4
MTT法检测转染miR-513a-3p后细胞的活力 将转染后的细胞接种于96孔板中,培养箱中分别培养1、2、3、4 d后,倒去旧的培养基,各孔加入基础培养基稀释好的MTT,使得最终每孔MTT终浓度为0.5 mg/ml,100 μl每孔,相同条件下继续培养4 h。最后倒去旧培养基,每孔加入150 μl的DMSO。置于酶标仪中中速振荡10 min,以加速结晶溶解,在490 nm处测定吸光度值。1
.3
.5
细胞克隆实验观察转染miR-513a-3p后细胞的增殖能力 将转染后的细胞消化充分并吹打至单个细胞,然后接种到铺好琼脂糖及细胞培养液的6孔板中(细胞200个/孔),培养箱中培养7 d后,4%多聚甲醛固定细胞15 min,PBS洗2~3遍后0.1%结晶紫溶液染色15 min,镜下观察细胞集落(细胞数量>20个)的数目。1
.3
.6
细胞划痕实验观察转染miR-513a-3p后细胞的迁移能力 种板前用标记笔在6孔板外侧底部,用直尺均匀地画4条直线;细胞5×10个/孔接种于6孔板,贴壁长满后,倒掉培养液,用200 μl移液枪头在底部中央作一直线划痕,PBS洗3次去除细胞表面残骸和碎片,分别在培养0、12、24 h后观察细胞迁移情况,并拍照记录。每孔沿划痕从上到下观察6个视野,每组3个复孔共18个视野。1
.3
.7
Transwell实验检测转染miR-513a-3p细胞的侵袭能力 细胞饥饿24 h后充分消化,接种到transwell小室(稀释的Matrigel基质胶包被)基底膜的上室表面,接种密度1×10个/室,下层小室内为10%含血清完全培养基,37 ℃培养24 h后, 4%多聚甲醛固定后0.1%结晶紫染色细胞,显微镜下选5个视野计数穿出细胞数目。1
.3
.8
NF-κB和Wnt/β-catenin通路相关蛋白表达的检测 提取HT-29和SW480细胞中的蛋白,随后用BCA蛋白检测试剂盒检测蛋白浓度,样品定量后上样,十二烷基硫酸钠-聚丙烯酰胺凝胶电泳分离(SDS-PAGE)凝胶,然后按照“三明治”标准进行转膜,300 mA恒流60 min,封闭后分别于4 ℃孵育p-p65(ab16502)、p65(ab86299)、p-IκBα(ab92700)、IκBα(ab32518)、Wnt3a(ab28472)、Wnt5a(ab72583)、β-catenin(ab32572)和β-actin(ab8226)一抗4 ℃孵育过夜,二抗(CST,#7076)室温孵育1 h,最后使用化学发光仪曝光,所得条带的蛋白灰度值采用Image-J进行分析,按目的蛋白/内参相对灰度值作为分析结果。
2 结果
2.1 组织中miR-513a-3p的表达
原位杂交检测结果显示(图1A),CRC组织miR-513a-3p阳性表达(棕色区域)较癌旁组织增加。qRT-PCR检测结果显示(图1B),CRC组织miR-513a-3p相对表达量较癌旁组织升高(t
=12.357,P
<0.01)。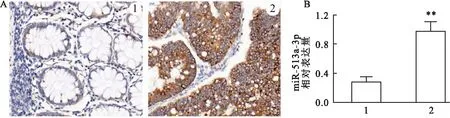
图1 CRC组织中miR-513a-3p的表达
2.2 miR-513a-3p过表达促进细胞增殖能力
促进表达组的HT-29和SW480细胞miR-513a-3p相对表达量均高于阴性对照组(t
=16.371、13.579;均P
<0.01),提示miR-513a-3p在HT-29和SW480细胞中转染成功(图2A)。阴性对照组和促进表达组的HT-29细胞活力在1、2、3、4 d时间中逐渐升高(F
=8.761、21.459;均P
<0.01;图2B),阴性对照组和促进表达组的SW480细胞活力在1、2、3、4 d时间中亦逐渐升高(F
=8.136、18.673;均P
<0.01;图2C)。与阴性对照组比较,促进表达组细胞活力在3、4 d两个时间段中均升高(t
=9.962、12.918;均P
<0.01)。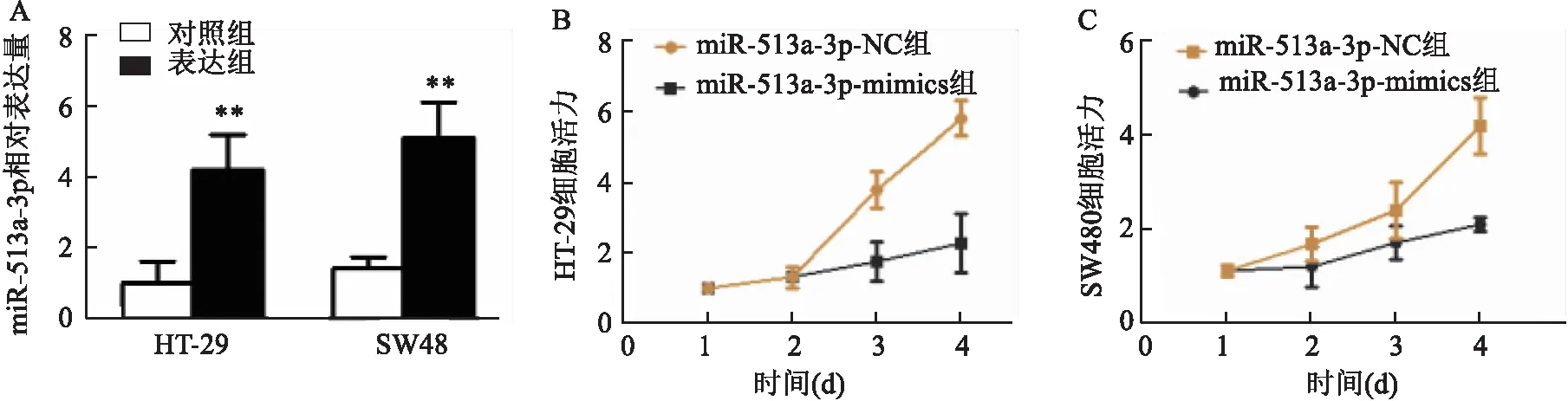
图2 miR-513a-3p过表达促进细胞增殖能力
2.3 miR-513a-3p过表达对细胞迁移能力的影响
与阴性对照组比较,促进表达组的HT-29和SW480细胞侵袭细胞比例增加(t
=43.675、36.782;均P
<0.01;图3A、B)。促进表达组HT-29和SW480的细胞迁移能力增强,划痕面积愈合快(图3C)。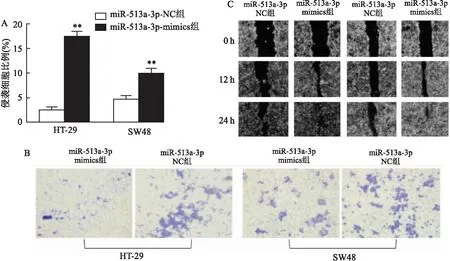
图3 miR-513a-3p过表达对细胞迁移能力的影响
2.4 miR-513a-3p过表达对NF-κB和Wnt/β-catenin通路的影响
Western blot结果如图4所示,与阴性对照组比较,促进表达组的HT-29细胞p-p65和p-IκBα、Wnt3a、Wnt5a和β-catenin蛋白相对表达量均升高(t
=14.719、14.878、8.957、9.137、9.132;均P
<0.01),促进表达组的SW480细胞p-p65和p-IκBα、Wnt3a、Wnt5a和β-catenin蛋白相对表达量均升高(t
=15.134、15.579、5.362、6.964、10.950;均P
<0.05),提示miR-513a-3p过表达两种细胞的p65/p-IκBα通路、Wnt/β-catenin通路均被激活。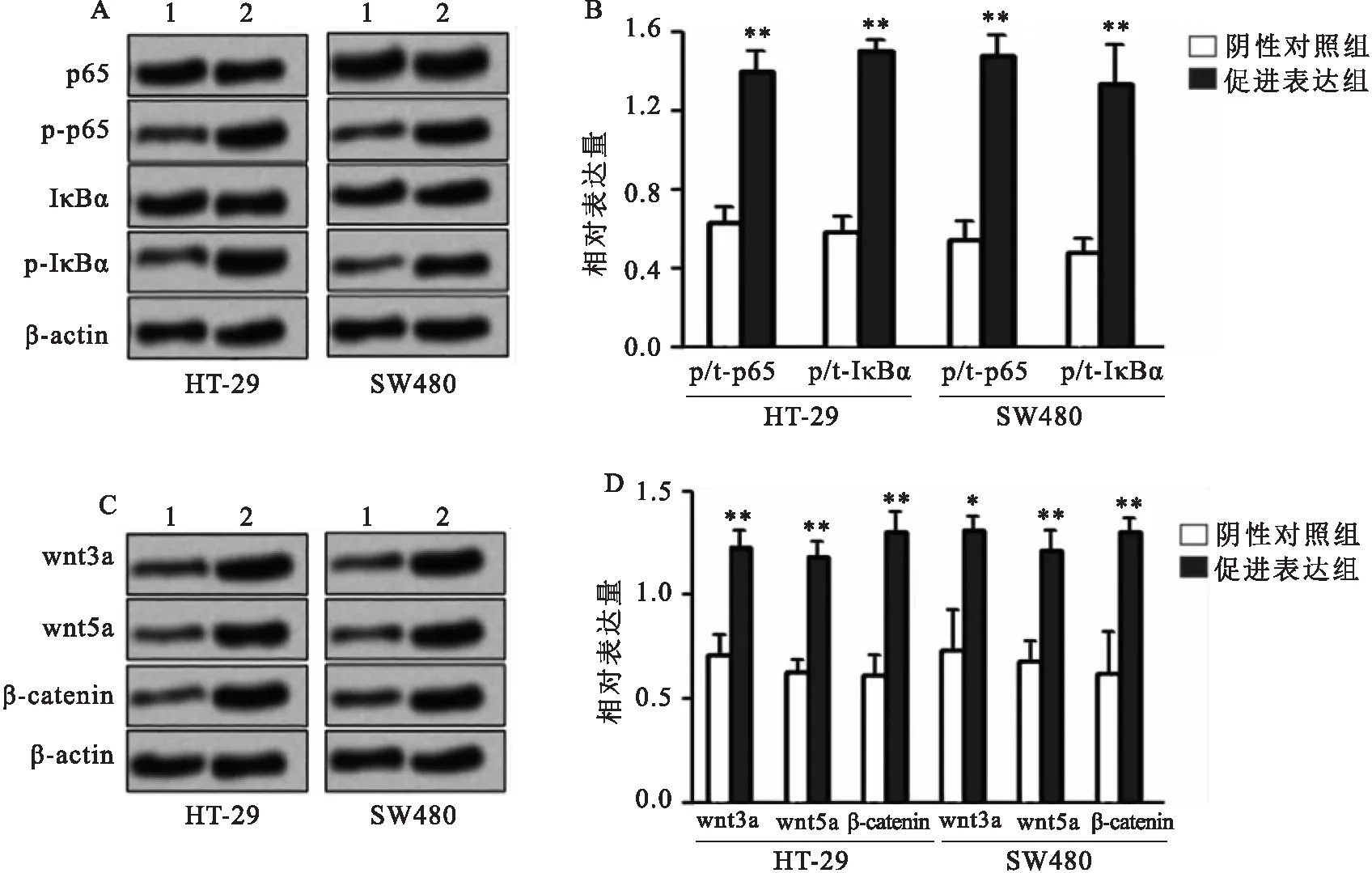
图4 miR-513a-3p过表达对NF-κB和Wnt/β-catenin通路的影响
3 讨论
全球每年有100多万CRC新确诊病例,CRC不仅加重社会和家庭经济负担,且严重威胁到患者的生命健康。CRC早期临床症状并不明显,部分CRC患者确诊时已发展到中晚期,这给予临床治疗带来巨大的挑战。另一方面,随着医疗技术不断进步,以手术、化疗和放射治疗等治疗手段为主治疗CRC,虽然有效改善CRC患者的生存和预后情况,但患者病死率依旧居高不下,每年仍有约60.8万人死亡。因此,开展CRC相关研究探讨其分子引起的发病机制,以期为CRC寻求治疗药物或治疗靶点具有重要的意义。该研究旨在观察miR-513a-3p在CRC组织及癌旁正常组织表达差异,初步探究miR-513a-3p与CRC发病机制的关系。
既往研究表明miRNAs参与介入几乎所有类型的癌症和恶性肿瘤,而CRC患者中或CRC组织中也有多种miRNAs异常表达。多项研究中表明miR-513a-3p充当“癌基因”的角色,其高表达能促进癌症发生发展,与上述结果相似,该研究应用原位杂交和qRT-PCR检测CRC组织和癌旁正常组织的miR-513a-3p表达情况,结果显示CRC组织miR-513a-3p均高于癌旁组织,提示miR-513a-3p过表达可能增加CRC发生风险。癌症易扩散、易复发归因于癌细胞增殖快、迁移侵袭能力强等恶性特征,基于以上结果可以推测,miR-513a-3p过表达可能通过影响癌细胞增殖、迁移、侵袭等恶性特征参与CRC发病机制,为了验证以上推论,该研究利用两种不同来源的癌细胞株转染miR-513a-3p类似物,以达到miR-513a-3p过表达的目的,结果显示,促进表达组miR-513a-3p相对表达量明显高于阴性对照组,表明实验转染成功。进一步检查细胞活力、迁移能力和侵袭能力显示,促进表达组细胞活力增高,迁移和侵袭能力明显增强,结果提示过表达的miR-513a-3p能够促进癌细胞增殖、迁移和侵袭作用。
上皮-间质转化(epithelial-mesenchymal transition,EMT)赋予细胞迁移和侵袭性,EMT参与CRC的迁移进程,而Wnt/β-catenin信号通路参与调控EMT的过程,Wnt/β-catenin信号途径被激活时,E-cadherin/catenin 复合物稳定性遭到破坏而发生一系列生物学作用,最终会导致EMT的发生。该研究采用Western blot检测两种癌细胞Wnt/β-catenin信号通路相关蛋白显示,促进表达组Wnt3a、Wnt5a和β-catenin蛋白相对表达量均较阴性对照组升高,提示Wnt/β-catenin信号通路活化,过表达的miR-513a-3p可能通过调控Wnt/β-catenin信号通路表达促进癌细胞迁移和侵袭作用。研究显示NF-κB信号通路在抑制CRC细胞增殖中也扮演重要的角色。该研究结果显示,促进表达组Wnt3a、Wnt5a和β-catenin蛋白相对表达量均升高,促进表达组p-p65和p-IκBα蛋白相对表达量均较阴性对照组升高,提示NF-κB信号通路活化,过表达的miR-513a-3p可能通过调控NF-κB信号通路表达促进癌细胞增殖作用。
综上所述,miR-513a-3p在CRC组织中的表达升高,细胞实验证实过表达的miR-513a-3p能促进人CRC细胞株HT-29和SW480的生长和迁移,其作用机制可能与NF-κB和Wnt/β-catenin通路的激活相关。
