沙格列汀通过miR-15a-5p/INSR轴缓解糖尿病大鼠胰岛素抵抗的机制研究
2021-08-04吴美芬潘海燕黄兴丽刘裕晓
吴美芬,潘海燕,黄兴丽,刘裕晓,武 革
胰岛素抵抗是2型糖尿病发病的主要机制,也是引起血脂异常、高血压、脂肪肝等疾病的重要原因。作为一种新型二肽基肽酶4抑制剂,沙格列汀在调控胰岛细胞对于葡萄糖的反应中具有良好效果。陈彦平 等研究表明,循环miR-26a高表达的糖尿病患者对于沙格列汀治疗的敏感性更高。胰岛素受体(insulin receptor,INSR)作为一种跨膜蛋白,在多种器官中广泛存在,与胰岛素功能的发挥存在重要关联。研究表明促进INSR表达水平的提高是增强胰岛素敏感性的关键。有研究表明miR-15a在糖尿病患者后代中表达增强,但是其在糖尿病中具体作用的发挥以及影响机制仍需进一步明确。该研究旨在探讨沙格列汀对于2型糖尿病胰岛素抵抗的影响并在分子层面探讨其具体机制。
1 材料与方法
1.1 实验材料
HEK-293T细胞购自南京科佰生物科技有限公司;沙格列汀购自阿斯利康制药有限公司;大鼠blood glucose试剂盒购自上海卡迈舒生物科技有限公司;TRIzol试剂盒购自美国英杰生命技术有限公司;TransScript II Green One-Step qRT-PCR SuperMix试剂盒购自北京全式金生物技术有限公司;pmirGLO质粒及双荧光素酶试剂盒购自美国Promega公司;BCA试剂盒购自上海碧云天生物技术有限公司;RIPA裂解液、链脲佐菌素及三酰甘油(triglyceride,TG)试剂盒均购自北京索莱宝生物技术有限公司;Lipofectamine 3000试剂盒购自美国赛默飞世尔生物技术有限公司;所有抗体均购自美国ABCAM公司,所有引物由深圳华大基因科技有限公司合成;大鼠血糖和胰岛素ELISA试剂盒购自上海哈灵生物科技有限公司;大鼠血压测量仪购自上海玉研科学仪器有限公司;MQ-2000PT糖化血红蛋白(hemoglobin A1c, HbA1c)分析仪购自上海惠中医疗科技有限公司;高/低密度脂蛋白胆固醇(low-density lipoprotein cholesterol,LDL-C)试剂盒购自长春汇力生物技术有限公司;全自动化学发光仪购自美国贝克曼库尔特有限公司。1.2 胰岛素抵抗2型糖尿病(insulin resistance-type 2 diabetes mellitus,IR-T2DM)大鼠模型构建
30只雄性SPF级SD大鼠(10周龄,体质量180~250 g)购自南方模式生物研究中心(上海,中国)。大鼠自由饮水进食且生长条件为12 h的昼夜循环、环境温度标准为20~22 ℃及湿度在50%左右。经适应性喂养1周后,所有雄鼠被随机均分为生理盐水组(n
=5)和IR-T2DM(n
=25)。采取链脲佐菌素(streptozotocin,STZ)联合高脂饮食诱导IR-T2DM大鼠模型:将STZ溶于0.1 mol/L枸橼酸缓冲液配制成5 mg/ml STZ溶液,随后按35 mg/kg腹腔注射至IR-T2DM组大鼠并给予高脂饲料(猪油28%、蔗糖25%、蛋黄3%及普通饲料59%混匀压缩)喂养15周。生理盐水组大鼠则腹腔注射等体积枸橼酸缓冲液并喂养普通饲料15周(小麦粉18%、玉米粉40%、麸皮18%、豆粉20%、骨粉2%及鱼粉2%)。在喂养15周后参照已报道研究测定大鼠收缩压(systolic blood pressure,SP)、舒张压(diastolic blood pressure,DP)、体质量(body weight,BW)、空腹血糖(fasting blood glucose, FBG)、空腹胰岛素(fasting insulin, FIN)、HbA1c含量、TG、LDL-C、高密度脂蛋白胆固醇(how-density lipoprotein cholesterol,HDL-C)并计算HOMA胰岛素抵抗指数(insulin resistance index,IRI,IRI=FBG×FIN/22.5)和胰岛素敏感指数[insulin sensitivity index,ISI,ISI=1/(FBG×FIN)],在第17周后,试剂盒测定大鼠不同时间点(3、7、10、14和21 d)FBG各3次,若各时间点FBG均16.7 mmol/L,则说明建模成功,建模周期均在15~17周。1.3 动物分组及处理
将喂养第15~17周的IR-T2DM组大鼠随机均分为如下5组,每组5只:阴性对照组(转染含miRNA阴性对照的脂质体)、miR-15a-5p mimic组(转染含miR-15a-5p mimic的脂质体)、miR-15a-5p inhibitor组(转染含miR-15a-5p inhibitor的脂质体)、沙格列汀组(沙格列汀溶液灌胃)和miR-15a-5p inhibitor+沙格列汀组。将购自华大基因的miR-15a-5p mimic和miR-15a-5p inhibitor及阴性对照参照Lipofectamine 3000说明书通过尾静脉注射的方式转染至大鼠体内。将沙格列汀溶于生理盐水中形成2 mg/ml沙格列汀溶液,按12 mg/kg 剂量对大鼠灌胃,每天一次,持续8周(分组处理期间,阴性对照组大鼠死亡1只,miR-15a-5p mimic组大鼠死亡2只)。随后采用40 mg/kg的1%戊巴比妥钠溶液腹腔麻醉大鼠,在无菌条件下获取大鼠股四头肌和外周血并保存于液氮中。1.4 靶向INSR的miRNA预测及双荧光素酶报告系统验证
以INSR常用转录本ENST00000341500为输入,搜索TargetScan 7.2数据库(http://www.targetscan.org/vert_72/)中含有Conserved sites的miRNA并选取Pct得分大于0.7的miRNA作为候选miRNA;同时获取miRDB数据库(http://www.mirdb.org/)中Target 得分大于80的miRNA;随后在miRWalk 3.0数据库(http://mirwalk.umm.uni-heidelberg.de/)中以binding probability>0.95靶向位点在3端非翻译区域(untranslated coding regions, UTR)的miRNA为阈值获取候选miRNA。Venny 2.1.0(https://bioinfogp.cnb.csic.es/tools/venny/index.html)绘制3个数据集的候选miRNA的Venn图并取交集。设计INSR的野生型及定点突变的3′UTR 片段并交由华大基因合成,随后分别克隆到含有荧光素酶报告基因pmirGLO上游。挑菌、测序后提纯质粒备用。miR-15a-5p mimic和mimic NC(由美国赛默飞世尔合成)分别与野生型及突变型3′UTR片段按Lipofectamine3000说明书两两共转染至HEK-293T细胞。转染后4 h换液,在37 ℃、CO体积分数为5%的培养箱中培养48 h后,收获细胞。双荧光素酶试剂盒和全自动化学发光仪检测荧光强度。细胞相对荧光素酶活性=萤火虫荧光素酶活性值/海肾荧光素酶活性值。1.5 反转录-PCR和定量-PCR
按TRIzol试剂盒提取骨骼肌和外周血中总RNA。DEPC处理的超纯水溶解RNA,使用ND-1000测量260 nm和280 nm下吸光度值,对总RNA的质量进行鉴定及测定浓度。利用TransScript II Green One-Step qRT-PCR SuperMix试剂盒一步完成RT-PCR合成及Q-PCR。反应体系和反应条件均依据试剂盒说明书进行设置。使用实时荧光定量PCR仪进行扩增,GAPDH和U6 snRNA分别作为基因和miRNA的内参,引物序列见表1。采用溶解曲线评价PCR结果的可靠性,取Ct值(扩增动力曲线拐点),△Ct=Ct(目的基因)-Ct(内参),△△Ct=△Ct(实验组)-△Ct(对照)。
表1 PCR引物
1.6 Western blot实验
RIPA裂解液使用前5 min加入PMSF,使PMSF终浓度为1 mmol/L。将适当的RIPA裂解液加入骨骼肌组织中(每20 mg组织添加200 μl裂解液)并于冰上孵育5 min。裂解物于26 760 r/min,4 °C下离心5 min。上清液采用BCA试剂盒测定蛋白浓度并用ddHO调整,随后进行SDS-PAGE凝胶电泳并转至PVDF膜上。含5% 牛血清蛋白的TBST在摇床上室温封闭1 h。弃去封闭液,加入一抗INSR、p-IRS-1、GLUT4、GAPDH(所有抗体均按1∶1 000稀释,终浓度为1 μg/ml)。将PVDF膜转印面朝上,置于4 ℃冰箱振荡过夜。次日,用TBST漂洗3×10 min。同法加入稀释好的山羊抗鼠IgG二抗,4 ℃孵育4~6 h后,用TBST洗膜3次,每次5 min。PVDF膜与ECL液在室温下反应1 min。吸去液体,覆盖保鲜膜,拍摄X光片,观察结果。以目标条带与内参照条带的灰度值之比作为蛋白质的相对表达量。1.7 统计学处理
使用SPSS 21.0软件包对计量数据进行分析并计算出平均值和标准差。对数据进行正态性检验和方差齐性检验,若符合正态分布,则两组间数据分析使用t
检验且多组间数据的比较采用单因素方差分析,进一步两两比较采用LSD法。若不符合正态分布,两组间数据使用Kolmogorov-Smirnov检验且多组数据采用Kruskal-Wallis检验。等级资料两两比较采用秩和检验。P
<0.05为差异有统计学意义。2 结果
2.1 沙格列汀调控胰岛素抵抗的可能分子机制
多种预测工具预测INSR的上游共同miRNA(图1A)并检测上述miRNA在沙格列汀处理后IR-T2DM大鼠骨骼肌组织中的表达,结果显示(图1B),与生理盐水组相比,IR-T2DM大鼠骨骼肌miR-497-5p与miR-15a-5p升高(均P
<0.05),但miR-4458、miR-6838-5p水平变化不明显;IR-T2DM鼠经沙格列汀处理后,miR-4458、miR-6838-5p表达升高(均P
<0.05)而let-7i-5p表达无明显变化,但miR-497-5p与miR-15a-5p表达降低(均P
<0.05)。推测沙格列汀可能通过下调miR-497-5p与miR-15a-5p来促进糖尿病的治疗。该研究选择与2型糖尿病发病及胰岛素抵抗的功能研究目前尚未完全明确的miR-15a-5p进行后续研究。随后双荧光素酶报告系统进一步验证了miR-15a-5p和INSR的靶向关系(图1C、D)(P
<0.05)。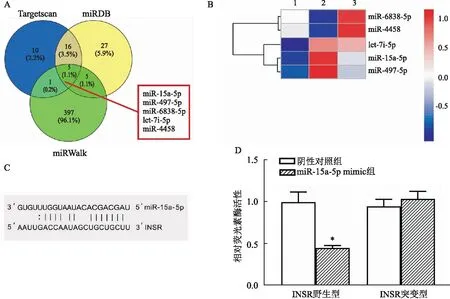
图1 沙格列汀调控胰岛素抵抗的可能的分子机制
2.2 沙格列汀通过介导miR-15a-5p对IR-T2DM大鼠INSR、IRS-1和GLUT4表达的影响
将IR-T2DM大鼠分别进行阴性对照、miR-15a-5p mimic、miR-15a-5p inhibitor转染或沙格列汀处理。检测IR-T2DM大鼠骨骼肌中INSR、IRS-1和GLUT4的mRNA和蛋白表达,结果显示(图2):与阴性对照组相比,IR-T2DM大鼠经miR-15a-5p inhibitor或沙格列汀处理后INSR、IRS-1和GLUT4 mRNA 的蛋白表达及磷酸化IRS-1表达被诱导(均P
<0.05);但miR-15a-5p mimic组中上述分子表达下调(均P
<0.05)。与miR-15a-5p inhibitor或沙格列汀单独处理相比,两者联合处理则有利于升高INSR、IRS-1和GLUT4 mRNA的蛋白及磷酸化IRS-1的表达(均P
<0.05)。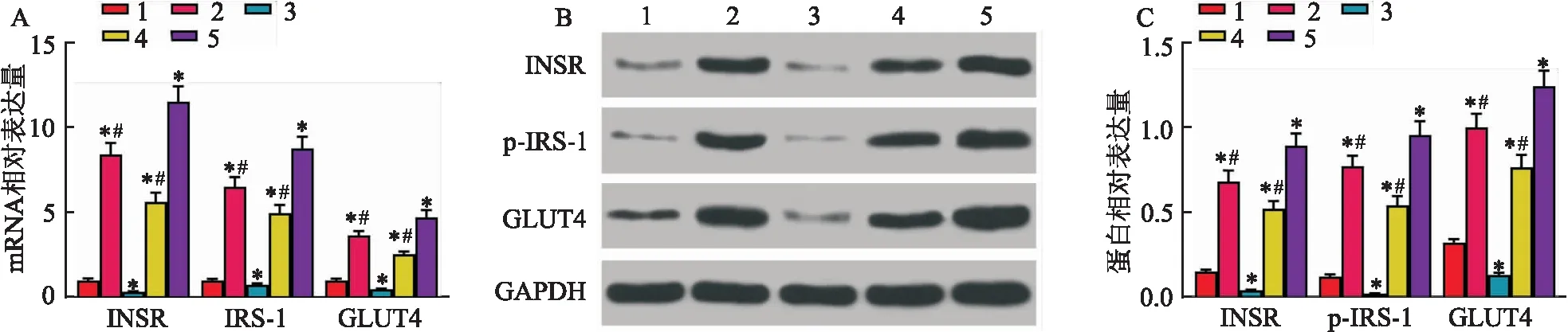
图2 INSR、IRS-1和GLUT4在不同处理后的IR-T2DM大鼠骨骼肌中表达
2.3 各组大鼠血清HbA1c、TG、HDL-C和LDL-C表达检测结果
对各组大鼠血清HbA1c、TG、HDL-C 和LDL-C表达进行检测,结果表明(表2):与阴性对照组相比,miR-15a-5p inhibitor组和沙格列汀组IR-T2DM大鼠血清HbA1c、TG和LDL-C水平下调,但HDL-C合成在上述组中升高(均P
<0.05)。IR-T2DM大鼠转染miR-15a-5p mimic后相对于阴性对照其HbA1c、TG和LDL-C生成被诱导,但miR-15a-5p mimic组HDL-C浓度降低(均P
<0.05)。与单独处理组比较,miR-15a-5p inhibitor联合沙格列汀能更有效地改善IR-T2DM大鼠血清糖和脂代谢障碍(均P
<0.05)。因此,沙格列汀能通过介导miR-15a-5p有效调节IR-T2DM大鼠糖和脂代谢。
表2 HbA1c、TG、HDL-C 和LDL-C在不同处理后IR-T2DM大鼠血清中浓度
2.4 沙格列汀通过介导miR-15a-5p对IR-T2DM大鼠的胰岛素敏感性的影响
为检测miR-15a-5p或沙格列汀对IR-T2DM大鼠IRI和ISI的影响。IR-T2DM大鼠分别进行miR-15a-5p mimic、miR-15a-5p inhibitor或沙格列汀处理。之后测定其SP、BW、FBG和FINS并计算IRI和ISI。结果显示(图3):与阴性对照组相比,miR-15a-5p inhibitor组和沙格列汀组IR-T2DM大鼠ISI升高,同时该组SP、DP和IRI较为下降(均P
<0.05);此外,SP、DP和IRI的值在miR-15a-5p mimic组IR-T2DM大鼠中明显升高并伴随着ISI的下降(均P
<0.05)。另外,与同时期阴性对照组相比,miR-15a-5p inhibitor和沙格列汀组IR-T2DM大鼠体质量在第4周和第8周增加,而miR-15a-5p mimic组在第2、4和8周体质量均下降(均P
<0.05)。联合组较单独处理组而言能更明显地增强IR-T2DM大鼠的胰岛素敏感性指标(均P
<0.05)。基于上述结果,沙格列汀可能通过介导miR-15a-5p增强IR-T2DM大鼠的胰岛素敏感性,从而促进机体对葡萄糖的利用。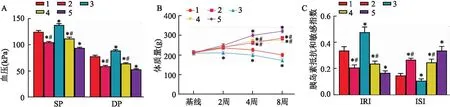
图3 不同处理后IR-T2DM大鼠胰岛素敏感性指标、血压及体质量
3 讨论
该研究通过生物信息学以及实验手段选定miR-15a-5p进行研究,结果显示沙格列汀能够通过调控miR-15a-5p的表达进而影响INSR,增强IR-T2DM大鼠胰岛素敏感性、改善胰岛素抵抗的情况。
既往的研究表明沙格列汀可以通过增加细胞胰岛素敏感性,从而激活INSR级联信号来促进机体对葡萄糖的利用率。近年来沙格列汀在糖尿病治疗中的潜在的分子机制不断被明确,如张政军 等研究表明沙格列汀能够通过调节miR-590/TLR4/NF-κB信号通路进而改善血管内皮细胞损伤。此外,也有研究表明,SDF-1α介导了沙格列汀对胰岛β细胞增殖的保护作用。陈彦平 等认为高表达miR-26a的糖尿病伴非酒精性脂肪肝患者在沙格列汀治疗中能够取得更好的效果。该研究对筛选得到的交集靶miRNA在生理盐水组大鼠、IR-T2DM以及沙格列汀治疗组大鼠中的表达进行检测发现,相对于生理盐水组、T2DM组miR-497-5p和miR-15a-5p表达增强,而接受沙格列汀处理后上述因子表达被抑制。推测沙格列汀可能通过下调miR-497-5p与miR-15a-5p来促进糖尿病的治疗。多项研究表明miR-497-5p能靶向INSR进而影响糖尿病大鼠胰岛素抵抗和耐药性机制。另外Wang et al研究表明上调miR-497-5p能通过靶向INSR诱导E3大鼠的肝胰岛素抵抗机制。除了Houshmand et al研究表明miR-15a在糖尿病患者后代中表达升高,并没有关于miR-15a和2型糖尿病具体发病机制关系的相关研究,因此,该研究关注miR-15a对胰岛素抵抗功能的影响。但也有研究表明,miR-15a在糖尿病患者外周血中表达降低并且可作为糖尿病诊断的潜在标志物。这一发现与该研究的结果趋势相反,推测miR-15a可能由于组织差异性的表达从而在不同组织中发挥不同功能。此外,IR-T2DM大鼠在接受沙格列汀处理后miR-15a-5p表达被抑制,且miR-15a-5p与INSR的靶向关系被随后验证,即沙格列汀可能通过调控miR-15a-5p介导INSR进而参与IR-T2DM的治疗。
IRS1为INSR底物家族的一员并且被证实是引起T2DM发病的重要因子,该基因缺失的大鼠表现为胰岛素抵抗。GLUT4是人体内主要的葡萄糖转运载体,在心肌、骨骼肌以及脂肪细胞等多种对胰岛素敏感的细胞中表达,其能够在胰岛素的刺激下转运至细胞膜并促进葡萄糖储存于上述组织和细胞中,多种针对T2DM治疗的药物均能够通过促进GLUT4的表达进而增强胰岛素敏感性。该课题组通过研究表明T2DM大鼠在接受miR-15a-5p inhibitor或沙格列汀处理后其骨骼肌中INSR和GLUT4表达增强且二者联合作用效果更明显,表明沙格列汀通过调控miR-15a-5p的表达进而促进T2DM的改善。此外,沙格列汀还能够调节miR-15a-5p促进IR-T2DM大鼠血清糖和脂代谢相关指标的改善。对各组大鼠血压相关指标以及IRI和ISI等指标进行检测,沙格列汀治疗或抑制miR-15a-5p的表达能够改善大鼠血压相关指标,降低IRI并促进胰岛素敏感的改善。另外,该研究还对各组大鼠的体质量进行了测量,结果显示沙格列汀组和miR-15a-5p inhibitor组大鼠体质量在第4周和第8周增加,而miR-15a-5p mimic组大鼠体质量则下降。miR-15a-5p inhibitor、沙格列汀组和联合组大鼠在第2周体质量变化较阴性对照组不明显,推测可能有增加的趋势,且P
值接近显著性的阈值,可能是由于样本量较小而导致差异不明显。