Scara3介导巨噬细胞对多壁碳纳米管摄取和炎症细胞因子产生的影响
2021-08-04何佳丽王其其赵子悦徐结苟
王 琼,何佳丽,王其其,赵子悦,徐结苟
人工合成纳米材料(engineered nanomaterial, ENM)进入机体后产生炎症等异物反应。巨噬细胞对颗粒性异物的吞噬作用是一个重要防御机制。巨噬细胞的病原微生物吞噬有两种基本方式:① 巨噬细胞膜上的模式识别受体介导的吞噬;② 调理吞噬,即巨噬细胞膜上的FcγR或补体受体介导的吞噬。ENM在体液中其表面吸附了多层蛋白质,其中包含IgG和补体,通过它们的调理作用从而促进巨噬细胞的吞噬。
多壁碳纳米管(multi-walled carbon nanotubes, MWCNT)是一种新型纳米材料,具有良好的应用前景,但在动物实验中其具有炎症、纤维化和恶性肿瘤等肺部毒性。该课题组前期研究表明刺激小鼠巨噬细胞Raw264.7清道夫受体A成员3(scavenger receptor A member 3,Scara3)表达增高,该研究将深入探讨Scara3在巨噬细胞对 MWCNT的摄取和炎症细胞因子产生中所起的作用。
1 材料与方法
1.1 试剂与仪器
纳米材料MWCNT购自三井化学有限公司;SiO购自美国Sigma-Aldrich公司;TiO购自日本化妆品协会;富勒烯C60购自日本先端碳材料株式会社;TRIzol试剂购自广州美基生物科技有限公司;HiScript® Ⅱ QRT SuperMix for qPCR试剂盒、AceQ® qPCR SYBR Green Master Mix试剂盒和2×Rapid Taq Master Mix试剂盒均购自南京诺唯赞生物科技股份有限公司;siRNA、shRNA质粒均购自上海吉玛基因有限公司;抗Scara3抗体购自美国Novusbio公司;抗Gapdh抗体购自美国Peprotech公司;电化学发光显影液(ECL)购自赛默飞世尔科技有限公司;X-VIVO巨噬细胞无血清培养基购自比利时Lonza公司;ELISA试剂盒购自上海酶联生物有限公司。Polytron PT1600 E匀浆器购自瑞士Kinematica公司;JY92-2超声粉碎仪购自宁波新芝生物科技股份有限公司;LightCycler 96定量PCR仪购自美国Roche公司;NEPA21高效基因电转仪购自日本NEPA GENE公司;凝胶数码成像分析系统购自上海天能科技有限公司;ECLIPSE偏光显微镜购自尼康仪器有限公司。
1.2 细胞系及培养
小鼠巨噬细胞系Raw264.7购自中国科学院典型培养物保藏委员会细胞库。RAW264.7复苏后,用添加了10%胎牛血清和1%青霉素-链霉素的DMEM培养基在37 ℃、5% CO培养箱中培养,传代用0.25%胰蛋白酶消化。1.3 ENM悬液的制备
在无菌条件下分别称取MWCNT、SiO、TiO及富勒烯C60纳米材料粉末各10 mg,放入20 ml含0.5% Pluronic F-68的生理盐水中。MWCNT悬液用匀浆器打碎(3 000 r/min)4次,每次1 min,间隔2 min。然后MWCNT及其他纳米材料悬液每次使用前用超声粉碎仪以600 W超声处理15 min。终浓度为500 g/L。1.4 RNA的提取、逆转录和定量PCR
Raw264.7细胞总RNA提取、逆转录和定量PCR分别采用TRIzol、HiScript® Ⅱ QRT SuperMix for qPCR和AceQ® qPCR SYBR Green Master Mix试剂盒进行,使用定量PCR仪分析靶基因表达情况。以GAPDH为内参,2法计算各靶基因的相对表达量。小鼠靶基因所使用的定量PCR引物见表1。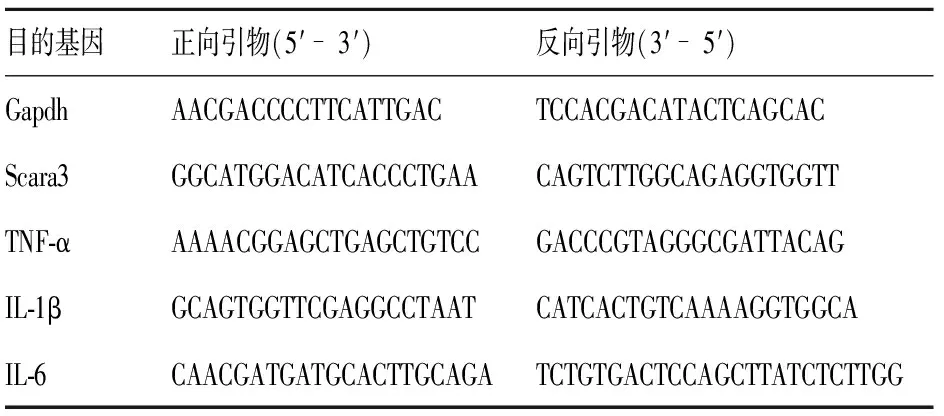
表1 引物序列
1.5 建立Raw264.7的Scara3 k/d稳定表达株
1×10个Raw264.7细胞悬于Opti-Mem中,加入1 μg Scara3 shRNA质粒 DNA(预先用3条siRNA进行预实验,选用敲低效果最佳的序列建立shRNA质粒),混匀后,用NEPA21高效基因电转仪转染。24 h后,培养基中加入800 mg/L G418进行筛选,约14 d后大部分细胞死亡,极少部分转染成功的细胞存活形成克隆。挑取较大的细胞克隆于24孔板培养,待细胞长满后再扩大培养来建立稳定细胞株。对Scara3的敲低效果采用普通PCR、定量PCR和Western blot进行检测。RNA提取、逆转录和定量PCR方法见1.4。普通PCR反应使用2×Rapid Taq Master Mix进行,用1 %琼脂糖凝胶进行电泳后,使用成像分析仪器进行成像。Scara3蛋白表达采用Western blot检测,简述如下:20 mg总蛋白上样进行10 % SDS聚丙烯酰胺凝胶电泳。转膜、封闭后,加入一级抗体(抗Scara3,1∶1 000稀释;以及抗GAPDH,1∶1 000稀释)4 ℃过夜,TBST洗3次,然后将膜与1∶10 000稀释的二级抗体共孵育1 h。最后使用ECL进行显影成像。
1.6 MWCNT对巨噬细胞的暴露
取1×10个对数生长期的空载或Scara3 ShRNA稳转的Raw264.7细胞,接种于6孔板,在含1 mg/L LPS的DMEM完全培养基培养8 h后,细胞大部分被LPS活化贴壁,吸去细胞培养上清液,更换为含10% 胎牛血清及1 mg/L LPS的X-VIVO巨噬细胞无血清培养基或含1 mg/L LPS的X-VIVO巨噬细胞无血清培养基,培养24 h后,加入10 mg/L MWCNT刺激12 h后,收取上清液和细胞分别用于Elisa和定量PCR检测细胞因子的表达情况。1.7 炎症细胞因子分析
收取的细胞培养上清液3 000 r/min离心20 min,去除沉淀。上清液中肿瘤坏死因子(tumor necrosis factors,TNF)-α、白介素(interleukin,IL)-1β及IL-6的浓度采用ELISA试剂盒按产品说明进行测定。细胞中TNF-α、IL-1β及IL-6的mRNA表达按1.4方法进行测定。1.8 偏振显微镜观察细胞摄取
取1×10个对数生长期的空载或Scara3 ShRNA稳转的Raw264.7细胞,接种于预先放置了细胞爬片的6孔板,在含1 mg/L LPS的DMEM完全培养基培养过夜,大部分细胞被LPS活化贴壁,轻轻吸去细胞培养上清液和未贴壁的细胞。更换培养基为添加或不加10%胎牛血清的含1 mg/L LPS的X-VIVO巨噬细胞无血清培养基继续培养12 h,然后加入1 mg/L的MWCNT刺激12 h。细胞爬片上的细胞经4 %多聚甲醛固定20 min后进行HE染色,然后用中性树胶封片。使用ECLIPSE偏光显微镜,在20倍镜下随机选取10个视野来观察细胞中含有的发光MWCNT数量,然后计算含发光MWCNT的细胞数占细胞总数的百分比。
2 结果
2.1 MWCNT悬液的制备和观察结果
为了研究MWCNT对巨噬细胞的作用,先将MWCNT干粉制成悬液。电子显微镜下MWCNT在悬液中仍然呈管状,并聚集成大小不等的团块(图1A),经NanoSight分析显示这些聚集团块的大小。见图1B。
图1 MWCNT的形态和大小
2.2 MWCNT诱导Scara3表达增加和建立稳定Scara3敲低的细胞系
定量PCR的结果显示,在MWCNT刺激的Raw264.7细胞中Scara3的表达远高于对照组和其他纳米材料(SiO、TiO及富勒烯C60)刺激组(图2A),提示Scara3可能参与了巨噬细胞对MWCNT的吞噬以及细胞因子产生等过程。为了阐明Scara3在巨噬细胞对MWCNT吞噬以及细胞因子产生的作用,首先采用shRNA技术建立了稳定Scara3表达敲低(Scara3 k/d)Raw264.7系。图2B显示2个代表性克隆Scara3的表达,其中1个克隆(克隆8)的Scara3 mRNA被明显敲低;定量PCR表明克隆8的Scara3约为稳定转染对照质粒(NC)细胞的10.65 %(图2C)。Western blot进一步表明克隆8 Scara3蛋白表达也显著下降(图2D)。因此,随后的研究在克隆8细胞系(Scara3 k/d组)和稳转对照-5(NC组)细胞系上进行。
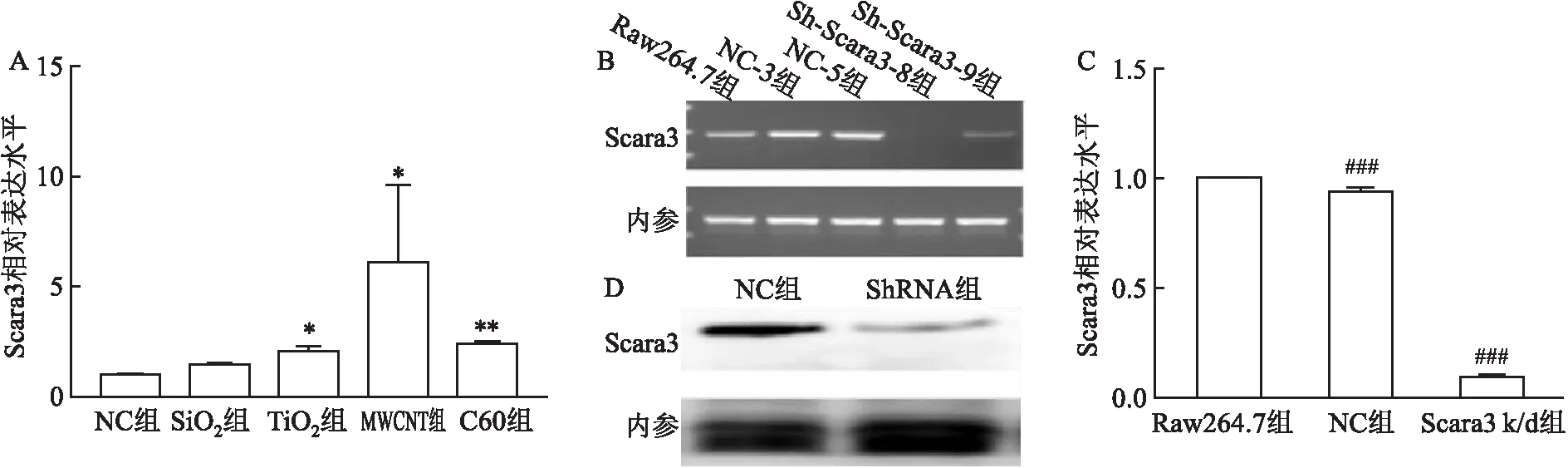
图2 Scara3的敲低结果
2.3 Scara3敲低减少炎症细胞因子的产生
该研究以TNF-α、IL-1β和IL-6为指标来观察巨噬细胞对MWCNT刺激的反应。如图3A、B和C所示,与存在血清条件相比,无血清条件时,无论是NC组还是Scara3 k/d组巨噬细胞经MWCNT刺激后所表达的TNF-α、IL-1β和IL-6的mRNA均有一定程度下降;而与NC相比,无论是存在还是不存在血清的条件下,Scara3 k/d都明显降低了MWCNT诱导巨噬细胞产生的TNF-α、IL-1β和IL-6的mRNA表达水平。使用ELISA测定培养上清液中这些炎症细胞因子的含量,结果显示在存在和不存在血清的两种条件下,Scara3 k/d组MWCNT刺激后,巨噬细胞产生的TNF-α和IL-1β的分泌降低(图3D、E、F)。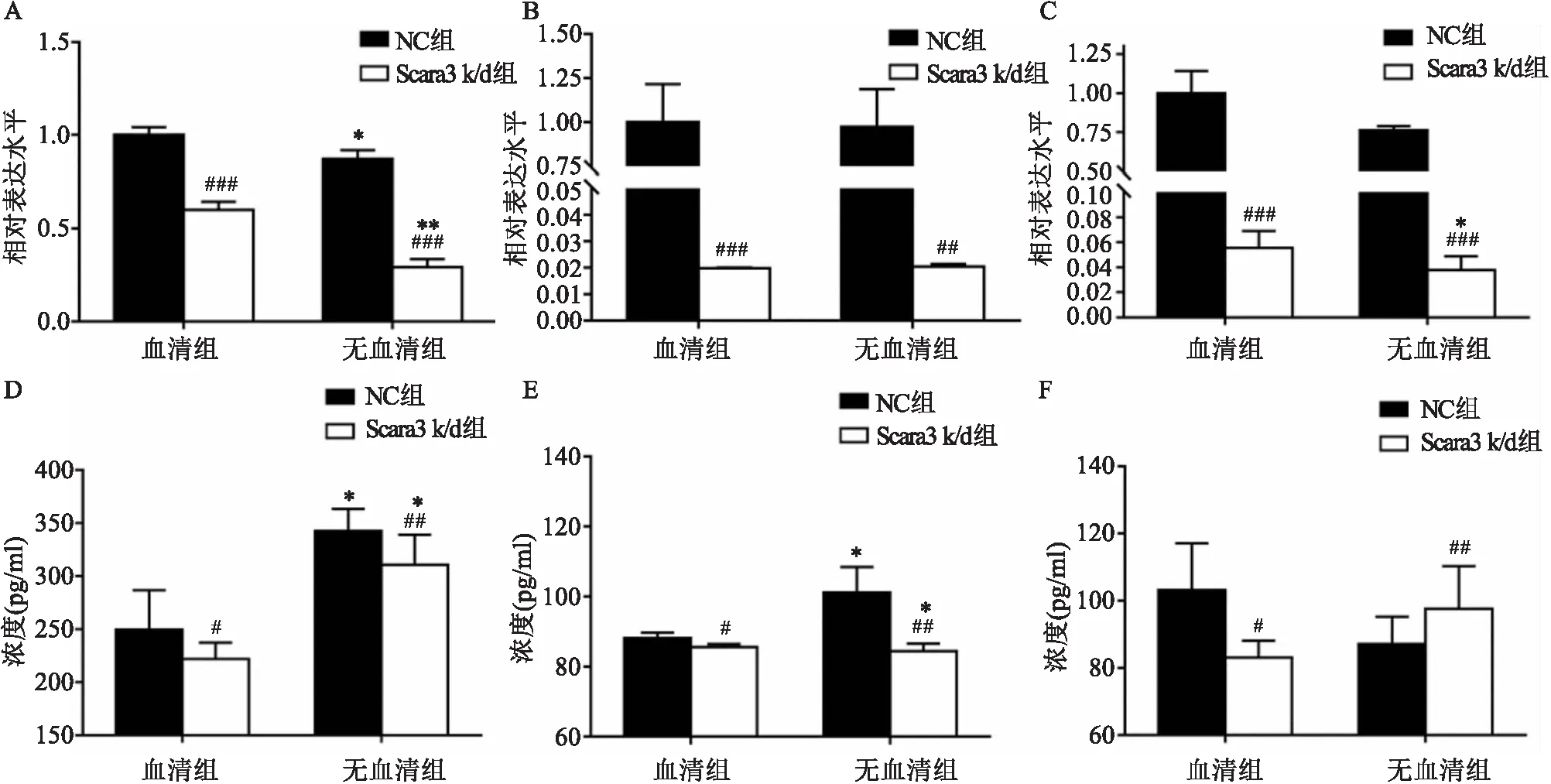
图3 Scara3敲低炎症细胞因子的表达情况
2.4 Scara3敲低后降低对MWCNT的摄取
偏光显微镜技术利用光折射原理,在弱光源背景下,颗粒性材料会发出折射的光。因此,在偏光显微镜下可以观察到MWCNT的分布。通过偏光显微镜观察显示,在存在血清时,NC细胞中含有MWCNT的比例较多(图4A、E),而Scara3 k/d细胞中的比例下降(图4B、E);同样,在不存在血清时,NC细胞和Scara3 k/d细胞中该比例分别为(13.40±5.23)%和(9.29±2.11)%(图4C、D和E)。关于吞噬率的统计学比较,血清组中Scara3 k/d与NC组比较的P
=0.000 18,无血清组中Scara3 k/d与NC组比较的P
=0.000 34;无血清组NC与血清组NC比较的P
=0.000 16,无血清组Scara3 k/d与血清组Scara3 k/d比较的P
=0.012,差异有统计学意义。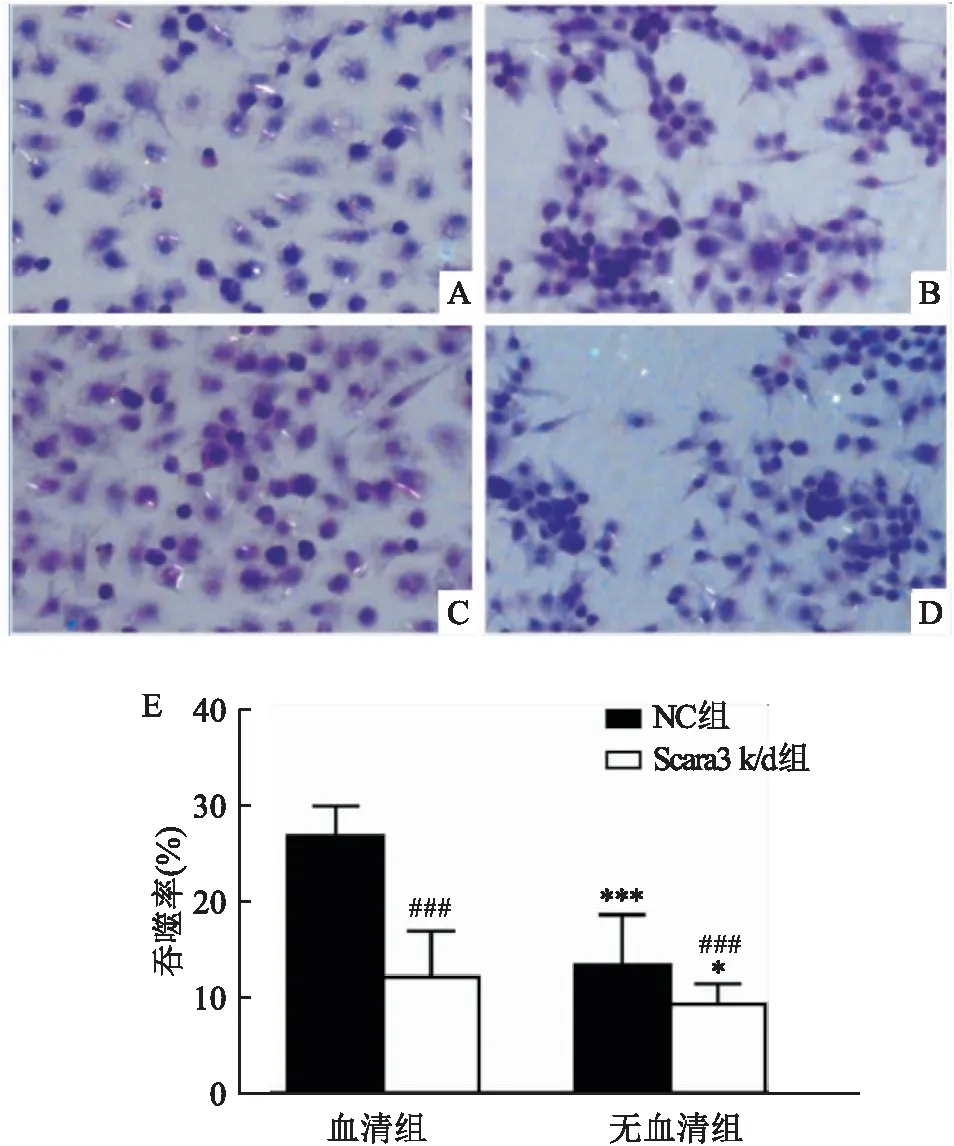
图4 MWCNT的摄取 HE×20
3 讨论
新型纳米材料MWCNT在材料科学、半导体工业和生物医学领域具有良好的应用前景,但许多研究表明MWCNT可以引起机体的炎症反应以及其他毒性。巨噬细胞通过对MWCNT等颗粒性物质的吞噬而清除进入机体的这些颗粒性材料,起到保护机体的防御作用,但同时巨噬细胞颗粒性材料而活化后产生许多细胞因子和氧自由基,促进炎症反应,引起细胞损伤。因此,了解巨噬细胞对MWCNT的吞噬和炎症因子产生在研究MWCNT毒性机制和指导更安全的MWCNT等方面具有重要意义。
既往研究中通过转录组高通量测序,表明在纳米材料刺激小鼠巨噬细胞Raw264.7基因表达谱改变中,纳米材料诱导了几个模式识别受体的表达增加,其中包含Scara3,尤其在MWCNT刺激的Raw264.7细胞中Scara3的表达量明显增加。定量PCR的结果表明,在MWCNT刺激的Raw264.7细胞中Scara3的表达远高于对照组和其他纳米材料(SiO、TiO及富勒烯C60)刺激组,提示Scara3可能参与了巨噬细胞对MWCNT的吞噬以及细胞因子产生等过程。所以该研究通过基因沉默和偏光显微镜技术等方法进行研究,结果表明了巨噬细胞膜上的Scara3介导了对MWCNT的识别和摄取以及炎症细胞因子的产生。Scara3属于A类清道夫受体,以同源二聚体表达于质膜和内质网膜上,氧自由基诱导其表达增加。Scara3的配体主要为脂质成分,其多形性和表达异常与肥胖、冠心病等代谢疾病相关, 也与手足口疫、冠状病毒和埃博拉病毒感染有关。最近的研究表明Scara3也介导了球形核酸纳米颗粒透过表皮细胞。这些研究结果提示Scara3可以结合不同的配体,参与巨噬细胞的识别和吞噬过程。该研究表明在无血清的条件下,巨噬细胞仍能吞噬MWCNT,诱导细胞因子产生,尽管与存在血清时相比有所下降,说明了巨噬细胞除了血清中补体、IgG等调理素介导的吞噬作用以外,还有其他介导识别和吞噬MWCNT的机制。无论是存在还是不存在血清的条件下,基因沉默Scara3均会导致MWCNT吞噬和细胞因子下降,显示Scara3可以直接识别MWCNT,或者通过识别吸附的脂质等成分,介导MWCNT吞噬和细胞因子产生。
该研究探讨了巨噬细胞通过Scara3介导其对MWCNT的吞噬和炎症细胞因子的产生。Scara3在MWCNT诱发的炎症、纤维化和肿瘤发生中的作用值得进一步研究。
