EPO对低氧状态下牙髓细胞增殖和保护的实验研究
2021-08-03殷亮亮李春年
殷亮亮,李春年
(河北医科大学口腔医学院, 河北医科大学口腔医院牙体牙髓科,河北省口腔医学重点实验室,河北省口腔疾病临床医学研究中心,河北 石家庄 050017)
牙髓坏死主要是由牙髓缺氧造成的。细菌感染、温度、充填材料的物理化学刺激、创伤等都会造成牙髓组织处于缺氧状态。线粒体[1]是体内氧气使用的主要场所,其功能障碍在缺氧性疾病的病理生理发展中起着关键作用。组织缺氧时,三磷酸腺苷生成减少,进而降低线粒体的呼吸功能。严重缺氧时线粒体可出现肿胀、嵴崩解、外膜破裂和基质外溢等病变,进而导致细胞本身及周围组织的溶解、坏死。促红细胞生成素(erythropoietin,EPO)最初被认为只在调节红细胞生成中发挥着关键作用[2-3]。越来越多的研究表明,EPO是DNA缺氧反应元件的关键基因之一,缺氧诱导因子1(hypoxia inducible factor-1,HIF-1)可以与EPO结合并驱动其转录,提供组织保护。EPO信号具有多种生物学效应,如促进创伤愈合、诱导内皮细胞增殖和迁移、刺激血管生成等。此外,EPO通过抑制白细胞介素等多种促炎细胞因子的产生,具有良好的抗炎作用。由于EPO能够促进血管生成并具有抗炎活性,推测EPO这些特征可能在牙髓修复和再生中发挥着作用。然而,到目前为止,EPO对缺氧状态下牙髓细胞的作用还未见报道。因此,本研究通过观察缺氧条件下EPO对牙髓细胞的作用,探讨低氧状态下牙髓细胞的增殖和保护机制。
1 资料与方法
1.1一般资料 选取河北医科大学口腔医院口腔颌面外科门诊因正畸需拔出的前磨牙或第三磨牙,男性10例,女性8例,年龄14~18岁,平均年龄16岁,未做过充填治疗和牙髓治疗,无龋坏,无根裂。
患者已签署知情同意书,实验已经过河北医科大学口腔医院医学伦理委员会批准。
1.2实验材料
1.2.1实验仪器设备 细胞培养箱(美国Thermo公司);超净工作台(Thermo Eleetron公司);倒置相差显微镜(德国ZEISS公司);Synergy-TH酶标仪(美国Biotech公司);低温高速离心机(美国Thermo公司);YP2001N电子天平(上海精密科学仪器有限公司);低速离心机(北京医用离心机厂);高压蒸汽灭菌器(日本松下健康医疗器械株式会社)。
1.2.2实验器材 25 cm2培养瓶,75 cm2培养瓶(ThermoFisher,美国);6孔细胞培养板,96孔细胞培养板(美国Corning公司)。
1.2.3实验试剂 胎牛血清,青、链霉素混合液,PBS磷酸盐缓冲液(以色列BI公司);高糖DMEM(dulbecco′s modified eagle medium)培养液,胰蛋白酶(美国Gibico公司)CCK-8试剂盒,碱性磷酸酶(alkaline phosphatase activity,ALP)试剂盒(中国碧云天生物技术研究所);EPO(沈阳三生制药有限责任公司)。
1.3实验方法
1.3.1离体牙取材 牙齿拔除后自根尖部至冠部碘伏消毒3遍,高速手机和无菌水冷却在牙颈部制备环形沟槽,不能穿髓,制备完成后将离体牙立刻置于预冷的含有1%双抗的基础培养基中,1 h内转运至实验室对牙髓组织取材,进行原代细胞培养。
1.3.2牙髓细胞培养 将收集的离体牙用含有2%双抗(200 g/mL青霉素和200 g/mL链霉素)的PBS溶液清洗3遍,用技工剪沿着牙颈部预磨好的凹槽剪断,拔髓针取出牙髓后剪去根尖区2 mm的牙髓,剩余的牙髓组织用含1%双抗PBS溶液清洗3遍,将清洗干净的牙髓组织用无菌眼科剪剪碎,使组织块体积约为0.5 mm×0.5 mm×0.5 mm大小,移入15 mL离心管中,加入1 mL的I型胶原酶(3 g/L)和中性蛋白酶(4 g/L),置于37 ℃,5% CO2培养箱中孵育,消化40 min,每隔15 min吹打组织块,使组织块与酶充分接触,直到组织块消化为棉絮状,然后加入3 mL含10%FBS的培养液终止消化,并进行吹打,充分接触。将离心机设置为1 000 r/min,离心5 min,去除上清液,加入3 mL的含10%FBS的培养液重悬,将悬液接种于8 cm2培养皿中,在37 ℃,5% CO2细胞培养箱内培养。3 d更换一次培养液,细胞生长汇合至80%时,用胰蛋白酶消化传代。
1.3.3牙髓细胞的传代 在倒置显微镜下观察细胞外形及细胞状态,原代牙髓细胞生长至80%时,可进行传代。在超净工作台下用1%双抗PBS荡洗培养皿3遍,清洗力度要轻柔,防止细胞损伤。然后加入1 mL 0.25%胰蛋白酶溶液,溶液量要达到与培养皿底细胞充分接触,在37 ℃恒温培养箱孵育2 min,在显微镜下及时观察,当贴壁细胞趋于圆形、细胞开始少量飘起时,加入2~3倍胰蛋白酶溶液体积的完全培养基终止消化。用巴氏吸管将皿底的细胞充分吹打,使细胞从皿底脱壁,移入离心管中,将离心机设置为1 000 r/min,离心5 min,去除上清液,加入3 mL含10% FBS的培养液重悬,按1∶2或1∶3进行传代,加入适量培养液,混匀后于37 ℃恒温培养箱中培养,24 h后换液,之后每3 d换液,牙髓细胞生长至80%时,进行下一次传代。
1.3.4牙髓细胞的冻存 取正常生长并增殖至80%的牙髓细胞,PBS清洗3遍,消化离心后获得细胞团块,加入4℃预冷的细胞冻存液(配置方法:10% 二甲基亚砜(dimethyl sulfoxide,DMSO)、30%胎牛血清、60% 高糖培养基,现配,细胞计数,将细胞密度调整为(1~3)×106个/mL,细胞悬液分装成每管1 mL至冻存管,在冻存管上标明细胞名称、细胞代数、时间及操作者。冻存步骤为4 ℃、30 min,-20 ℃、60 min,-80 ℃过夜然后转移至液氮罐中进行长期保存。冻存后1周取一管进行复苏,检测细胞冻存效果,以便进行后续试验。
1.3.5牙髓细胞的复苏 从液氮容器中取出冻存管,在37 ℃恒温水浴箱中浸泡,并不断摇动使其尽快融化。从37 ℃水浴中取出冻存管,吸出细胞悬液,移入离心管中并加入10倍以上培养液,混匀,离心5 min,弃上清,加入含10%FBS培养液重悬细胞并计数,调整细胞密度,接种于培养皿中,放入37 ℃培养箱中培养,24 h细胞贴壁后更换培养液,之后每3 d换液,继续培养。
1.3.6CCK-8法检测EPO在低氧状态下对牙髓细胞增殖的影响 ①选用第4代生长状态良好的牙髓细胞,0.25%胰蛋白酶消化后制取细胞悬液,以2×104个/mL密度接种至96孔板内,每孔200 μL,24 h细胞贴壁后,吸去孔中培养液,用PBS清洗3遍。②实验分为实验组和对照组。实验组中在贴壁细胞孔内加入200 μL含有浓度为20 U/mL EPO的完全培养液,对照组中在贴壁细胞孔内加入200 μL仅含10%FBS的高糖DMEM培养液。③将培养箱氧气浓度调至1%,分别培养24 h、48 h、72 h后,弃去孔内的培养液,PBS清洗3遍后每孔加入100 μL培养液和10 μL CCK-8溶液,培养箱内孵育2~4 h,用酶标仪检测各孔450 nm波长的OD值。
1.3.7ALP检测EPO在低氧状态下对牙髓细胞分化的影响 ①选用第4代生长状态良好的牙髓细胞,0.25%胰蛋白酶消化后制取细胞悬液,以2×104个/mL密度接种至96孔板内,每孔200 μL,24 h细胞贴壁后,吸去孔中培养液,用PBS清洗3遍。②实验分为实验组和对照组。实验组中在贴壁细胞孔内加入200 μL含有浓度为20 U/mL EPO的完全培养液,对照组中在贴壁细胞孔内加入200 μL仅含10%FBS的高糖DMEM培养液。③将培养箱氧气浓度调至1%,分别培养24 h、48 h、72 h后,弃去孔内的培养液,PBS清洗3遍后加入250 μL/孔RIPA裂解液,同时反复吹打,提取细胞蛋白。根据ALP试剂盒说明书,按照不同分组分别将蛋白样品加入96孔板内,每孔30 μL,再分别加入基质液和缓冲液各50 μL,37 ℃孵育15 min,加入显色剂150 μL,酶标仪检测在520 nm波长下的吸光度值。
1.4统计学方法 应用SPSS 24.0统计软件进行数据分析。相同实验条件下重复3次,计量资料比较采用重复测量的方差分析。P<0.05为差异有统计学意义。
2 结 果
2.1牙髓细胞形态 倒置显微镜下观察发现,用改良组织块酶消化法进行原代牙髓细胞培养,原代培养第3天,可见牙髓细胞从组织块边缘爬出,成放射状,原代细胞培养14 d左右基本长满,细胞呈长梭形,纤维状。细胞数量较多时呈放射状或旋涡状,生长汇合至80%时可进行传代。见图1~4。
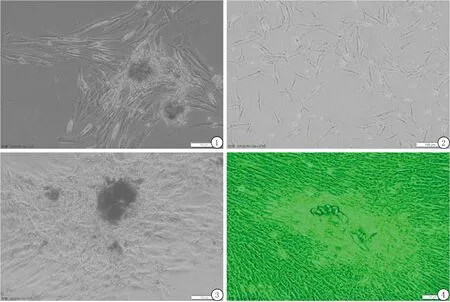
图1 人牙髓细胞原代培养第3天(倒置显微镜 ×200)
2.2低氧状态下EPO对牙髓细胞增殖和分化的作用 低氧状态下在浓度为20 U/mL的EPO分别作用于牙髓细胞24 h、48 h、72 h后,在酶标仪上测定450 nm波长下各孔的吸光度值,结果显示:各时间点的吸光度值实验组均高于对照组,差异有统计学意义(P<0.05);在酶标仪测定520 nm波长下各孔的吸光度值,结果显示:在24 h、48 h、72 h吸光度实验组与对照组比较差异无统计学意义(P>0.05)。见表1。
表1 低氧状态下EPO对牙髓细胞增殖及分化的作用Table 1 Effect of EPO on dental pulp cell proliferation and differentiation under hypoxic condition
3 讨 论
研究表明,缺氧直接影响MALAT1基因的转录。MALAT1通过缺氧控制着内皮细胞的表型转变,抑制内皮细胞的增殖。此外,缺氧可诱导MiR-140-5p抑制细胞,降低细胞活力,加速细胞损伤和凋亡。缺氧诱导因子(hypoxia inducible factor,HIF)[4-6]途径在缺氧反应中也起着重要作用,在缺氧条件下,HIF-1α进入细胞核,与其亚基结合形成HIF-1,并与其他蛋白一起结合到miR-210[7],引起缺氧反应相关基因的表达,进而导致细胞本身及其周围组织的溶解、坏死。而缺氧诱导基因的表达对EPO基因表达起着重要作用,缺氧诱导的核因子通过蛋白合成与EPO基因结合,从而促进EPO基因的转录激活。研究已表明,EPO及受体在炎症的牙髓组织中也会高度表达。当细胞缺氧时,EPO可以调节干细胞功能,保护组织,减少损伤并促进组织功能的恢复[8]。有学者指出,EPO以剂量依赖性方式影响着细胞生长,当EPO浓度为20 U/mL时,细胞表现出最大的活性。因此,本研究观察低氧状态下对牙髓细胞保护的EPO浓度设定为20 U/mL,结果显示:无论在第24 h、48 h、72 h时实验组和对照组吸光度值,差异有统计学意义,说明适当浓度的EPO在低氧状态下能促进牙髓细胞的增殖,对低氧状态下的牙髓细胞有一定的保护作用。基质细胞衍生因子1(stromal cell derived factor-1,SDF-1)是一种具有趋化活性的细胞因子,CXCR4是其唯一受体。在牙髓损伤修复过程中,SDF-1/CXCR4轴起着关键作用。研究也表明,EPO可以通过SDF-1调控间充质干细胞的生长和迁移。EPO诱导牙髓细胞后能显著上调趋化因子CXCR4且SDF-1mRNA的表达水平,提示在缺氧状态下EPO可能通过SDF-1/CXCR4轴促进牙髓细胞的增殖。
EPO除了调节红细胞的生成外还具有多种生物学功能,但EPO对成骨分化的作用仍存在争议。有研究发现,EPO可以通过激活细胞微环境中的骨形态发生蛋白2(bone morphogenetic protein-2,BMP-2)释放来增强破骨细胞的形成。此外,EPO已显示在体外能够刺激间充质基质细胞向成骨细胞的分化[9-11],并增加了骨骼成骨细胞的形成和体内成骨细胞的数量[12],EPO在组织损伤时,也可以通过促进内皮细胞[13]趋化,将其募集到损伤部位,参与新生血管形成[14],并促进细胞的分化表现出更高的ALP活性,加快组织损伤修复。Runx2是负责激活成骨细胞分化标记基因,骨钙蛋白(osteocalcin,OCN)参与控制矿化过程,出现在分化的后期,其特征是成熟成骨细胞系的细胞。此外,osterix(也称为Sp7)是一种新型的含锌的成骨细胞特异性转录因子,对细胞的分化,增殖和骨形成至关重要。EPO调节许多成骨因子的表达,包括Runx2、骨连接蛋白、骨桥蛋白、骨钙素和ALP。Runx2、OCN和Osterix与间充质干细胞分化的多个步骤密切相关。EPO可以上调Runx2、OCN和Osterix在基因和蛋白质水平。同时EPO可以上调血管内皮生长因子(vascular endothelial growth factor,VEGF)[15]的表达,而VEGF的表达水平与牙髓间充质干细胞分化和修复性牙本质形成有关。本实验在低氧状态下以20 U/mL的EPO作为实验组作用于牙髓细胞,ALP结果显示:在24 h、48 h、72 h时,实验组吸光度与对照组差异无统计学意义。分析其原因可能是与药物作用时间太短、选择组数太少有关,使EPO对牙髓细胞分化作用不明显,有待于今后进一步的研究。
EPO是一种具有抗炎、抗细胞凋亡、抗氧化等多种生物学效应的细胞因子,在低氧环境下可诱导牙髓细胞EPO的表达,从而提高牙髓细胞对低氧的耐受力,减轻牙髓组织的损伤。因此,将EPO用于缺氧状态下保护牙髓细胞具有广阔的前景。
