血浆骨粘连蛋白水平影响因素的研究
2021-08-03吴乌德勒胡齐金新赵雅欣李冬梅
吴乌德勒胡,包 旭,齐金新,赵雅欣,李冬梅
(1.内蒙古自治区人民医院内分泌科,内蒙古 呼和浩特 010017;2.内蒙古科技大学包头医学院;3.内蒙古医科大学)
随着经济的发展,中国的城市化进程明显加快,同时人口老龄化的加速等原因,我国糖尿病患病率仍在上升,最新调查结果显示,18岁及以上人群糖尿病患病率为11.2%,其中以2型糖尿病(T2DM)为主,占90%以上。同时肥胖和超重人群糖尿病患病率显著增加,从体重指数(BMI)方面调查显示,25kg/m2≤BMI<30kg/m2者糖尿病患病率为13.8%,BMI≥30kg/m2者糖尿病患病率为20.1%[1]。近年来,骨粘连蛋白(osteonectin,ON)引起大家的极大关注,它与糖尿病和肥胖密切相关。ON最初被发现于骨骼,也被称为富含半胱氨酸的酸性分泌蛋白(secreted protein acidic and rich in cysteine,SPARC),也被称为BM-40。ON主要存在于细胞外基质,在胰岛、脂肪组织、肝脏和骨骼肌等多个组织中均有表达,是一种由多种细胞分泌的多功能糖蛋白,它还参与骨生成、血管形成、伤口愈合、肿瘤、肝肾纤维化和抑制脂肪生成等过程[2,3]。最近研究发现,属于糖代谢负调节因子的微小RNA-29(miR-29)家族通过抑制ON合成来抑制葡萄糖摄取,miR-29s/ON通路在糖代谢中起重要作用[4]。ON在ob/ob小鼠平滑肌组织中呈现高表达,可能参与了胰岛素抵抗与糖尿病及其并发的动脉粥样硬化的过程[5]。ON可增强骨骼肌AMPK依赖的葡萄糖摄取,可改善饮食诱导肥胖小鼠的糖耐量和胰岛素抵抗,以及对改善代谢紊乱有重要作用[6]。ON基因敲除小鼠表现出糖代谢异常,随着年龄的增长,脂肪组织的沉积也会增多,影响葡萄糖稳态[7]。较低的ON水平可能是健康肥胖的早期标志物[8]。肥胖者ON mRNA的表达高于非肥胖者,ON的表达受到脂肪含量、瘦素、血糖及胰岛素水平的影响[2]。
但是,目前对于血浆ON水平影响因素方面的报道相对较少。ON是一种分泌蛋白,多项研究表明ON与糖脂代谢密切相关,本研究通过动物实验和临床观察来探讨血浆ON水平的影响因素以及分析其分泌特点,为ON可能成为糖尿病和肥胖的治疗新靶点机制研究提供科学依据。
1 材料与方法
1.1 一般资料
1.1.1 基础研究对象实验采用雄性C57BL/6J小鼠,小鼠被安置在一个可控的环境中,自由饮水,并以高压灭菌的CE-2饮食(CLEA日本)作为食物喂养。用血糖仪Freestyle Freedom(日本大阪,Nipro)测量血糖浓度。
1.1.2 临床观察对象收集自2018-11~2020-11于内蒙古自治区人民医院内分泌科收治的2型糖尿病伴超重或肥胖病人36例,进行馒头餐试验。
1.2 方法
1.2.1 禁食试验采用8周龄雄性C57BL/6J小鼠,禁食前和禁食24h后分别测定体重、血糖、胰岛素和骨粘连蛋白水平。葡萄糖负荷试验:采用6周龄雄性C57BL/6J小鼠,禁食6h后,经口给予葡萄糖(2g/kg体重)或PBS缓冲液,并在灌糖后0、15、30、120 min分别测定血糖、胰岛素和骨粘连蛋白水平。胰岛素负荷试验:采用9周龄雄性C57BL/6J小鼠,腹腔注射人胰岛素(Humarin,Eli Lilly,Kobe,日本)(1U/kg体重)或PBS缓冲液。给药后0、20、40、60min分别测定血糖和骨粘连蛋白水平。
1.2.2 馒头餐试验选取36例T2DM伴超重或肥胖的患者,空腹状态下进食150g馒头,在餐前和餐后2h分别测定血糖、胰岛素及骨粘连蛋白水平。
1.3 统计学分析
采用学生t检验,所有数据均以平均值±标准差表示。检验水准为α=0.05,P<0.05说明组间差异存在统计学意义。
2 结果
2.1 禁食试验中骨粘连蛋白水平
在禁食试验中,与禁食前相比较,禁食后的体重显著下降[(23.64±1.13)g vs(19.93±0.92)g,P<0.05],血糖显著降低[(95.5±14.25)mg/dL vs(63.64±6.31)mg/dL,P<0.05],胰岛素水平显著降低[(746.7±333.49)pg/mL vs(228.4±200.12)pg/mL,P<0.05]。但是,血液中骨粘连蛋白水平无明显变化[(262.08±82.38)ng/mL vs(215.47±66.67)ng/mL,P>0.05](见图1)。
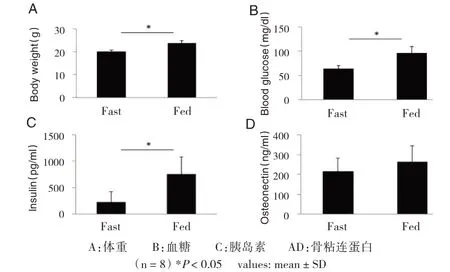
图1 禁食试验中骨粘连蛋白水平
2.2 葡萄糖负荷试验中骨粘连蛋白水平推移
在葡萄糖负荷试验中,与PBS缓冲液组小鼠相比较,葡萄糖负荷组小鼠的骨粘连蛋白水平无明显差异(见图2)。血糖变化:0min[(147.0±5.60)mg/dL vs(138.7±10.16)mg/dL,P>0.05],15min[(211.2±12.90)mg/dL vs(358.8±15.75)mg/dL,P<0.05],30min[(218.5±22.22)mg/dL vs(347.3±29.15)mg/dL,P<0.05),60min[(214.2±28.60)mg/dL vs(308.3±58.06)mg/dL,P<0.05],120min[(186.2±15.85)mg/dL vs(227.0±23.67)mg/dL,P<0.05];胰岛素变化:0min[(950.5±551.93)pg/mL vs(844.8±211.63)pg/mL,P>0.05],15min[(833.3±300.33)pg/mL vs(2080.9±474.01)pg/mL,P<0.05],30min[(849.0±323.72)pg/mL vs(1267.8±175.09)pg/mL,P<0.05],120min[(884.9±225.97)pg/mL vs(1015.4±193.94)pg/mL,P>0.05];骨粘连蛋白水平推移:0min[(106.1±40.52)ng/mL vs(115.5±23.34)ng/mL,P>0.05],15min[(122.5±31.73)ng/mL vs(122.6±24.74)ng/mL,P>0.05],30min[(119.8±29.70)ng/mL vs(115.7±19.07)ng/mL,P>0.05],120min[(105.5±29.09)ng/mL vs(116.5±23.72)ng/mL,P>0.05]。
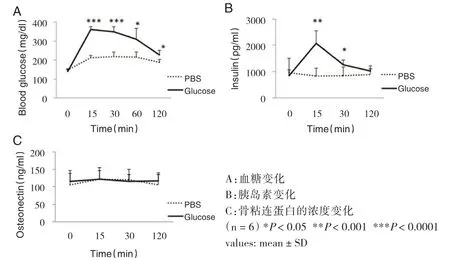
图2 葡萄糖负荷试验中骨粘连蛋白水平推移
2.3 胰岛素负荷试验中骨粘连蛋白水平推移
在胰岛素负荷试验中,与PBS缓冲液组小鼠相比较,胰岛素负荷组小鼠的骨粘连蛋白水平无明显差异(见图3)。血糖变化:0min[(91.8±4.34)mg/dL vs(101.7±12.33)mg/dL,P>0.05],20min[(140.5±12.50)mg/dL vs(61.3±6.69)mg/dL,P<0.05],40min[(164.8±23.63)mg/dL vs(70.9±4.94)mg/dL,P<0.05],60min[(199.0±12.66)mg/dL vs(88.4±9.33)mg/dL,P<0.05];骨粘连蛋白水平推移:0min[(168.6±72.99)ng/mL vs(188.6±61.77)ng/mL,P>0.05],20min[(143.5±74.38)ng/mL vs(211.8±71.48)ng/mL,P>0.05],40min[(206.8±62.50)ng/mL vs(220.5±89.06)ng/mL,P>0.05],60min[(236.6±110.18)ng/mL vs(254.6±73.85)ng/mL,P>0.05]。
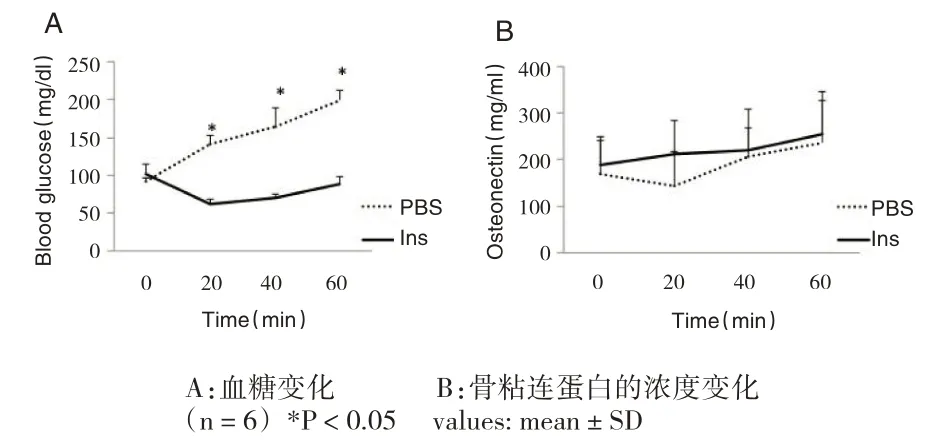
图3 胰岛素负荷试验中骨粘连蛋白水平
2.4 临床观察高碳水化合物刺激对骨粘连蛋白分泌水平的影响
在馒头餐试验中,比起餐前,餐后2h血糖显著升高[(8.8±2.17)mmol/L vs(15.2±4.0)mmol/L,P<0.05],胰岛素水平显著升高[(11.0±7.19)uU/mL vs(45.6±30.49)uU/mL,P<0.05]。但血液中骨粘连蛋白水平无明显差异[(93.1±30.81)ng/mL vs(97.9±29.49)ng/mL,P>0.05](见图4)。
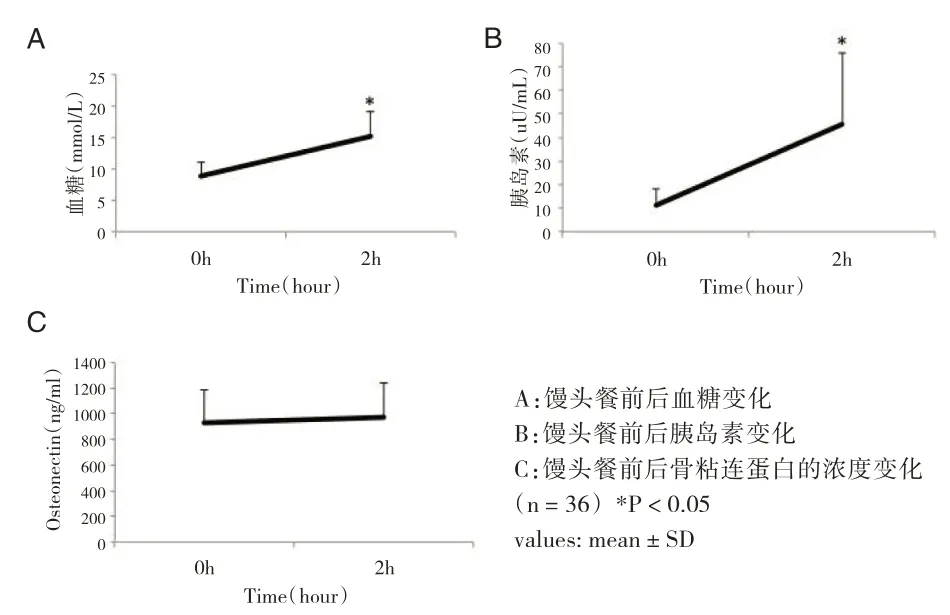
图4 馒头餐试验中骨粘连蛋白水平变化
3 讨论
本研究通过动物实验和临床研究,在饥饿试验、高糖及胰岛素刺激下评估了血浆ON浓度变化,结果无论在小鼠还是在人体,刺激前后的血浆ON水平均未见明显变化。有研究报道,急性极限运动刺激后,血清ON水平同样没有显著变化,这与我们的研究结果是一致的[9]。
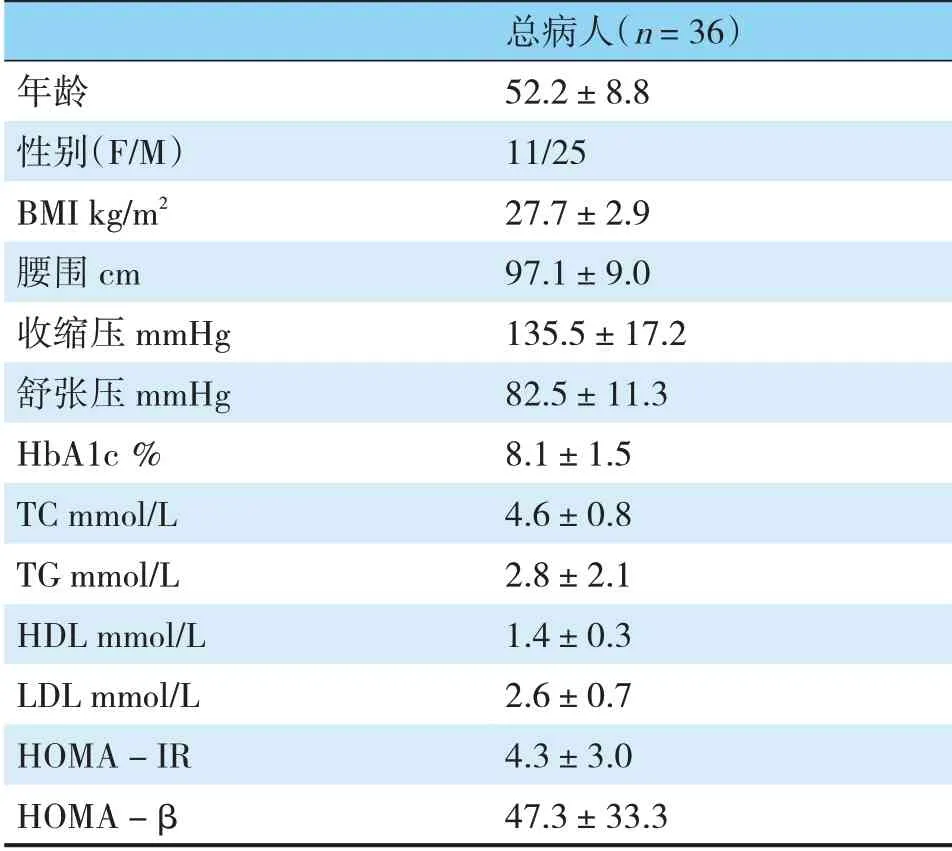
表1 2型糖尿病患者基本情况
ON与糖尿病以及胰岛素分泌密切相关。链脲佐菌素(STZ)诱导的糖尿病大鼠β细胞功能失调而胰岛素的分泌减少,其ON在胰腺中表达显著下调[10]。在人的胰岛中观察ON表达与葡萄糖刺激胰岛素分泌(GSIS)的关系,发现糖尿病患者ON的表达减低,ON的表达与GSIS呈正相关。此外,在人工培养的胰岛β细胞(INS-1)中,ON的过度表达导致葡萄糖刺激下的胰岛素分泌比对照细胞增加2.4倍。研究指出,ON的这种调节作用涉及WNT信号通路和参与β细胞变化的若干相关基因[11]。ON的缺乏降低了胰岛β细胞胰岛素的表达和葡萄糖刺激的胰岛素分泌,这种情况在高脂饮食喂养的动物中更为显著,ON是调节胰岛素表达和分泌所必需的[7]。在β细胞中,G蛋白信号调节因子4(RGS4)通过调节M3受体G蛋白偶联调节胰岛素分泌,是已知的胰岛素分泌的负调节因子,ON通过下调RGS4的表达来调节胰岛素分泌[12]。ON在胰岛素分泌和保持胰岛β细胞功能上具有潜在的调节作用。
ON是一种分泌蛋白,分泌蛋白一般有两种途径从细胞中分泌,也就是调节型分泌途径和组成型分泌途径[13]。众所周知,胰岛素的分泌是通过调节型分泌途径完成的,胰岛素原从内质网移动到高尔基体区域,随后不久被包装成分泌颗粒,然后转化为胰岛素,在葡萄糖刺激下分泌到细胞外[14]。ON在细胞质合成后进入高尔基体,在信号肽的引导下分泌到细胞外。研究发现,胰腺基质细胞中ON的表达受胰岛素和葡萄糖的调节[15]。胰岛素和瘦素作用下可增加脂肪组织中ON的表达[2]。但我们的研究结果显示,血浆ON水平在短时间内不受葡萄糖和胰岛素刺激的影响。
综上所述,ON参与调节胰岛素分泌,其表达和分泌也受胰岛素等代谢指标的影响,但血浆ON水平在短时间内不受代谢参数以及饥饿应激的影响,其分泌特点不同于胰岛素分泌途径,是以组成型分泌途径分泌到细胞外。本研究在ON与糖尿病和肥胖相关机制研究提供科学依据。
