miR-145 对 TNF-α 诱导人关节软骨细胞增殖、凋亡及炎症反应的影响
2021-08-02阿布都艾尼热吾提肖伟周文正车立新徐江波孙俊刚
阿布都艾尼·热吾提 肖伟 周文正 车立新 徐江波 孙俊刚
骨关节炎(osteoarthritis,OA) 是一种常见的慢性退行性关节疾病,其特征是关节软骨、滑膜与软骨下骨的炎症改变[1-2]。OA 的病因十分复杂,包括关节损伤、遗传、肥胖、衰老和炎症等,其确切的发病机制仍不十分清楚[3]。软骨细胞是关节软骨中的特有细胞,合成由 Ⅱ 型胶原蛋白和蛋白聚糖组成的细胞外基质(extracellular matrix,ECM),并且在维持 ECM 代谢和分解之间的动态平衡方面起着关键作用[4]。研究发现,软骨细胞的增殖与凋亡异常均与 OA 发生发展密切相关[5]。微小 RNA(microRNA,miRNA) 是一类小、非编码 RNA 分子,长度约 20~22 个核苷酸,通过与 3’-非翻译区(untranslated region,UTR) 相互作用来调节转录后水平的基因表达[6]。随着越来越多的 miRNA 被发现,其在 OA 中的生物学功能受到极大的关注,并可能成为 OA 新的诊断标志物和分子治疗靶点[7]。miR-145 是当前研究最多的 miRNA 之一,其在生物发育、肿瘤形成及炎症反应中均具有重要作用[8-10]。研究显示,miR-145 对于维持血管平滑肌细胞的分化状态和调节胚胎干细胞的自我更新十分重要[11]。此外,miRNA 表达谱芯片数据表明,miR-145 在 OA 软骨细胞中的表达水平明显下调[12]。目前关于 miR-145 在 OA 中的生物学作用尚不清楚。本研究通过建立不同浓度肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α) 诱导人关节软骨细胞模型,观察 miR-145 对细胞增殖、凋亡及炎症反应的影响,旨在为 OA 防治提供新的方向与思路。
材料与方法
一、方法
1.细胞培养:人关节软骨细胞系(C-20 / A4 和 CH8) 购自中科院上海细胞库。所有细胞均放置于 37 ℃ 含 5% CO2的细胞培养箱(Bio-Rad 公司,美国) 中培养,给予充足的杜氏改良 eagle 培养基(dulbecco’s modified eagle medium,DMEM),并添加10% 胎牛血清(fetal bovine serum,FBS)、100 U / ml 青霉素和 100 μg / ml 链霉素(Sigma,美国)。
2.TNF-α 诱导软骨细胞:选取生长状态良好的 C-20 / A4 和 CH8 细胞按照 7×106个 / 孔接种至 6 孔板,培养过夜后,分别将 0、5、10、15 及 30 ng / ml TNF-α(Thermo Fisher Scientific 公司,美国) 添加至各孔细胞中,每组设置 2 个复孔,继续放置培养箱中培养 48 h,之后按照要求收集细胞进行炎症因子浓度检测。
3.细胞转染:取 30 ng / ml TNF-α 诱导的 C-20 / A4 和 CH8 细胞按照 3×104个 / 孔接种至 24 孔板,培养过夜后,待融合度达到 80% 时采用 lipofectamine 2000 试剂(Thermo Fisher Scientific 公司,美国) 转染 miR-145 模拟物(mimics) 及模拟物对照(mimics control)(苏州吉玛基因股份有限公司) 至各孔细胞中,每组设置 2 个复孔,继续放置培养箱中孵育 48 h,之后收集细胞检测转染效率。
4.噻唑蓝比色法 [ 3-(4,5-dimethyl-2-thiazolyl)-2,5-diphenyl-2-H-tetrazolium bromide,MTT ]:取转染后的 C-20 / A4 和 CH8 细胞按照 5×103个 / 孔接种至 96 孔板,放置培养箱中培养 0、24、48 和 72 h 后,向每个孔中添加 12 μl MTT(5 mg / ml),继续孵育 3~4 h 后去上清,每孔加入 150 μl 二甲亚砜溶解结晶。在 SAF-680T 酶标仪(上海巴玖实业有限公司) 上选择 490 nm 波长,测定各孔光吸收值,以培养时间为横坐标,吸光度值为纵坐标绘制细胞生长曲线。
5.实时荧光定量聚合酶链反应(quantitative real-time PCR,qRT-PCR):按照 Trizol 试剂盒(Thermo Fisher Scientific 公司,美国) 步骤提取样本总 RNA。采用紫外分光光度计(上海谱元仪器有限公司) 测定 RNA 浓度,并进行反转录试验合成互补脱氧核糖核酸(complementary DNA, cDNA)。按照 SYBR® Premix EX TaqTM Ⅱ PCR Kit 试剂盒(Takara 公司,日本) 步骤以合成的 cDNA 作为模版在 LightCycler480 实时荧光定量 PCR 仪(Roche 公司,瑞士) 上进行荧光定量 PCR 反应。反应总体系为:cDNA 模版 1 μl,Premix Mix 10 μl,上下游引物各 0.5 μl,无 RNA 酶去离子水 8 μl。反应条件为:95 ℃ 10 min,随后 98 ℃ 10 s,58 ℃ 30 s,72 ℃ 30 s,共 40 个循环。引物购自上海生工生物工程有限公司。人 miR-145 上游引物:5’-CAGTGCGTGTCGTGGAGT-3’,下游引物:5’-AGGTCCAGTTTTCCCAGG-3’;人 U6 上游引物:5’-GCTTCGGCAGCACATATACTAAAAT-3’,下游引物:5’-CGCTTCACGAATTTGCGTGTCAT-3’。
6.酶联免疫吸附剂测定(enzyme-linked immunosorbnent assay,ELISA):收集转染后的 C-20 / A4 和 CH8 细胞,根据白介素-1β(interleukin-1β,IL-1β)、IL-6 和 IL-13 ELISA 试剂盒(Proteintech 公司,美国) 步骤裂解细胞、静置 30 min、离心,留取上层血清。采用酶标仪测定吸光度并计算炎症因子浓度。
7.蛋白质印迹:收集转染后的 C-20 / A4 和 CH8 细胞,加入 150 µl 放射免疫沉淀测定(radio immunoprecipitation assay,RIPA) 裂解液连同 1.5 µl 蛋白酶抑制剂,冰上孵育 30 min,4 ℃,13 000 g, 离心 30 min,获取总蛋白。通过 12% 十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE) 分离总蛋白,每孔上样为 30 µg,并转移到聚偏二氟乙烯膜上。将膜用 5% 脱脂牛奶在 37 ℃ 下封闭 2 h,并与抗胱天蛋白酶 3(caspase 3,CASP3)、cleaved CASP3 及 BAX 抗体(Abcam 公司,美国)(均 1∶1000 稀释) 在 4 ℃ 下孵育过夜。采用 0.1% Tween-20 / TBS 缓冲液中洗涤 3 次后,将膜与抗鼠辣根过氧化物酶共轭的二抗(Abcam 公司,美国)(1∶2000 稀释) 在 37 ℃ 下孵育 1 h。甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH) 蛋白用作内参对照。采用增强化学发光法(enhanced chemiluminecence,ECL) 检测蛋白条带。
二、统计学处理
采用 SPSS 22.0 软件进行统计学分析。数据采用x-±s表示。统计分析采用 Student’st或 ANOVA 检验。P< 0.05 为差异有统计学意义。
结 果
一、不同浓度 TNF-α 诱导人关节软骨细胞中炎症因子及 miR-145 的表达水平分析
利用 0、5、10、15 及 30 ng / ml TNF-α 诱导人 C-20 / A4 和 CH8 关节软骨细胞 48 h,细胞形态学如图 1a 所示,随着 TNF-α 诱导浓度的提高,凋亡细胞明显增多。ELISA 结果显示,随着 TNF-α 诱导浓度的提高,C-20 / A4 和 CH8 细胞中炎症因子 IL-1β、IL-6 及 IL-13 的浓度呈剂量依赖性升高(P< 0.05)(图 1b)。qRT-PCR 结果显示,C-20 / A4 和 CH8 细胞中 miR-145 的表达水平呈剂量依赖性降低(P< 0.05)(图 1c)。

图1 不同浓度 TNF-α 诱导人关节软骨细胞中炎症因子及 miR-145 的表达水平分析 a:细胞培养图;b:炎症因子;c:miR-145。*P < 0.05Fig.1 Analysis of the expression level of inflammatory factors and miR-145 in human articular chondrocytes induced by different concentrations of TNF-α a: Images of cell culture; b: Inflammatory factors; c: miR-145.*P < 0.05
二、miR-145 mimics 转染效率分析
qRT-PCR 结果显示,与 mimics control 组相比较,miR-145 mimics 显著提高 C-20 / A4 和 CH8 细胞中 miR-145 的表达水平(P< 0.05)(图 2)。

图2 miR-145 mimics 对 TNF-α 诱导人关节软骨细胞中 miR-145 表达水平的影响。*P < 0.05Fig.2 The effect of miR-145 mimics on the expression of miR-145 in human articular chondrocytes induced by TNF-α.*P < 0.05
三、过表达 miR-145 对 TNF-α 诱导人关节软骨细胞增殖及凋亡的影响
MTT 结果显示,与 mimics control 组相比较,miR-145 mimics 显著降低 C-20 / A4 和 CH8 细胞的增殖能力(P< 0.05)(图 3a)。蛋白质印迹结果显示,与 mimics control 组相比较,miR-145 mimics 显著增加 CASP3、cleaved CASP3 及 BAX 的蛋白表达水平(P< 0.05)(图 3b)。
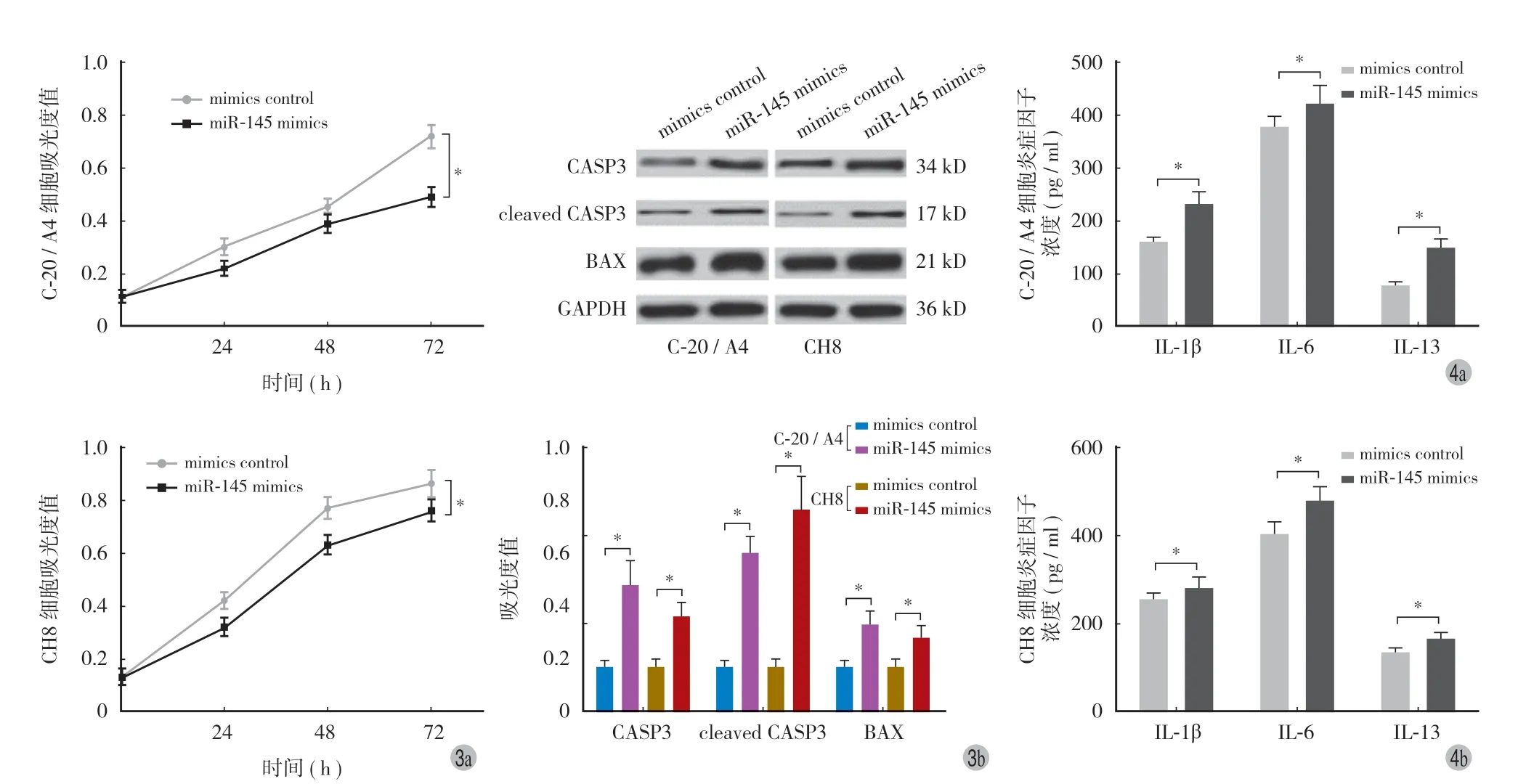
图3 过表达 miR-145 对 TNF-α 诱导人关节软骨细胞增殖与凋亡的影响 a:细胞生长曲线;b:凋亡相关蛋白的表达水平。*P < 0.05图4 过表达 miR-145 对 TNF-α 诱导人关节软骨细胞炎症反应的影响 a:C-20 / A4;b:CH8。*P < 0.05Fig.3 The effect of over-expression of miR-145 on the proliferation and apoptosis of human articular chondrocytes induced by TNF-α a: Cell growth curves; b: Apoptosis-related protein expression level.*P < 0.05Fig.4 The effect of over-expression of miR-145 on inflammatory response in human articular chondrocytes induced by TNF-α a: C-20 / A4; b: CH8.*P < 0.05
四、过表达 miR-145 对 TNF-α 诱导人关节软骨细胞炎症反应的影响
ELISA 结果显示,C-20 / A4 和 CH8 细胞转染 miR-145 mimics 后炎症因子 IL-1β、IL-6 及 IL-13 的浓度显著高于 mimics control 组(P< 0.05)(图 4)。
讨论
OA 是一类由于关节软骨基质的代谢平衡被打破,继而引发关节产生退行性病变的慢性运动系统疾病。据最新统计,我国 65岁以上的老年人中约 80% 患有 OA。OA 可导致关节疼痛、僵硬、变形,甚至活动能力丧失,从而严重影响患者的日常生 活[13]。尽管目前临床上有多种方法治疗 OA,包括药物、针灸、电磁、干细胞及手术等,但临床疗效仍然难令人满意[14]。因此,有必要深入探索 OA 的发病机制以指导临床诊治。miRNA 是内源性非编码 RNA,在 RNA 稳定性和蛋白质表达的负调控中起着重要的作用[6]。研究发现,一部分 miRNA 在 OA 中表达异常并参与对关节软骨细胞增殖、凋亡、自噬及炎症反应的调控作用[15]。例如,Zhao 等[16]研究发现,miR-107 通过靶向肿瘤坏死因子受体相关因子 3(TNF receptor-associated factor 3,TRAF3) 调节 OA 软骨细胞的凋亡和自噬,并可能被用作 OA 治疗的潜在靶点。Zhong 等[17]研究报道,miR-335-5p 通过激活自噬缓解 OA 软骨细胞的炎症反应。Wu 等[18]研究显示,miR-181 通过靶向 10 号染色体缺失的磷酸酶及张力蛋白同源物(phosphatase and tensin homolog deleted on chromosome ten,PTEN) 上调 CASP3,聚腺苷酸二磷酸核糖转移酶 [ poly(ADP-ribose) polymerase,PARP ],基质金属蛋白酶-2(matrix metallopeptidase-2,MMP-2) 和 MMP-9 的表达,从而抑制 OA 软骨细胞增殖并促进凋亡。此外,Yu 等[19]研究发现,miR-19a 通过 NF-κB 信号通路正调控性别决定区 Y 框蛋白 9(SRY-box transcription factor 9,SOX9) 促进软骨细胞的生存和迁移。因此,鉴定与软骨细胞中相关的 miRNA 对进一步阐明 OA 发生发展的分子机制具有重要的理论价值,亦将为该病的治疗提供新的思路。
miR-145 定位于人第 5 号染色体长臂 3 区 2 带。众所周知,miR-145 是一种抑癌基因,过表达 miR-145 可抑制癌细胞增殖并诱导凋亡[8]。例如,miR-145 通过调节 BAX 和 CASP3 表达抑制非小细胞肺癌增殖[20]。miR-145 靶向调控性别决定区 Y 框蛋白 11(SRY-box transcription factor 11,SOX11) 表达抑制子宫内膜癌细胞增殖[21]。miR-145 负调节转化生长因子-β1(transforming growth factor-β1,TGF-β1) 表达降低乳腺癌生长并促进凋亡[22]。目前,关于 miR-145 在 OA 发生发展中的作用尚缺乏系统的研究。本研究通过建立 TNF-α 诱导人关节软骨细胞模型,发现随着 TNF-α 诱导浓度的提高,C-20 / A4 和 CH8 细胞中炎症因子包括 IL-1β、IL-6 及 IL-13 的表达水平呈剂量依赖性升高。该结果结合细胞形态学改变,提示 TNF-α 诱导人关节软骨细胞建立 OA 体外模型是成功可靠的。有趣的是,笔者还发现 miR-145 的表达水平呈剂量依赖性降低。鉴于 miR-145 在对癌细胞增殖与凋亡中的调控作用,因此笔者推测 miR-145 在 OA 软骨细胞可能具有相似的功能。
由于 30 ng / ml TNF-α 诱导 C-20 / A4 和 CH8 细胞中 miR-145 的表达量最低,于是选择该剂量作为后续实验的主要模型。为了进一步证实推测,笔者通过瞬时转染 miR-145 mimics 至 30 ng / ml TNF-α 诱导人关节软骨细胞,并采用 MTT 和蛋白质印迹观察细胞增殖与凋亡的变化。结果发现,过表达 miR-145 抑制 C-20 / A4 和 CH8 细胞增殖并诱导凋亡,表现为 CASP3、cleaved CASP3 及 BAX 的蛋白表达水平增加。该结果与 miR-145 在癌细胞中的作用一致,提示 miR-145 通过调控人关节软骨细胞增殖与凋亡影响 OA 进展。然而最近 Hu 等[23]一项研究发现 miR-145 对 TNF-α 诱导大鼠关节软骨细胞增殖没有明显影响,笔者认为引起这种差异的主要原因为细胞系不同所致。研究发现,炎症反应与 OA 发生密切相关并影响疾病的进展[24]。OA 软骨细胞中炎症因子如 IL-1β、IL-6 及 IL-13 表达升高,并与疾病疼痛程度相关[25]。目前,已报道了几种 miRNA 在 OA 抗感染中发挥重要作用,如 miR-27a[26]、 miR-93[27]及 miR-142-3p[28]。为了检测 miR-145 对 OA 炎症反应的影响,笔者采用 ELISA 观察转染 miR-145 mimics 后 TNF-α 诱导人关节软骨细胞中炎症因子的浓度变化。结果显示,过表达 miR-145 促进 C-20 / A4 和 CH8 细胞炎症反应,表现为 IL-1β、IL-6 及 IL-13 浓度升高。该结果提示,miR-145 可调控人关节软骨细胞炎症反应而影响 OA 进展。
综上所述,本研究观察到 miR-145 在 TNF-α 诱导的人关节软骨细胞中呈剂量依赖性下调,并初步揭示体外过表达 miR-145 抑制 TNF-α 诱导的人关节软骨细胞增殖,促进凋亡及炎症反应,提示 miR-145 可能被用作 OA 治疗的潜在分子靶点。
