微小核糖核酸-29b通过靶向髓样细胞白血病-1影响脑缺血/再灌注损伤时神经细胞凋亡
2021-07-31王黎洲
陈 浩, 黄 智, 张 帅, 王黎洲, 周 石
缺血性脑卒中是全球最严重的神经系统疾病之一,现阶段除了早期溶栓、取栓等介入治疗外,尚无其他更有效的治疗手段。然而介入治疗后血管再通的同时,可能发生脑缺血/再灌注(I/R)损伤[1-3],是影响脑卒中预后的重要环节。因此寻找新的有效措施预防脑I/R损伤具有重要意义。微小核糖核酸(microRNA,miRNA,miR)是通过靶向调节信使RNA(mRNA)稳定性和/或转化效率执行转录和转录后负调控功能的小片段(18~25 nt)单链非编码RNA分子[4]。研究证实最成熟的miRNA通过结合3’非编码区改变靶向mRNA降解或翻译[5-6]。既往研究显示miR-29b、miR-21、miR-200和miR-497似可作为潜在治疗靶点,通过改变大脑皮层中通常高表达的关键信号元件参与脑I/R损伤[7]。miR-29b也可能负调控B淋巴细胞瘤(BCL)-2家族成员,如BCL-W(BCL-2L2)和髓样细胞白血病(MCL)-1等促生存蛋白。这些蛋白是脑I/R损伤的重要调节因子,其作用机制尚不清楚[8-10]。本研究旨在确定miR-29b是否对体外脑I/R损伤具有保护作用,并探讨其潜在作用机制,以期为改善其临床疗效提供新策略。
1 材料与方法
1.1 实验细胞和主要试剂
小鼠成神经细胞瘤(N2a)细胞(中国科学院上海分院),miR-29b模拟物、抑制剂及相应对照组序列(广州锐博生物科技公司),LipofectamineTM 3000试剂(美国Invitrogen公司),细胞计数试剂盒(CCK)-8(日本同仁化学研究所),膜联蛋白(annexin)Ⅴ/碘化丙啶(PI)凋亡试剂盒(杭州联科生物科技公司),TRIzol试剂(美国Thermo Fisher公司),抗小鼠多克隆MCL-1抗体(1∶2 000)(美国Sigma公司),抗小鼠多克隆BCL-2抗体(1∶1 000)、抗小鼠多克隆半胱氨酸天冬氨酸特异性蛋白酶(caspase)-3抗体(1∶1 000)(英国Abcam公司),抗小鼠多克隆3-磷酸甘油醛脱氢酶(GAPDH)抗体(1∶1 000)(美国Santa Cruz生物技术公司),化学发光试剂(美国Merck Millipore公司),psiCheckTM2载体(美国Invitrogen公司),限制性内切酶(生工生物工程上海公司),7500 Fast实时聚合酶链反应(PCR)系统PCR仪(美国Thermo Fisher公司),KO-PLUS诱变试剂盒(美国Santa Cruz生物技术公司)。
1.2 氧糖剥夺/复氧模型建立和实验分组
37℃、5%CO2、95%O2湿润空气条件下,N2a细胞置于加入10%胎牛血清(美国Hyclone公司)和1%青霉素/链霉素(美国Mediatech公司)的高糖Dulbecco改良伊格尔培养基(DMEM)(美国HyClone公司)中培养;N2a细胞置于脱氧无糖DMEM(美国HyClone公司)进行氧糖剥夺(OGD)处理,缺氧条件(5%CO2、1%O2、94%N2)下培养4 h;置于含葡萄糖DMEM,正常培养条件(5%CO2、95%O2)下于12 h进行复氧(R)处理。体外OGD/R模型建立并分为6组:空白对照组(control)、OGD/R组(OGD/R)、OGD/R+转染miR-29b模拟物组(mimics)、OGD/R+转染miR-29b抑制剂组(inhibitor)、OGD/R+转染miR-29b模拟物阴性对照组(mimics NC)、OGD/R+转染miR-29b抑制剂阴性对照组(inhibitor NC)。
1.3 miRNA模拟转染和实验分组
miR-29b模拟物、miR-29b抑制剂、模拟物NC、抑制剂NC引物序列见表1。按2×105细胞将miR-29b模拟各组N2a细胞培养于6孔板中,分别用LipofectamineTM3000试剂转染200μL成熟miR-29b模拟物、miR-29b抑制剂、模拟物NC、抑制剂NC 24 h,并相应分为4组。

表1 miRNA引物序列
1.4 细胞活力检测
上述4组序列转染后,在96孔板每孔中加入100μL CCK-8溶液,培养箱中孵育1 h;酶标仪测量450 nm处吸光度。
1.5 细胞凋亡检测
采用annexinⅤ/PI凋亡试剂盒定量检测凋亡细胞。收集4组N2a细胞,磷酸盐缓冲液(PBS)冲洗,置于含5μL annexinⅤ(10 g/mL)的200μL结合缓冲液中重新悬浮,暗室中静置10 min;置于10μL PI(20 g/mL)中孵育;流式细胞仪(美国Beckman公司)检测细胞凋亡,CellQuestTM软件(美国BDBiosciences公司)进行数据采集和分析。
1.6 蛋白分离和免疫印迹分析
常规方法对4组样本2×l06N2a细胞裂解后,提取总蛋白,进行免疫印迹分析。主要抗体为抗小鼠多克隆MCL-1抗体(1∶20 000)、BCL-2抗体(1∶1 000)、caspase-3抗体(1∶1 000)、GAPDH抗体(1∶1 000)。采用化学发光试剂和LAS4000发光成像分析仪(美国GE Healthcare公司)观察蛋白印迹。
1.7 实时定量PCR检测
根据TRIzol试剂使用说明,从细胞中提取总RNA,NanoDrop 1000分光光度计(美国Thermo Fisher公司)进行RNA定量;根据Bestar qPCR RT试剂盒(德国DBI Bioscience公司)使用说明,对每个样本1μg总RNA行逆转录,96孔板和7500 Fast PCR仪行实时定量PCR检测。每20μL PCR反应体系包括1μL逆转录产物(1∶5)、0.5μL有义引物、0.5μL通用逆转录引物、10μL混合缓冲液(Bestar Sybr-Green qPCR master mix),加双蒸水至20μL。反应条件为94℃,反应2 min,94℃和58℃循环20 s,循环40次,72℃反应20 s,所有反应重复3次。引物序列见表2。

表2 miR-29b引物序列
1.8 重组质粒结构和双荧光素酶检测
从GenBank数据库中检索小鼠MCL-1 mRNA(NM_000286)3'非翻译区(UTR)并应用合成引物:MCL-1正向5'GCTAGCCGCTACTAGGCTCCCC3',反向5'CGGGTAGTATATACGCGTCGTTAC3'扩增。将产物克隆至psiCheckTM2载体,重组载体扩增至重组大肠杆菌DH5α,并用无内毒素质粒纯化试剂盒纯化。每片段分别用Takara LA Taq(日本TaKaRa生物公司)PCR扩增并克隆至载体。采用KO-PLUS诱变试剂盒使MCL-1 3'UTR序列中miR-29b结合位点突变。所有构建物均经限制性内切酶(上海生工生物工程公司)消化测序。
N2a细胞在6孔板上接种密度为1.0×105细胞/mL,次日可达到50%覆盖。miR-29b转染24 h,用上述LipofectamineTM3000转染psiCheckTM2-MCL-1-3'UTR-wt/-mut质粒(美国Invitrogen公司),再孵育24 h;收集细胞,测定荧光素酶活性,通过双荧光素酶报告器(美国Promega公司)和微孔板阅读器(美国Biotek公司)标准化荧光素酶活性。处理后的细胞样本与对照细胞样本的发光率,均给予3个独立样本转染的均值±标准差。
1.9 数据分析
实时定量PCR数据分析中,以相对定量法测定目标miRNA表达量变化。用U6 RNA对表达进行标准化,并测定扩增后变化。每个样本折叠变化用2-ΔΔCq表达式计算法,ΔΔCq=(Cq目标基因-CqU6)PIH-(Cq目标基因-CqU6)对照。值2-ΔΔCq>1.5或<0.67考虑miRNA差异表达。t检验评估实时定量PCR检测的miRNA表达差异。采用SPSS 17.0软件分析其他实验数据。各组间miRNA log10转换相对数量比较用单因素方差分析,其基因间差异评价用Post-Hoc检验。P<0.05为差异有统计学意义。
2 结果
2.1 miR-29b与MCL-1相互作用
双荧光素酶实验显示,与psiCheckTM2-MCL-1-3'UTR-mut转染细胞相比,miR-29b模拟物和psiCheckTM2-MCL-1-3'UTR-wt处理后N2a细胞中荧光素酶活性降低(图1);结果表明miR-29b通过与MCL-1的3'UTR端结合下调MCL-1表达。

图1 N2a细胞中转染miR-29b模拟物与MCL-1 3'UTR端潜在miR-29b结合片段的相互作用
2.2 miR-29b模拟物和抑制剂在N2a细胞中的作用
转染24 h后,OGD/R组miR-29b水平与control组相比明显升高,mimics组升高更明显,inhibitor组升高不明显(图2)。
2.3 miR-29b模拟物和抑制剂对细胞活力的影响
OGD/R组细胞存活率与control组相比明显降低,mimics组降低更加明显(P<0.01),inhibitor组与control组无明显差别;表明OGD/R环境下miR-29b模拟物抑制N2a细胞活力,miR-29b抑制剂促进N2a细胞存活(图3)。
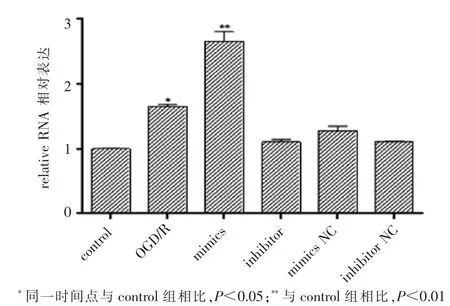
图2 miR-29b模拟物和抑制剂在N2a细胞中的作用
2.4 miR-29b模拟物和抑制剂对细胞凋亡的影响
mimics组细胞凋亡发生与control组相比显著升高,inhibitor组与mimics组相比细胞凋亡较少(图4);表明OGD/R环境下miR-29b模拟物促进神经细胞凋亡,miR-29b抑制剂抑制神经细胞凋亡。

图3 miR-29b模拟物和抑制剂对N2a细胞活力的影响

图4 miR-29b模拟物和抑制剂对细胞凋亡的影响
2.5 miR-29b模拟物和抑制剂对凋亡蛋白的影响
OGD/R组细胞中BCL-2、MCL-1表达水平与control组相比均明显下调,caspase-3明显上调,mimics组BCL-2、MCL-1表达进一步受抑,但在inhibitor组明显上调,caspase-3表达明显下调;表明OGD/R环境下miR-29b下调MCL-1、BCL-2表达,同时上调caspase-3表达(图5)。
3 讨论
研究表明脑I/R损伤是影响脑卒中预后的重要环节,OGD/R环境下神经细胞凋亡明显增加[11-12]。本实验研究结果与之一致。然而OGD/R环境下神经细胞凋亡机制不甚明确[12]。许多研究表明,miRNA在脑I/R损伤中起关键作用[13-14]。miR-29b是否有促进细胞凋亡的作用尚不明确[15]。本研究结果表明,脑I/R过程中miR-29b表达明显升高,且下调抗凋亡蛋白MCL-1、BCL-2表达,上调凋亡蛋白caspase-3表达,促进神经细胞凋亡,但miR-29b促进神经细胞凋亡的具体机制仍不清楚。miR-29b可直接与MCL-1 3’UTR端结合下调MCL-1表达,因此推断miR-29b通过靶向下调MCL-1表达促进脑I/R时神经细胞凋亡。

图5 miR-29b模拟物和抑制物对N2a细胞凋亡相关蛋白的影响
以往大量研究关注miR-29b对肿瘤的调控作用。然而miR-29b在OGD/R环境下和脑I/R损伤患者神经细胞中也显著上调[7,16]。有研究显示,激活的miR-29b在神经元成熟过程中通过靶向BH3蛋白表达促进神经细胞凋亡[17]。本实验研究表明miR-29可与MCL-1蛋白3'UTR端结合,这与既往研究结果一致。BCL-2家族可分为抗凋亡因子或促凋亡因子,它们通过改变线粒体膜完整性和功能发挥作用,也影响凋亡信号转导通路。BCL-2家族由3个亚群组成:①促生存蛋白,如BCL-2、BCL-xl(BCL-2L1)、BCL-w(BCL-2L2)、MCL-1和A1;②多域促凋亡蛋白,如BAX和BAK;③BH3域促凋亡蛋白,如BIM、PUMA(BBC3)、BID、BAD、BIK、BMF、HRK和NOXA(PMAIP1)[18-20]。MCL-1是BCL-2家族中重要的抗凋亡蛋白,抑制MCL-1可通过线粒体途径促进细胞死亡;MCL-1还参与脑I/R损伤过程中神经细胞凋亡[21]。因此,本研究考虑miR-29b与MCL-1间相互作用,是神经细胞凋亡过程中关键因素之一。Shi等[22]研究也表明,一些miRNA直接针对BCL-2家族蛋白3'UTR端,如miR-15b在永久性大脑中动脉闭塞(MCAO)后高表达,可能直接针对BCL-2。miR-491-5p也被认为可结合BCL-xl(BCL-2L1)mRNA,这是BCL-2家族中抗凋亡成员之一[23]。此外,miR-29b上调通过抑制缺血后脑损伤BCL-2L2蛋白促进神经元细胞凋亡[24]。许多化疗药物通过下调肿瘤细胞中MCL-1表达诱导细胞凋亡,本中心既往研究结果表明靶向miR-29b也可能通过抑制MCL-1表达成为脑I/R损伤的治疗靶点[25]。本研究再次证实该结果。
本研究在蛋白质和组织学水平证实本中心最初假设,即miR-29b通过靶向MCL-1促进脑I/R损伤过程中神经细胞凋亡。然而本研究也有一定局限性,如实验数据是在体外环境中应用miR-29b模拟物所获得,可能不能准确反映体内效应。本中心计划在MCAO动物模型中进一步实验探索脑I/R损伤与miR-29b抑制剂或MCL-1过表达间的治疗关系。此外,需要进一步实验验证miR-29b在脑I/R损伤中靶向MCL-1的神经损伤和神经保护作用,探讨miR-29b在脑I/R损伤时神经元细胞中的功能和机制,以期为缺血性脑卒中患者开发出新的治疗靶点。
