椎间盘退变的基因治疗研究进展
2021-07-31李海峰阮狄克
李 勇,沈 超,李海峰,阮狄克
椎间盘退变(Intervertebral Disc Degeneration,IDD)是一系列脊柱退行性疾病的病理学基础,包括腰腿痛、颈椎病、椎管狭窄、椎间盘突出症等疾病[1-2]。临床上高达40%的下腰痛被认为主要是由IDD 引起的,尽管国内外学者对IDD 的治疗进行了广泛而深入的研究[3-4],但目前对于椎间盘源性背痛的治疗仍然极具挑战性[5]。1997 年日本Nishida 首先开展了IDD基因治疗实验研究[6]。虽然在基因载体的安全性和表达调控方面仍有许多问题需要进一步解决,但是基因治疗为IDD的治疗提供了一种新的思路和方法,并在近年取得显著的进步,表1。因此,依据近期发表的文献,将IDD 的基因治疗进展综述如下。
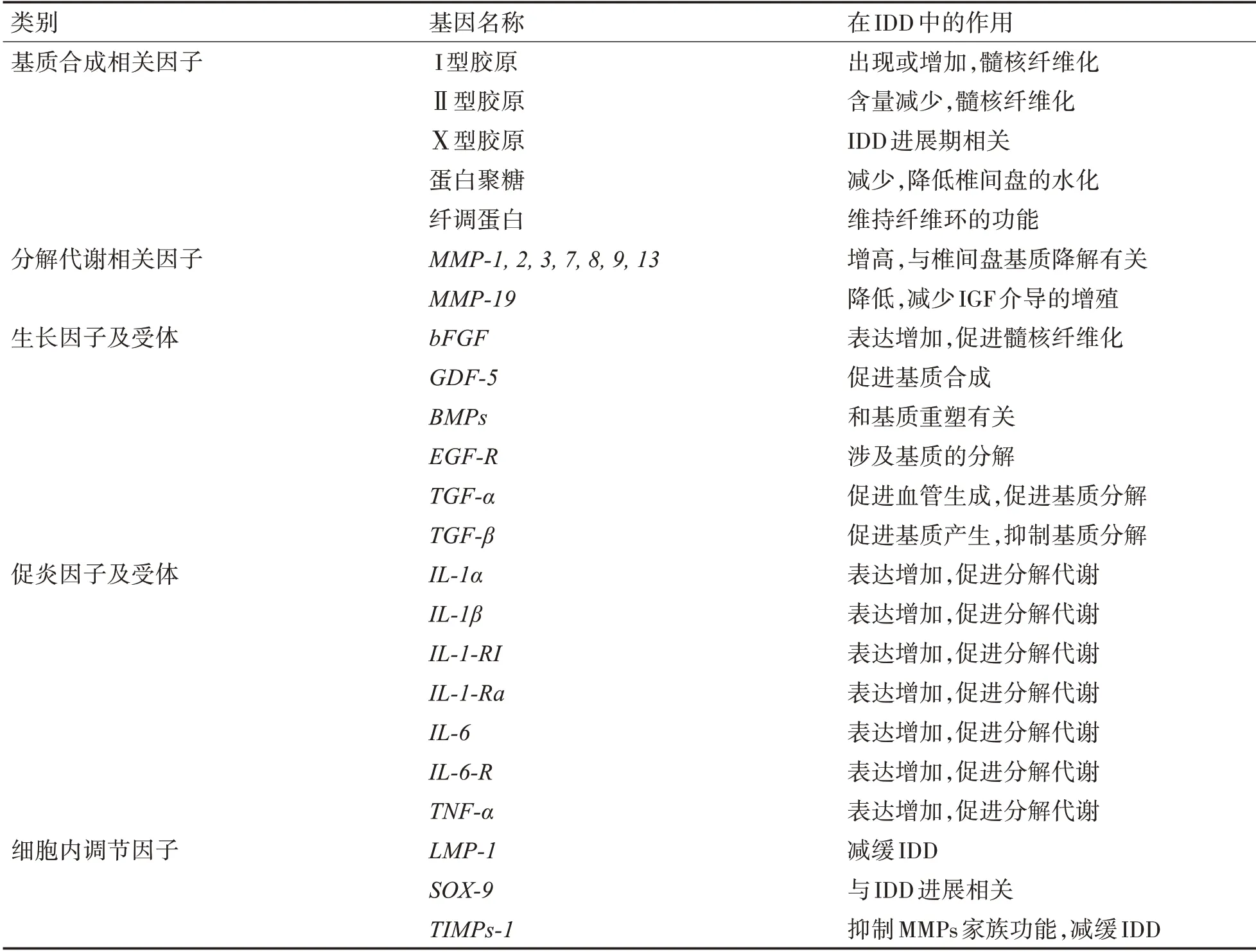
表1 IDD相关基因及其作用
1 病毒介导的基因治疗
1.1 逆转录病毒介导的基因治疗 逆转录病毒为单链RNA 病毒,可高效地感染多种类型细胞,将外源基因随机插入并稳定整合到宿主细胞基因组中持续表达。逆转录病毒作为载体的缺点包括:①不能感染非分裂细胞;②转录终止能力相对较弱,从而有可能造成转录通读;③可能产生有复制能力的病毒;④可能造成插入性突变。通常逆转录病毒的插入位点是随机的,但更倾向于插入基因的第一个内含子和转录起始位点。此外,逆转录病毒可包装的外源基因要求小于8 kb,因此只适用于体外的细胞感染[7-8]。Wehling 等[9]通过逆转录病毒载体将两种外源基因─细菌LacZ基因和人白细胞介素-1(IL-1)受体拮抗剂的互补DNA,从体外转移到牛尾椎终板分离的软骨细胞中,并在48 h内成功产生了IL-1受体拮抗剂蛋白。Reinecke 等采用大鼠也得到了类似的结果,也是将LacZ基因和人IL-1ra的cDNA 通过逆转录病毒介导导入椎间盘细胞,并检测到表达。这些研究显示了局部基因治疗IDD 的潜在应用,将外源性的治疗基因引入椎间盘细胞和其他脊柱组织,可能会为治疗物质输送到脊柱开辟新的途径。
1.2 慢病毒介导的基因治疗 慢病毒作为载体用于基因治疗,其特点是用于各种组织的靶细胞、能承载相对多的基因载荷,可携带较大基因组、并可将目的基因高效整合至目的基因组DNA 而稳定表达[8]。慢病毒可以有效地传递大量的外源基因,在多基因表达系统中具有明显优势,对于分裂期及非分裂期细胞均能够高效感染。慢病毒载体另一大优点是不易诱发宿主免疫反应。从安全角度来看,慢病毒是一种复制缺陷型病毒载体,因此不会对细胞或人体产生不良感染,属于低毒性病毒载体。其生物安全性明显优于逆转录病毒,甚至优于非病毒类基因载体。2015年,赛佳明等[10]研究慢病毒载体GVl 15 介导Caspase-3siRNA 转染人椎间盘髓核细胞,转染l周后即可表达绿色荧光素,Ⅱ型胶原和蛋白多糖含量较对照组显著增高。Ma 等[11]采用慢病毒介导的凋亡抑制因子survivin转染退变人椎间盘髓核细胞,结果发现:尽管慢病毒携带survivin可以成功地在髓核细胞中表达,细胞形态明显改变,但细胞凋亡率未降低。因此,对survivin基因在椎间盘退变中的治疗作用还需进一步评估。2016 年,Liu 等[2]报道了转化生长因子β3(TGF-β3)、结缔组织生长因子(CTGF)和TIMP-1与慢病毒载体在新西兰大白兔环形穿刺模型中的体内共转导,结果显示具有上调蛋白聚糖和Ⅱ型胶原的基因表达和蛋白合成的作用,并且椎间盘的磁共振成像(MRI)分级评分有显著改善。这些结果既让我们看到了慢病毒多基因转移治疗IDD的潜在价值和希望,也发现了存在的问题和不成熟的一面。
1.3 腺病毒介导的基因治疗 腺病毒载体介导基因治疗也颇受研究者重视,因为它具有体外稳定、易于纯化的优点,而且能够感染终末分化细胞,并且不整合入宿主,避免了插入突变的可能。腺病毒载体也有缺点:①与细胞基因的重组,可能使腺病毒结构蛋白表达,从而引起机体免疫反应;②在特定情况下少量的复制能力,会导致宿主发生脑炎的危险。Nishida 等人[13]报道了体外培养成熟雌性新西兰大白兔分离的椎间盘髓核细胞,通过编码lacZ基因的腺病毒构建体(Ad-lacZ)转导成功的例子,证明了基因治疗IDD 疾病的可行性。2016 年,Luo等[14]发现腺病毒不仅是一种有效的基因传递载体,而且可以延长人生长和分化因子5(GDF-5)的表达,从而促进髓核细胞后粘多糖和羟脯氨酸含量增加,促进了细胞外基质的产生,这表明Ad-GDF-5组细胞在蛋白和mRNA水平分泌蛋白多糖,Ⅱ型胶原和聚糖蛋白表达上调。因此,利用腺病毒载体将病毒基因转移到椎间盘髓核细胞的治疗方法被证明是可行的,可以通过增强人髓核细胞的细胞外基质生成来恢复退变椎间盘的功能等方式来实现,而且有报道使用腺病毒载体的单次注射,可实现载体基因表达长达1年。腺病毒作为载体的免疫原性,并由此导致的临床安全问题,这一点一定不能忽略。
1.4 腺相关病毒介导的基因治疗 腺相关病毒(AAV)属于细小病毒科,Dependoparvovirus 属。它的生命周期依赖于辅助病毒的存在,如腺病毒,目前的共识认为AAV 不会引起任何人类疾病。AAV 作为基因治疗最有希望的载体之一[15-16],其重要特征是在人类中的低遗传毒性。2012 年,Leckie SK 研究团队[17]在一项动物实验中,以AAV为载体,将金属蛋白酶组织抑制因子-1(TIMPs-1)注射到兔退变椎间盘中,结果证实TIMPs-1能够延缓椎间盘退行性变的发展。Lattermann 等[18]报道了AAV 载体成功地将荧光素酶的基因转导到兔椎间盘髓核细胞,并与腺病毒的载体进行比较。在处死动物时,Lat‐termann 等发现除了注射部位有软组织瘢痕形成外,没有发现椎间盘任何宏观变化[18],目前研究发现,AAV 载体的免疫原性低于腺病毒载体,且与人类或哺乳动物的任何已知疾病无关[19]。Ren 等[20]研究探讨了AAV 介导的BMP-7和SOX9双基因体外共转染人退变性椎间盘髓核细胞的生物学功能,AAV 介导的BMP-7和SOX9体外共转染可促进人退变椎间盘髓核细胞中Ⅱ型胶原的合成。AAV 是实现椎间盘转基因治疗的一种有价值的新载体,尤其它的低遗传毒性和低免疫原性的优点,正受到越来越多人的青睐。但是,AAV 作为基因治疗载体,与腺病毒载体相比,起效更慢,表达强度更低,因此,它的使用还需要进一步评估。
1.5 杆状病毒介导的基因治疗 杆状病毒也可以作为基因治疗的载体。这种病毒能在体内或体外释放外源性基因至哺乳类动物细胞,包括不含细胞毒素未分化细胞。有研究发现杆状病毒介导的某些基因在宿主细胞长期表达并无明显毒性反应。Liu 等[21]报道了杆状病毒将绿色荧光蛋白(GFP)基因转移到椎间盘上的实验研究,结果显示均在兔椎间盘细胞中成功表达,且无任何症状。尽管相关研究数量特别少,但这些结果表明杆状病毒也有潜力成为一个有效治疗IDD的载体工具。
2 非病毒介导的基因治疗
2.1 阳离子多聚物载体 阳离子多聚物可与富含阴离子的DNA 互相结合,其形成的复合物(polyplex)具有黏合到细胞膜表面的硫酸粘多糖上的功能,从而利用细胞膜内吞功能将其吞入进入细胞内。报道的阳离子多聚物种类众多,其中研究较早的是多聚赖氨酸,后来研究发现聚乙烯亚胺性能更佳,是目前研究的热点[22-23]。2015 年,Feng 等[24]采用阳离子嵌段共聚物用传递治疗质粒DNA(pDNA),结果发现,这种混合胶束对核酸酶的高耐受性和对蛋白质吸附的强抵抗力,在大鼠尾盘注射明显降低了实验诱导的炎症反应,增加了糖胺聚糖(GAG)含量,最终获得了更好的治疗效果。2018年,Feng等[25]又报道了一种持续的两阶段生物反应的microRNA 转运系统,通过可注射的可降解水凝胶包裹基质金属蛋白酶-响应性多聚胶团进入椎间盘髓核细胞。该研究中阳离子嵌段共聚物被设计成复合miR-29a,第一阶段,局部纤维化区域基质金属蛋白酶水平升高触发水凝胶降解,从而定位病变椎间盘组织中多聚胶团的持续释放。第二阶段,释放的多聚胶团对基质金属蛋白酶反应,使PEG 壳脱落,随后,在椎间盘髓核细胞中可实现增强细胞摄取和内小体逃逸。多聚胶束是重要的非病毒载体,也是有希望治疗IVD 退变的基因治疗载体之一。如何找到性能更优的阳离子多聚物并形成有效的载体系统是该方向研究的关键点。
2.2 纳米颗粒载体 纳米颗粒载体所介导的基因治疗具有自身独特的优势。首先,纳米材料的大小在一定的数量范围内,因此对细胞的生长和活性几乎不具备细胞毒性;其次,纳米颗粒载体通常没有免疫原性,不会激活细胞的免疫反应;再次,纳米颗粒载体对外源基因转导效率通常要高于脂质体,并且它的自身体积很小,从而可以随血液循环到达各个组织中。目前实验研究较多的包括无机纳米颗粒(如碳酸钙、金纳米颗粒、磁性氧化铁)、有机硅纳米颗粒、天然高分子纳米颗粒等[22]。2010 年,Yang等[26]将BMPF 做成纳米颗粒的水悬浮液,实验发现这些纳米颗粒可下调基质蛋白aggrecan、Ⅰ型胶原、Ⅱ型胶原的基因表达,上调基质金属蛋白酶3的基因表达。最近研究[27]证明miR-141是IDD 的关键调控因子,而纳米颗粒转染miR-141 可加重或减轻实验性IDD。该研究揭示了miR-141 通过与SIRT1/NF-KB 通路相互作用促进IDD 进展的一种新机制。因此,在体内阻断miR-141 可能是治疗IDD 的一种潜在的治疗方法。目前,纳米材料研究的蓬勃发展,为下一步基因治疗奠定了更加坚实的基础。
2.3 RNA 干扰 RNA 干扰(RNAi)是由长度为20~30 nt 小双链RNA 介导的转录后的基因沉默现象,用于特异性基因沉默,当然也可以用作基因治疗。经典的siRNA 介导的RNAi 途径通过与靶标mRNA互补配对实现对同源序列表达水平的下调。siR‐NA 介导的RNAi 的优势之一是其有效性。即使是相对较小的siRNA 也能有效地下调特定基因表达的调控。因为siRNA 被纳入RNA 诱导的沉默复合体(RISC),它在细胞中是稳定存在[28],并反复劈开目标mRNA。Kakutani 等[29]首次证明靶向外源性报告基因的siRNA 可以有效地在体外沉默人类和大鼠椎间盘髓核细胞中的基因表达。该研究siRNA介导的基因沉默在大鼠和人椎间盘细胞的体外实验中是可行的,并且可以有效的下调特定基因的表达。2011 年,Sudo 等[30]发现采用SiRNA 技术,在兔椎间盘细胞中敲除caspase 3 可有效防止凋亡细胞死亡,从而调控IDD。韩敦富等[31]用阴性对照FassiRNA 转染原代大鼠腰椎间盘细胞后,结果发现siRNA 可降低大鼠椎间盘细胞对IL-β 预刺激导致的凋亡敏感性,说明减轻或抑制炎症反应对减缓IDD 有重要作用。RNA 干扰能够特异的沉默一些特定的基因表达,从而影响髓核细胞内相关信号通路作用或细胞因子生成,因此,其在IDD 治疗中的应用正变得越来越广泛。
3 基因编辑技术
基因编辑是指对基因组进行定点修饰的一项新技术[32]。基于DNA 核酸酶的基因编辑技术发展迅速,从第一代DNA 核酸酶编辑系统ZFNs、第二代TALENs 到第三代CRISPR/Cas9 系统,基因编辑效率不断提高、成本逐渐降低,应用范围不断扩大。CRISPR 技术在活的真核细胞中实现了精确高效的基因组编辑[32-33]。在IDD 的基因治疗领域,Farhang等[34]报道了将慢病毒CRISPR 表观基因组编辑系统引入人类退变椎间盘细胞,下调TNF 受体1(TN‐FR1)/IL-1受体1(IL-1R1)的表达。这些研究结果证明了CRISPR-Cas9 系统在病理椎间盘细胞中的有效性和可行性,同时也揭示了IL-1R1表观基因组靶向性的局限性,这表明可能需要一种定制的方法来成功调控每个基因。Bowles 和Farhang 团队[35]最近又报道了一种通过dCas9-VPP CRISPR 基因激活系统直接上调主要软骨组织蛋白aggrecan(ACAN)和Ⅱ型胶原(COL2A1)来增强再生表型的新方法,这种方法表明dCas9-VPR 系统可以在不需要生长因子的情况下稳定地上调COL2A1和ACAN沉积,为IDD 进行基因治疗提供了一种新的、精确的控制干细胞表型的方法。基因编辑是一项新的热门技术,尤其是最新的CRISPR技术在真核细胞中实现了精确高效的基因组编辑,其定点修饰功能必定在IDD的基因治疗中开拓出一片新的空间。
4 IDD的基因治疗的展望与挑战
椎间盘是一个低氧并营养供应有限的组织,其独特的解剖和生理特性是我们进行退变椎间盘基因治疗最主要的挑战之一[36]。尽管现阶段一些基因治疗应用已初见成效,而且新的基因治疗技术的兴起让IDD 的治疗再一次步入了全新的起点,但是目前仍然还有许多障碍需要克服,如安全性、高成本和转染效果等。因此,努力提高基因治疗的安全性和有效性是科研工作者们的重要工作,而发展和寻求更高效的基因治疗方法,是促进基因治疗发展的助推器。
