Rab10通过介导肝癌细胞上皮间质转化促进肝癌转移
2021-07-31高明萱雍遇乐刘泽昆陆蒙
高明萱,雍遇乐,刘泽昆,陆蒙
肝癌在全球恶性肿瘤中发病率排名第七,死亡率排名第四,从全球来看,我国肝癌的发病率和致死率都居于世界首列[1],其中肝细胞癌(Hepatocel‐lular Carcinoma,HCC)是最主要的肝癌类型,由于其高复发、高转移,患者接受治疗的5 年生存率较低[2],因此,研究肝癌转移的潜在机制,对于预防HCC 患者转移的发生、制定晚期HCC 患者的治疗策略均具有重要意义。
Rab10 是小分子GTP 酶家族的成员,具有GDP和GTP 结合域,主要参与蛋白的囊泡运输[3-4]。Rab10的表达和活化均会影响蛋白和脂质的合成与转运。研究发现,活化的Rab10 破坏VSVG 到达细胞基底侧膜的定位分选,使其部分位于顶端膜[5]。在上皮细胞早期极化过程中,Rab10 从高尔基体运输开始发挥作用,并与Rab8 合作参与蛋白质向基底侧膜的转运[5]。此外,Rab10蛋白作为Ras家族成员,参与肿瘤发生和进展。例如,长链非编码RNA LINC00152通过miR-107/Rab10调控食管鳞癌细胞的增殖、迁移和侵袭[6]。MiR-329 通过下调Rab10抑制骨肉瘤的发展[7]。在HCC 中,Rab10 过表达通过多种致癌、细胞应激和细胞凋亡途径来调节细胞存活和增殖,最终促进肿瘤发生[8]。MicroRNA-519d/Rab10 可通过激活AMPK 通路诱导肝癌细胞自噬和凋亡[9]。尽管最近的研究表明Rab10 的表达与肝癌细胞的增殖和凋亡密切相关,然而,关于Rab10在肝癌转移中的作用目前尚无报道。
本研究将探讨Rab10 表达对肝癌迁移和侵袭的影响。首先,通过对美国癌症基因组图谱(Can‐cer Genome Atlas,TCGA)和基因表达汇编(Gene Expression Omnibus,GEO)两个肿瘤数据库的分析发现Rab10 mRNA 在HCC 患者中高表达,并且Rab10 的表达与肝癌病人生存密切相关。然后,利用特异靶向Rab10 的小RNA 干涉片段,明确干涉Rab10 可通过调控上皮间质转化(Epithelial-Mes‐enchymal Transition,EMT)来降低HCC 细胞的迁移和侵袭。
1 材料与方法
1.1 材料 人肝癌细胞系HCC-LM3细胞购于上中国科学院上海生科院细胞资源中心,E-cadherin、N-cadherin 和Snail 抗体购于武汉三鹰生物有限公司,Rab10 多克隆抗体购于Abcam 公司,α-tubulin单克隆抗体为空军军医大学细胞生物学教研室制备,转化生长因子-β1(Transforming Growth Factorβ1,TGF-β1)购于美国Peprotech 公司。DMEM 培养基、细胞消化液、谷氨酰胺、青链霉素均购于美国Invitrogen 公司,胎牛血清购自于杭州四季青公司,Rab10 干涉与对照片段购于上海吉玛基因公司,LipofectamineTM 2000 转染试剂购于美国Invitrogen公司,细胞裂解液RIPA 与PMSF 购于上海碧云天生物技术公司,二辛可宁酸(Bicinchoninic Acid,BCA)蛋白定量试剂盒购于英国Pierce 公司,发光液EnlightTM 购于北京英格恩生物科技有限公司。实时荧光定量聚合酶链反应(Real-Time fluores‐cence Quantitative Polymerase Chain Reaction,RTqPCR)所用试剂盒为反转录试剂盒和SYBR Pre‐mix Ex TaqTM 购于大连宝生物工程公司,主要仪器Real-time PCR 仪购自美国Agilent 公司,电泳仪与电泳槽、发光仪、流式细胞仪均购自美国BD 公司,酶联免疫检测仪购自美国BioTek 公司、倒置显微镜购自日本Nikon 公司,Image Station 4000 MM Pro和XLS180 光信号采集系统为美国Kodak公司。
1.2 方法
1.2.1 细胞培养与转染 人肝癌细胞系HCC-LM3用含10%胎牛血清的DMEM培养基培养,培养于温度37 ℃,5% C02浓度,饱和湿度的培养箱中,隔天换液。细胞转染时取对数生长期的HCC-LM3细胞悬液接种于6 孔板中,培养至细胞密度70%后进行转染,转染步骤及剂量严格按照LipofectamineTM 2000转染说明书步骤,分别用设计的Rab10特异性小干扰RNA(Small Interfering RNA,SiRNA)片段和阴性对照片段(表1)来实现Rab10的下调表达。
1.2.2 分组 按照Rab10 干涉情况可分为Si-Rab-1,Si-Rab-2,Si-Rab-3 组和阴性对照组(Negative Control,NC)。按照处理因素可分为4 组,空白对照组(不加TGF-β1),TGF-β1 刺激组(加入5 ng/ml TGF-β1 刺激24h),TGFβ1+NC组(在阳性对照组加入5 ng/ml TGF-β1)和TGF-β1+Si-Rab10-3 组(在干涉Rab10组加入5 ng/ml TGF-β1)。
1.2.3 蛋白提取与Western Blot HCC-LM3细胞于转染48 h 后,加入TGF-β1(5 ng/mL),24 h 收集细胞,用RIPA 裂解缓冲液裂解细胞,4 ℃裂解30 min,13000 rcf 离心30 min,提取细胞总蛋白,用BCA 法进行蛋白定量,用10%SDS-PAGE凝胶进行蛋白电泳,转膜,孵育一抗Rab10(1:300)、E-cadherin(1:1500)、N-cadherin(1:1500)、Snail(1:500)和αtubulin(1:50),4 ℃过夜孵育,用TBST 缓冲液洗去一抗,滴加同种属二抗室温孵育1 h,再用TBST 缓冲液洗去二抗,用化学发光液进行发光。
1.2.4 RNA 提取和RT-qPCR 依照RNA 提取试剂盒说明书提取HCC-LM3 的RNA,并将其反转合成为cDNA。使用Primer Blast 进行引物设计,序列如下,Rab10:上游引物5’-CTGCTCCTGATC‐GGGGATTC-3’,下游引物5’-TGATGGTGT‐GAAATCGCTCCT -3’;GAPDH:上游引物5’-GCACCGTCAAGGCTGAGAAC -3’,下游引物5’-TGGTGAAGACGCCAGTGGA -3’。使用SYBR Premix Ex TaqTM,配制20 μL反应体系:SYBR 10 μL;Primer Forward 0.8 μL;Primer Reverse 0.8 μL;cDNA 2 μL;DEPC H2O 6.4 μL,将反应体系加入八连管中,混匀后离心,放入实时定量PCR仪中。
1.2.5 基质胶侵袭实验与迁移实验 在24 孔板中预先铺设Transwell 小室,对于侵袭实验,提前加入用培养基稀释好的Matrigel稀释液(1:5)100 μL,置于37 ℃培养箱3 h,使Matrigel 胶凝固,迁移实验直接铺设Transwell小室。准备转染48 h的HCC-LM3细胞,TGF-β1(5 ng/mL)刺激24 h 后,消化、离心用无血清培养基重悬,细胞计数约1×105个/mL。取细胞悬液加入小室,上室每孔加200 μL 的细胞悬液,下室加入含10%胎牛血清的DMEM 培养基500 μL,继续培养。再培养18 h 后,取出Transwell 小室,用0.2%结晶紫/95%乙醇固定染色,清水中涮洗,再用干净的棉签去除上层的细胞,风干过夜后进行拍照计数。每组实验重复3次,取均值。
1.3 统计学处理 通过SPSS16.0 分析软件,采用Kaplan-meier 法进行总生存时间分析。计量资料采用“均数±标准差()”表示,统计分析用Graphpad prism 软件,组间比较采取t检验,P<0.05为存在显著差异。
2 结果
2.1 临床HCC组织中,Rab10表达与预后的相关性分析 为了明确Rab10 在HCC 患者组织中的表达,我们通过TCGA-LIHC 数据库和GEO 数据库(GSE22058),首先分析了Rab10 的mRNA 表达,其中,TCGA-LIHC 数据库包括371 例原发性肝癌肿瘤和50 例非肿瘤癌旁组织,GEO 数据库包括96 例原发性肝癌肿瘤和相对应的癌旁组织。TCGALIHC 和GEO 数据分析显示,癌旁组织中Rab10 的mRNA水平显著低于HCC组织,差异具有统计学意义(图1A)。接着,对TCGA-LIHC 的肝癌病人进行总体生存分析,结果表明Rab10高表达的HCC患者生存率低(P<0.0001,图1B)。
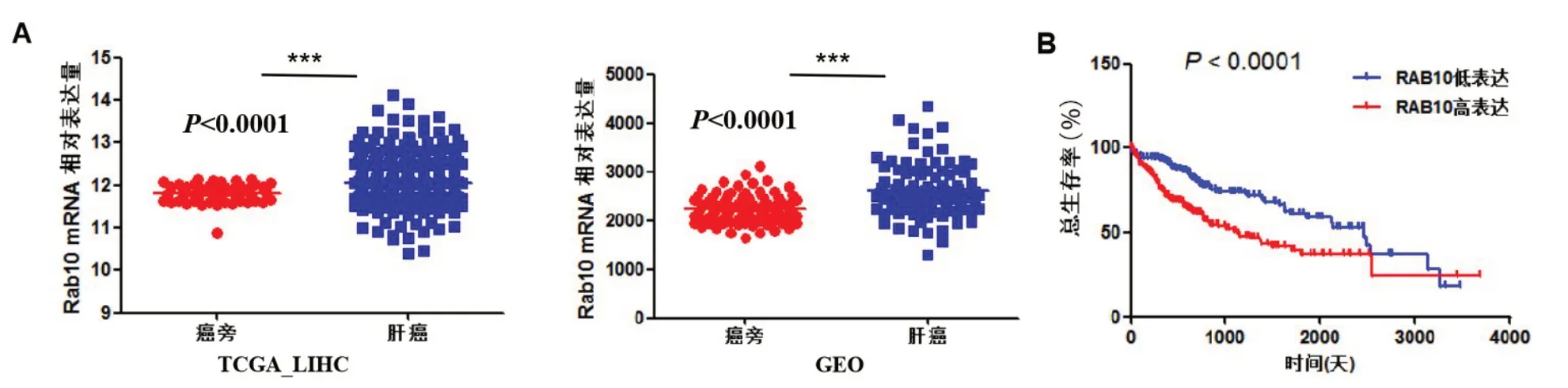
图1 Rab10对临床预后的影响
2.2 Rab10 对肝癌细胞迁移和侵袭能力的影响Western Blot 和RT-qPCR 结果显示,与阴性对照组(Negative Control,NC)比较,siRab10-3 组中Rab10蛋白和mRNA 水平显著降低(图2A,图2B)。接下来,利用此干涉片段和NC组进行细胞功能实验,迁移实验显示,穿过小室的NC 组细胞数为194.30±5.78,与对照组比较,干涉Rab10 组细胞穿过数目为68.67±12.81,干涉Rab10降低了HCC-LM3细胞的迁移能力(P=0.0009,图2C)。同时,细胞侵袭实验显示,干涉Rab10 降低了HCC-LM3 细胞的侵袭能力(P=0.0139),其中NC 组和Si-Rab10-3 组穿过小室的细胞数分别为139.3±16.59 和64.00±7.02(图2D)。
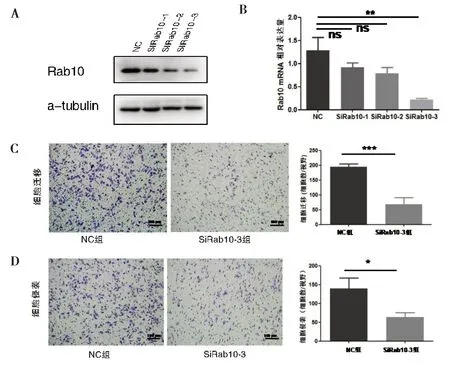
图2 两组细胞迁移和侵袭能力的比较
2.3 Rab10 对TGF-β1 诱导的肝癌细胞EMT 的影响 Western Blot结果显示,在HCC-LM3细胞中,与对照组比较,干涉Rab10 后E-cadherin 表达上调,同时N-cadherin 和Snail 表达下调(图3A)。TGF-β 1 刺激后,E-cadherin 表达下调,N-cadherin 和Snail表达上调,而相比于NC 组,干涉Rab10 则升高Ecadherin 的表达,降低N-cadherin 和Snail 的表达,即干涉Rab10 抑制了由TGF-β1 引起的E-cadherin下降和N-cadherin、Snail 表达的升高(图3B)。TGF-β1 诱导肝癌细胞EMT 的过程中,肝癌细胞的迁移和侵袭能力增强,Transwell迁移和侵袭实验也证实此结论,与空白对照组(细胞迁移数为216.30±5.55;细胞侵袭数为211.00±17.78)比较,TGF-β1 组可明显增强HCC-LM3 细胞的迁移(细胞迁移数为531.00±3.79,P<0.0001)和侵袭能力(细胞侵袭数为448.70±24.22,P=0.0014)。然而,TGF-β1 刺激下,与NC 组相比(细胞迁移数为533.30±4.37;细胞侵袭数为480.70±4.06),干涉Rab10 后肝癌细胞的迁移(细胞迁移数为166.30±8.01,P<0.0001)和侵袭能力降低(细胞侵袭数为125.70±12.13,P<0.0001,图3C)。
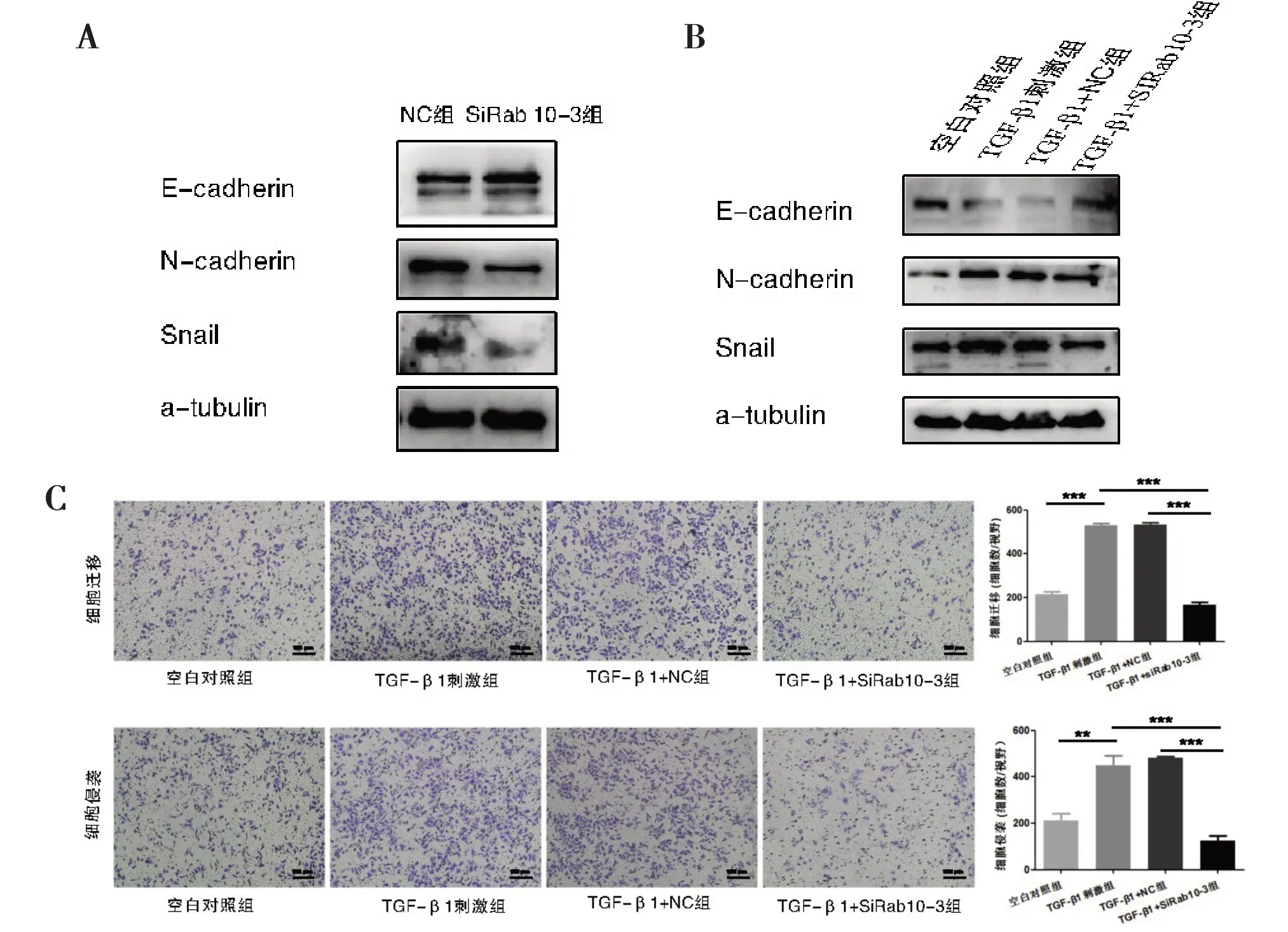
图3 Rab10对肝癌细胞EMT的作用
3 讨论
Rab GTP 酶可作为细胞膜系统的核心调控因子,在生理状态下,维持胞内蛋白的转运,膜性结构的转运和细胞骨架的稳定。当转运功能障碍时,可导致机体出现从感染性疾病到癌症不等的多种疾病状态[10]。尤其值得注意的是,作为一个转运相关分子,近些年越来越多的报道指出Rab10在多种恶性肿瘤的发生发展中发挥着重要作用[11-12]。目前,Rab10在HCC 中研究仍处于初级阶段,在肝癌发生阶段的增殖和凋亡方面少有报道,而对于该蛋白在肝癌进展中的作用未有研究。因此,我们将关注点放在了Rab10 在HCC 转移中的作用。首先,通过TCGA-LIHC 和GEO 两个癌症相关数据库的分析发现与癌旁组织相比,Rab10 在HCC 组织中mRNA显著高表达。然后,通过与肝癌转移相关的细胞功能实验证实,干涉Rab10显著降低HCC细胞的侵袭和迁移能力。综上,Rab10 不仅在肝癌的形成和增殖方面发挥了重要作用,该蛋白在肝癌转移方面的作用也不可忽视。
通常EMT 的发生被认为是转移的启动子,是肿瘤细胞迁移和侵袭的重要步骤[13],具有极性的上皮细胞转化为间质细胞,并获得侵袭和转移能力。经历EMT 的细胞,其形态和功能都会发生改变,丧失顶端-基底极性和细胞-细胞间的连接,既可以穿透基底膜和间质组织,还可以穿过循环系统至远处组织[14-15]。那么,Rab10 对肝癌细胞的迁移和侵袭是否是通过EMT 呢?于是,我们检测了干涉Rab10后对上皮细胞标志物E-cadherin和间质细胞标志物N-cadhein、Snail 表达的影响,结果显示,HCC-LM3 细胞中,下调Rab10 后,E-cadherin 表达上调,N-cadherin和Snail表达下调。
TGF-β1是公认的EMT诱导因子,在HCC发生和发展中发挥着重要的作用,其可以通过与细胞膜上的受体结合,激活Smad 通路(Smad2、Smad3 和Smad4),最终促进EMT 的形成[16-18]。另外,TGF-β1可以破坏上皮细胞极性和细胞连接,诱导癌细胞发生EMT,促进肿瘤的转移,其中包括E-cadherin、Ncadherin、Snail、Twist 等分子表达的改变[19-21]。为了更加明确Rab10表达与EMT的相关性,我们建立了TGF-β1 诱导的肝癌细胞EMT 模型,本研究通过Western Blot 发现,降低Rab10 的表达可以增加TGF-β1 下调的上皮标志物E-cadherin 蛋白表达,降低TGF-β1上调的间质标志物N-cadherin和Snail蛋白表达。进一步功能实验证实,干涉Rab10抑制了TGF-β1 引起的肝癌细胞的迁移和侵袭,总之,Rab10 的表达会影响肝癌细胞发生EMT 进而调控肝癌进展。这些结果表明:干涉Rab10 可抑制由TGF-β1增强的HCC-LM3细胞的迁移和侵袭能力,即Rab10可通过EMT调控肝癌细胞的迁移和侵袭。
综上所述,我们的研究发现癌基因Rab10 可通过介导EMT 影响HCC 的恶性进展。这样,Rab10可作为一个潜在的肝癌晚期标志物,靶向Rab10可能成为一种新的针对晚期HCC 的治疗策略,对今后肝癌的研究提供新理论和新思路。然而,我们只揭示了Rab10 在HCC 转移中作用,我们认为,在这一进程中,一定有许多有趣的机制深埋在地下,值得我们进一步探索。
