当归多糖对慢性应激抑郁小鼠的行为影响及其机制研究
2021-07-30葛韵芝
丁 超,许 寅,葛韵芝
上海市公共卫生临床中心,上海 201508
作为一种常见的精神疾病,抑郁症能够影响患者的认知、情感及机体功能[1-2]。抑郁症的发生发展与多种风险因素有关,包括社会因素、心理压力、慢性疾病与遗传因数等[3]。患者除了感到悲伤、焦虑、空虚和绝望外,还常表现出兴趣缺失、食欲不振及自杀倾向[1]。目前,全球约有4亿人受到抑郁症困扰[4-5]。
近年来,抑郁症的病理机制逐渐明晰,包括下丘脑-垂体-肾上腺(hypothalamic-pituitaryadrenal,HPA)轴改变、炎症反应系统激活、代谢异常、内分泌失调及神经系统病变等[6-8]。而抗抑郁药物也快速发展,临床常用的三环类抗抑郁药物、5-羟色胺(5-hydroxytryptamine,5-HT)再摄取抑制剂和单胺氧化酶抑制剂等能够一定程度上改善抑郁症患者的认知与情感等功能[9]。但是,抑郁症的高度异质性[10-11]、易耐药性[9]、药物的严重不良反应及昂贵售价限制了现有抗抑郁药物的临床应用。因此,抗抑郁药物的开发引起了研究人员的关注。而价格低廉、不良反应较小的中药成为了抗抑郁药物开发的重点[12-13]。
作为一种在亚洲国家被广泛使用的天然药物[14],当归(Angelica archangelicaL)能够补血和血、调经止痛,它参与了多种抗抑郁中药复方的组成,包括逍遥散[15]、当归补血汤[16]和当归芍药散[17]等。现代药理学研究报道[18],当归能够显著减少抑郁模型小鼠悬尾与强迫游泳不动时间,降低抑郁模型小鼠下丘脑中精氨酸加压素的表达[19];对抗慢性束缚应激引起的嗜睡症状[20],增加抑郁模型大鼠脑源性神经营养因子表达[21]。但是,当归改善抑郁症的活性成分和作用机制尚不明确。
当归多糖(angelica polysaccharides,AP)是从当归中分离得到的主要活性成分之一[22]。研究表明,当归多糖具有广泛的药理活性,包括了免疫调节[23]、抗肿瘤[24]、抗肝脏损伤[25]、抗炎[26]、抗贫血[27]、抗脊髓损伤[28]等作用。然而,目前对于当归多糖干预抑郁症的研究仍然未见报道。在本研究中,笔者使用行为学评价、神经递质检测及mRNA测定的方法探讨了当归多糖对慢性应激诱导的抑郁模型小鼠的影响及作用机制,现报道如下:
1 材料与方法
1.1 实验动物C57BL/6小鼠,SPF级,雄性,6周龄,购自上海斯莱克实验动物有限责任公司,实验动物使用许可证号:[SYXK(沪)2014-0029],饲养于复旦大学实验动物科学部,饲养条件:温度(22±1)℃,湿度(60±5)%,12 h明暗交替。
1.2 试药与试剂当归多糖(美国泛华医药公司,批号:A22000);氟西汀(美国礼来公司,批号:J20130010);乌来糖(国药集团化学试剂有限公司,批号:30191228);蛋白测定试剂盒(上海碧云天生物技术有限公司,批号:B69320);逆转录试剂盒、甲酸、乙腈及甲醇[赛默飞世尔科技(中国)有限公司,批号分别:11146024、166963、172443、138489];qPCR 反应试剂盒[东洋纺(上海)生物科技有限公司,批号:SCQ-501];RNA 提取试剂盒[赛默飞世尔科技(中国)有限公司及东洋纺(上海)生物科技有限公司,批号分别为AM1931、NPK-801];qPCR引物(上海赛百盛基因技术有限公司)。
1.3 模型制备采用旷场实验筛选出60 只合格健康C57BL/6小鼠,适应性喂养7天后随机分为正常对照组(Control)、模型对照组(Model)、当归多糖低剂量组(20 mg/kg AP)、当归多糖高剂量组(40 mg/kg AP)及氟西汀组(10 mg/kg Fluoxctinc),每组12 只。正常对照组小鼠正常饲养;其他组小鼠制备慢性应激抑郁模型,在标准小鼠框单笼饲养,并不定时给予以下7 种刺激:禁食24 h、禁水12 h、连续日照36 h、电击5 min(0.7 A)、无垫料饲养24 h、倾斜45°饲养、24 h 和夹尾刺激1 min。每种刺激重复出现(非连续),共5 周。造模的同时灌胃给药,其中正常对照组和模型对照组给予等体积的水,药物组给予对应药物灌胃。每周记录小鼠体质量。
1.4 观察指标
1.4.1 行为学检测 5 周结束时,进行强迫游泳测试(forced swimming test,FST),将小鼠置于含20 cm 深清水容器中,记录小鼠在6 min 内累积不动时间;悬尾测试(tail suspension test,TST),将小鼠尾部固定在一根水平木棍上,使其倒挂,记录小鼠在6 min 内累积不动时间;高架十字迷宫实验(elevated plus maze test,EPMT),使用30%的酒精清洁高架十字迷宫后,将小鼠放入中央位置并使头部面向开臂,记录6 min内小鼠进入开臂的时间;记录小鼠1 h 饮用1%蔗糖溶液百分比(糖水消耗量/用水量×100%)作为评价指标计算糖水偏好率(sugar perference)。
1.4.2 海马组织神经递质检测 5 周结束时,麻醉条件下将小鼠安乐死,取海马组织加入500 μL的甲酸-甲醇(1∶1000)匀浆,以离心半径15 cm,2 3000 r/min离心15 min。取上清液,使用LC-MS/MS色谱法进行海马组织多巴胺(dopamine,DA)、5-HT、γ-氨基丁酸(γ-aminobutyric acid,GABA)和谷氨酸(glutamate,GLU)含量检测。
液相条件如下:A 相为甲酸-水(1∶1000),B 相为乙腈,进行梯度洗脱。洗脱条件为0~2 min,0.02B;2.01 min,0.8B;7 min,0.9B;11 min,0.02B;流速为0.2 mL/min。
1.4.3 海马组织TPH1、SNAP25 mRNA 检测 取小鼠海马组织进行色氨酸羟化酶1(tryptophan Hydroxylase 1,TPH1)和突触体相关蛋白25(synaptosome associated Protein 25,SNAP25)mRNA表达的检测,所有实验方案严格按照qPCR试剂盒说明书操作,反应体系为20 μL。TPH1、SNAP25和ACTB引物序列见表1。

表1 引物序列
海马组织总RNA提取方法如下:将海马组织加入1 mL Trizol 试剂,匀浆后以离心半径15 cm,12 000 r/min条件下离心15 min取上清液;加入200 μL氯仿,振荡15 s 后静置5 min,在离心半径15 cm,12 000 r/min 离心15 min 取上清液;加入500 μL异丙醇,摇匀后在离心半径15 cm,12 000 r/min离心10 min,取上清液;加入1 mL75%乙醇,吹打后离心半径15 cm,7000 r/min离心5 min,弃去上清液;加入60 μL RNase-free水溶解沉淀,摇匀。
1.5 统计学方法使用SPSS 20.0软件进行统计学分析,计量资料使用表示,使用单因素方差分析(ANOVA),P<0.05表示差异有统计学意义。
2 结果
2.1 行为学表现与正常对照组比较,其余各族可显著增加小鼠在强迫游泳测试与悬尾测试中的累积不动时间(P<0.01),减少小鼠在高架十字迷宫实验中的进入开臂时间及糖水偏好率(P<0.01),对小鼠体质量的影响未见统计学差异(P>0.05)。与模型对照组比较,当归多糖高剂量组和氟西汀组显著降低小鼠在强迫游泳测试中的累积不动时间(P<0.05),增加小鼠在高架十字迷宫实验中的进入开臂时间及糖水偏好率(P<0.05);当归多糖各组及氟西汀组可显著降低小鼠在悬尾测试中的累积不动时间(P<0.05),对小鼠体质量的影响未见统计学差异(P>0.05)。见图1。
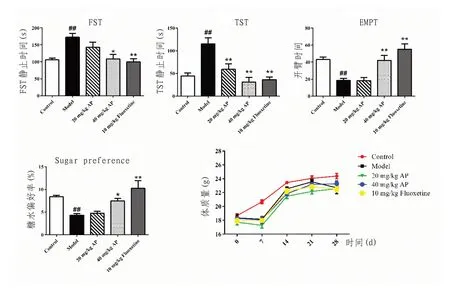
图1 各组小鼠行为学表现
2.2 海马组织神经递质含量与正常对照组比较,其余各组显著减少小鼠海马组织中DA、5-HT含量及GABA/GLU比率(P<0.01),对GABA和GLU含量的影响未见统计学差异(P>0.05)。与模型对照组比较,当归多糖高剂量组和氟西汀组可显著增加小鼠海马组织中DA 和5-HT 含量(P<0.05);当归多糖高剂量组显著增加小鼠海马组织中GABA/GLU 比率(P<0.05),对GABA 和GLU 含量的影响未见统计学差异(P>0.05)。见图2。

图2 各组小鼠海马组织神经递质含量
2.3 海马组织中TPH1 和SNAP25 mRNA 表达与正常对照组比较,其余各组可显著减少小鼠海马组织中的TPH1、SNAP25 mRNA 表达(P<0.05)。与模型对照组比较,当归多糖高剂量组可显著增加小鼠海马组织中的TPH1 mRNA 表达(P<0.05),对SNAP25 mRNA表达的影响未见统计学差异(P>0.05)。见图3。

图3 各组小鼠海马组织中TPH1和SNAP25 mRNA表达
3 讨论
在我国,抑郁症已经成为造成青少年非正常死亡的首要原因[29]。近年来,抑郁症和身体健康之间的生物学关联越发得到重视[1]。由于细胞模型无法满足对情绪及认知评估的要求,动物模型仍旧是抑郁症实验研究的首选[30]。目前,常用的抑郁症动物模型包括药物诱导、慢性应激诱导与脑损伤诱导等[30-31]。而作为人类抑郁症的诱因之一,动物在经历慢性应激后容易产生与人类相似的食欲减少、淡漠及绝望情绪等抑郁症状[32]。因此,慢性应激诱导的抑郁模型是目前抗抑郁药物评价时的常用模型[32-33]。在本研究中,我们采用慢性应激诱导的抑郁小鼠模型探讨当归中的主要活性成分当归多糖对抑郁症的影响。
在临床上,抑郁量表与行为评分是评估抑郁症程度的重要指标[34]。在动物模型上,由于可以较好地反映动物认知情况,行为学评估在抑郁症药物筛选中也是至关重要的[35-36]。常规的抑郁相关动物行为学评估包括糖水偏好率、FST、TST、EMPT 及旷场实验(open field test,OFT)等[37-38]。这些测试能够评估动物的认知与绝望情绪,进而反应动物的抑郁行为程度。在本研究中,模型组小鼠糖水偏好率、FST、TST、EMPT 显著变化,说明慢性应激诱导了小鼠抑郁行为;高剂量当归多糖可对小鼠糖水偏好率、FST、TST、EMPT 进行调节。该结果提示当归中的主要活性成分当归多糖能够通过改善抑郁行为对抑郁症产生影响。
抑郁行为的发展常与大脑中的神经递质变化有关[39]。作为学习与记忆的关键部位,海马组织也与抑郁症的发生关系密切[40]。当抑郁发生时,海马组织内的神经递质传导功能通常显著受损[41-42]。在抑郁症实验模型中,海马组织中的神经递质检测是常用的抑郁评估指标[43]。这些神经递质包括DA、5-HT、GABA、GLU 和5-羟吲哚乙酸(5-hydroxyindoleacetic acid,5-HIAA)等[44-46]。其中,DA 的缺失能够引起悲伤和自我否定[47];5-HT分泌减少能够诱发人类抑郁与自杀行为[34];GABA能够直接影响人类认知与焦虑情绪[47];海马组织内GLU 水平异常升高能够引发兴奋性神经毒性,进而促进抑郁的产生[48];GABA/GLU 比值变化与脑内兴奋抑制功能紊乱相关[48]。在本研究中,模型组小鼠海马组织中DA、5-HT含量及GABA/GLU比率的下降,说明慢性应激诱导了小鼠脑内神经递质传导功能减退与兴奋抑制功能紊乱;高剂量当归多糖对小鼠海马组织中DA、5-HT 含量及GABA/GLU比率的调节指示:当归多糖能够改善慢性应激诱发的小鼠大脑内神经递质传导功能减退与兴奋抑制功能紊乱。该结果提示当归中的主要活性成分当归多糖改善抑郁症的效果可能与其能够调节神经递质传导及纠正兴奋抑制功能紊乱有关。
在抑郁症的发生发展中,相关的神经递质紊乱常与其上下游效应分子变化有关[5,36]。5-HT 是抑郁过程中的重要靶点,其在中枢系统的表达与抑郁行为密切相关[6]。TPH1 是5-HT 合成过程中的重要限速酶,与5-HT 含量直接相关,因此检测海马组织中TPH1 的表达可以衡量5-HT 传导功能的情况[49]。SNAP25 直接影响着DA、5-HT、GLU 及GABA 等神经递质合成后的递质释放,与神经递质传递能力密切相关。因此,检测TPH1 和SNAP25 mRNA 表达可以评估脑内5-HT 合成与神经递质传递情况[50]。在本研究中,模型组小鼠海马组织中TPH1 和SNAP25 mRNA 表达显著下降,说明慢性应激诱导了小鼠脑内5-HT 合成障碍和神经递质传递功能减退;高剂量当归多糖组小鼠海马组织中TPH1 mRNA 表达升高,SNAP25 mRNA 表达未见明显变化,说明当归多糖能够改善慢性应激诱发的小鼠脑内5-HT 合成障碍。综合该结果与脑内神经递质含量变化结果,提示当归中的主要活性成分当归多糖改善抑郁症的效果可能与TPH1 mRNA 表达升高引起5-HT 合成增加有关,与SNAP25 mRNA表达变化引发的神经递质传递功能变化无关。
在本研究中,我们通过行为学评价、神经递质检测及mRNA 测定的方法探讨了当归多糖对慢性应激诱导的抑郁模型小鼠的影响及作用机制。结果发现当归多糖能够改善慢性应激模型小鼠抑郁行为;其作用机制与上调TPH1 mRNA 表达引起5-HT 合成增加、提高DA 含量及升高GABA/GLU 比率进而调节神经递质传导及纠正兴奋抑制功能紊乱有关,与调节SNAP25 mRNA 表达变化无关。该研究结果能够为当归多糖改善抑郁症的药物开发和作用机制研究提供物质基础。然而当归多糖改善抑郁症的作用机制仍未完全明晰。在未来的研究中,我们将进一步探讨当归多糖对脑内神经递质上下游效应分子的影响。
