慢性硬膜下血肿钻孔引流术后早期血肿机化的诊治
2021-07-29高宝成郑云飞张永发欧阳劲松赵建华
高宝成 郑云飞 张永发 欧阳劲松 刘 柳 周 帅 赵建华
慢性硬膜下血肿(chronic subdural hematoma,CSDH)是神经外科的常见病。对于占位效应明显的CSDH,首选钻孔冲洗引流术,但术后复发率在5%~33%,平均复发时间为30 d[1]。机化型CSDH(organized CSDH,O-CDSH)是CSDH的一种特殊类型,发病机制度不明确,0.5 %~2%的CSDH经6~12个月可进展成O-CSDH[2]。CSDH钻孔冲洗引流术后早期(7 d内)形成血肿机化即早期O-CSDH,临床罕见,处理困难,并发症多。2013年1月至2017年12月收治早期O-CSDH共7例,现报道如下。
1 资料与方法
1.1 一般资料 纳入标准:①临床表现结合影像学诊断为CSDH,血肿厚度>10 mm;②初次手术为单孔钻孔冲洗引流术;③术后1周内出现新发颅内压增高症状或神经功能障碍,并进行性加重;④再次手术证实为血肿机化。排除标准:①初次手术证实为机化;②距离第一次手术间隔>7 d;③术后2年内失访。
2013年1月至2017年12月收治CSDH共313例,其中7例为早期O-CSDH。7例中,男5例,女2例;年龄44~84岁,平均65.0 岁;7例均具有糖尿病病史,5例具有服用拜阿司匹林或氯吡格雷史,2例使用肝素史,4例具有高血压病史。
1.2 治疗方法 入院后行单孔钻孔冲洗引流术,术中用温生理盐水冲洗至清亮,留置引流管,术后给予阿托伐他汀等治疗,引流管在48 h内拔出。术后1周内出现新发颅内压增高症状或神经功能障碍,且进行性加重,头颅CT示占位效应明显,均全麻下行大骨瓣开颅血肿清除术,均见血肿机化,清除血肿的同时切除骨窗范围内壁层包膜及部分脏层包膜,常规留置硬膜下引流管48 h。术后6 h、7 d及随访时行CT检查,必要时行MRI检查。
2 结果
2.1 早期O-CSDH特征5例术前CT为混杂密度,2例为均一低密度;钻孔引流术中均未见明显机化血肿,术后6 h复查CT示血肿基本清除,中线移位6~15 mm,平均8.7 mm。术后诉症状均明显好转。术后1周内新发对侧肢体肌力下降3例,失语2例,头痛呕吐等颅内压增高症状1例,烦躁等精神症状1例;均进行性加重。开颅术中均发现切口处少许炎性渗出,未见明显脓性改变;以实性机化组织为主,其间夹杂少量液化的血性液体。
2.2 并发症及预后 二次术后再发急性硬膜下出血1例,再次行开颅血肿清除术;癫痫发作2例;无死亡病例。术后2年,GOS评分5分6例,4分1例。
2.3 典型病例63岁男性,因头痛2周入院。体格检查未见明显神经系统阳性体征。既往1个月前有头部外伤史;既往有糖尿病、高血压、口服拜阿司匹林史。入院CT示左侧额颞顶枕混杂密度(图1A),局麻下行单孔钻孔冲洗引流术,术中用温生理盐水冲洗至冲洗液清亮,留置引流管,术后口服阿托伐他汀钙(20 mg,1次/d)等治疗,头痛症状明显缓解,术后6 h复查头颅CT示血肿基本清除,额叶少量积气(图1B)。术后48 h内拔除引流管。术后6 d,出现运动性失语,渐进性加重,复查头颅CT示血肿占位效应明显,脑沟脑回显示不清(图1C)。急诊全麻下行大骨瓣开颅血肿清除及包膜切除术,术中见机化血肿(图1D~F),术后症状好转。术后半年复查头颅MRI示未见血肿复发(图1G~I)。
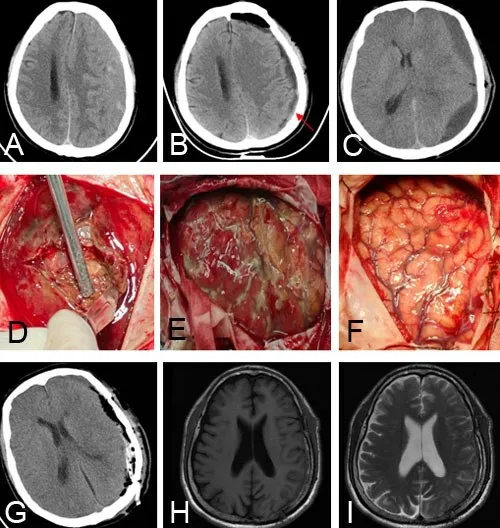
图1 左侧额颞顶枕部慢性硬膜下血肿钻孔引流术后早期继发血肿机化影像学表现及术中表现
3 讨论
3.1 早期O-CSDH的病因及危险因素 文献报道,CSDH是在血肿外膜的不断渗血及纤溶亢进的环境下逐渐扩大形成的[3]。O-CSDH是CSDH的一种特殊类型,部分CSDH经6~12个月可演变为O-CSDH[4],而继发于CSDH钻孔引流术后早期O-CSDH,临床罕见,其发病机制不明,我们推测可能为:①钻孔引流术将纤溶亢进的血性液体清除后,类似于肉芽组织的包膜广泛纤维化,血肿的纤维蛋白网被胶原纤维代替而形成血肿机化;②钻孔引流术后残留的血肿及絮状物内含有的大量炎性因子可加速血肿机化;③CSDH的慢性压迫导致脑血流自我调节异常,钻孔引流术后脑组织过度灌注,导致局部自由基生成,继而促使炎性因子增多[2]。
结合本文病例,我们认真导致早期O-CSDH的高危因素可能为以下几种:①糖尿病病史。文献报道糖尿病病人的血液粘度及渗透压高、血小板聚集性增加,血液凝固加快,在理论上可促进形成血肿机化[5]。②停止使用抗凝或抗血小板药物。文献[5]表明抗凝药的使用在CSDH的形成中具有重要作用,术前抗凝治疗且凝血酶原时间/国际标准化比值大于1.5 是CSDH复发的独立危险因素,因此突然停止抗凝及抗血小板药物,血液处于高凝状态,促进血肿机化。③切口乙级愈合。炎性因子在血肿机化过程中起重要作用。本文7例术中皮下均可见少许炎性渗出,部分病人术中可见少许炎性物质,由此推测,切口局部炎性反应可能加速血肿机化。④钻孔术后CT示中线移位>5 mm。文献[5]表明术后中线移位明显(即中线移位>5 mm)的病人,其外膜异常增生,且血肿内大量纤维化形成,促进血肿机化。
3.2 早期O-CSDH的诊治 对于CSDH钻孔冲洗引流术后早期出现新发神经功能障碍,特别是合并糖尿病史、术前停止抗凝药或抗血小板药、切口乙级愈合及术后头颅CT示中线移位>5 mm的病人,应警惕早期O-CSDH。单依据影像学检查诊断困难,金标准仍为术中见机化血肿。
虽然CT示中线移位及血肿厚度均较钻孔引流术前有所好转,但症状进行性加重,CT显示脑肿胀,故大骨瓣开颅血肿清除术是早期O-CSDH的首选治疗方式,但内膜是否去除及术后并发症等仍是争论的焦点。早期O-CSDH外膜与血肿扩大有关,内膜使脑组织变得僵硬,阻碍脑复张;同时,内膜切除后,血肿内容物可通过脑皮层及硬脑膜淋巴通路重吸吸而降低复发率[5],故应积极切除内膜,但激进的切除可因脑组织局部粘连紧密导致脑挫伤。本文7例术中均切除外膜,并在与蛛网膜疏松处切除内膜,适量冲水使内膜与蛛网膜分离,若黏连紧密局部离断保留,避免脑组织挫伤。
文献报道,早期O-CSDH的手术病死率在0~15.6 %[4];再出血发生率为10.7 %,主要原因为骨瓣未达血肿边缘,位于内外膜结合处的窦状血管反复出血、术中止血不彻底等。本文7例中,术后再发出血1例(14.3 %),考虑术后气颅导致引流入上矢状窦的桥静脉受牵拉破裂导致;术后发生癫痫发作2例(28.6 %),可能与术中内膜剥离时脑组织点状挫裂伤有关。术后随访2年,GOS评分5分6例,4分1例;无死亡病例。
综上所述,早期O-CSDH临床罕见,应用大骨瓣开颅血肿清除联合膜切除术,必要时结合神经内镜,均可取得良好的疗效。但本文为小样本病例资料,存在局限性,仍需多中心、大样本及更加详尽的资料以进一步深入研究和临床论证。
