术中B超联合神经导航辅助显微手术切除脑功能区及脑深部病变
2021-07-29武融青王美瑶徐成仕李正伟李志强陈劲草
武融青 王 潇 王美瑶 徐成仕 李正伟 李志强 陈劲草
对于大脑皮层功能区及深部病变,为保留神经功能,一次性、无偏差地并安全地最大程度切除病变至关重要。神经导航目前已广泛运用于指导颅内肿瘤的切除,但开颅后脑组织位移造成的“脱靶”以及术中无参照,导致术中很难判断病变是否切除完全。术中B超可实时、多角度探查病变。2017年12月至2020年12月在神经导航联合B超引导下切除大脑皮层功能区及深部病变25例,现总结如下。
1 资料与方法
1.1 一般资料25例中,男13例,女12例;年龄4~69岁,平均47岁。头痛、头晕8例,癫痫6例,单侧肢体乏力或感觉异常4例,视野缺损3例,中枢性面瘫1例,感觉性失语1例,无症状5例。术前均行头部CT及MRI检查,25例共发现病灶32个,最大径0.6 ~6.5 cm,平均2.1 cm;形态规则且轮廓清晰9个,形态呈菜花样或分叶形但轮廓清晰9个,形态不规则且与正常脑组织边界不清14个;位于胼胝体体部1个,丘脑及内囊1个,基底节1个,大脑皮质功能区29个[根据Brodman分区法,位于额叶联合皮质区4个,运动前区及运动区2个,运动区及躯体感觉区6个,躯体感觉区及躯体感觉联络皮质区4个,运动语言中枢(Broca区)2个,听觉语言中枢及听觉皮质区3个,视觉语言中枢1个,视觉皮质区2个,运用中枢2个,嗅觉皮质区3个]。
1.2 手术方法 术前根据CT及MRI检查初步确定病变范围,通过神经导航设计最小皮瓣、骨窗及合适的入路。打开硬脑膜后,先行MRI神经导航定位病变,然后使用B超证实,并测量病灶大小、深度、血供及病灶与周围血管的关系,矫正皮层切口及皮层下造瘘的方向和深度,在显微镜下切除病变。术中灵活运用B超随时了解病变位置及切除程度,扫描时清除术腔中的血凝块及止血材料,注满生理盐水。6例癫痫术中行皮层脑电描记,12例中央区病变术中辅以神经电生理监测及唤醒技术,8例脑胶质瘤在5-氨酸乙酰丙酸(5-aminolevulinic acid,5-ALA)荧光引导下切除。
1.3 疗效评估 术后24~72 h内复查MRI,分析病变切除程度,记录术后神经功能变化。随访记录康复情况以及肿瘤术后复发情况。
2 结果
2.1 手术结果 术中B超均完整、清晰显示32个病灶,病灶距脑表面0.1 ~3.4 cm,平均1.4 cm;其中29个皮层功能区病灶,术中B超定位与MRI神经导航定位无偏差;而3个深部病灶均有不同程度位移,最大误差约为1 cm。术后MRI显示,22例病变全切除,2例高级别胶质瘤次全切除,1例多发脑结核瘤切除80%。术后神经功能损伤加重及新增副损伤4例。随访截至2021年3月,25例中,失随访2例,其余23例平均随访13.3 个月,14例非恶性肿瘤症状明显缓解,3例胶质瘤术后复发、无进展生存期平均13个月,2例肺腺癌转移瘤及另4例胶质瘤未复发。
2.2 术后病理检查结果 胶质瘤8例,海绵状血管瘤10例,肺腺癌转移瘤3例,巨大动脉瘤1例,结核瘤1例,胚胎发育不良性神经上皮瘤1例,青少年多形性低级别上皮肿瘤1例。
2.3 典型病例
病例1:61岁男性,因脑胶质母细胞瘤术后1年复发入院。脑MRI平扫+增强示左侧顶叶不规则长T1、长T2flair高信号术腔影,边缘见大片状高T2flair高信号水肿带,及数枚不均匀强化结节(图1A)。全麻后经MRI神经导航定位颅内病变,设计开颅部位及骨窗大小。剪开硬膜后B超定位3个肿瘤(图1D),与MRI神经导航定位无明显偏差,黄荧光成像下切除囊周2个肿瘤,再次B超探查并定位囊后一肿瘤组织(图1E),5-ALA荧光引导下切除(图1C)。术后恢复良好,脑MRI平扫+增强显示肿瘤切除效果满意(图1B),术后病理诊断为胶质母细胞瘤。
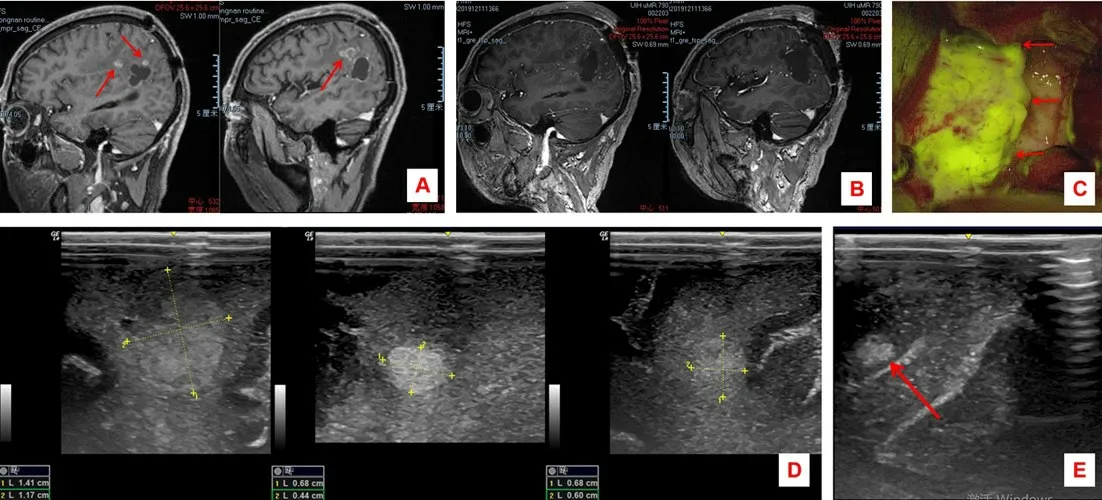
图1 左侧顶叶胶质母细胞瘤术中B超联合神经导航辅助下手术治疗前后影像
病例2:61岁男性,因间断头痛1年,加重伴呕吐5 d入院。脑MRI平扫+增强示胼胝体体部左上方结节状短T1、短T2、T2flair高低混杂信号,边缘见环形低信号环,该结节强化不明显(图2A)。全麻后经MRI神经导航定位颅内病变,设计开颅部位及骨窗大小。剪开硬膜后B超定位1个稍高回声光团(图2B),大小约为1.3 cm×0.8 cm,距脑表面约3 cm,位置与MRI神经导航偏差约1 cm,以B超定位为准,矫正手术入路,术中多次监测以保证手术入路无偏斜(图2C)。肿瘤切除后脑表面切口直径仅1.5 cm(图2D)。术后恢复良好,脑MRI平扫+增强显示肿瘤切除效果满意,术后病理诊断为海绵状血管瘤。
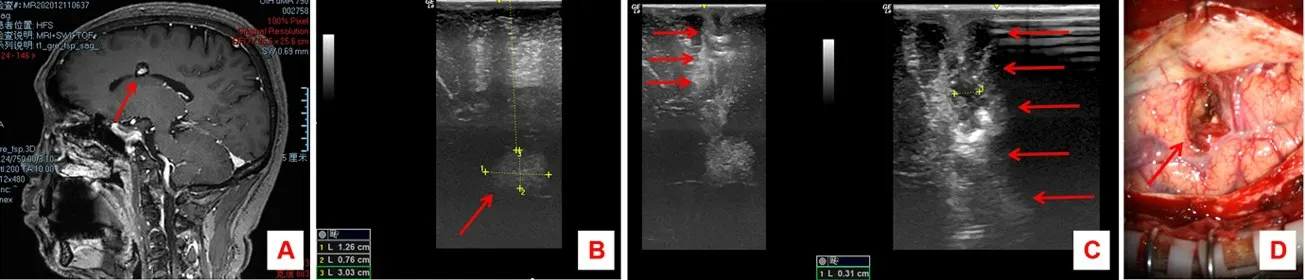
图2 胼胝体体部海绵状血管瘤术中B超联合神经导航辅助下手术治疗前后影像
3 讨论
在大脑功能区及脑深病变切除术中,病灶的精准定位和手术入路的正确选择,是减少、甚至避免损伤正常脑组织的关键。根据术前CT及MRI影像,可在神经导航指导下制订手术方案,但脑移位现象的存在使神经导航并不如预期可靠。所谓脑移位,是指原本密闭的颅腔在术中开放后脑脊液流失、皮质肿胀、术腔塌陷、暴露目标病灶的过程中不可避免地牵拉脑组织以及重力、体位改变、使用甘露醇等多种因素,从而导致脑组织形状及空间位置的改变。Gerard等[1]回顾并总结关于脑移位的研究发现,硬脑膜、脑皮质、锥体束、大脑血管、中线结构均可发生不同程度的位移,肿瘤中心的平均位移2.0 ~3.8 mm,肿瘤边缘的最大位移可高达30.9 mm。Pedtridis等[2]单独使用神经导航的“脱靶”率高达26%。可见单纯依靠术前神经导航,并不能完全避免术中“脱靶”,仍需术中影像学技术帮助实时了解病变的准确位置,特别是小病灶(直径≤1 cm)[3]。术中MRI及CT图像分辨率高、成像方式多样,但造价昂贵,使用繁琐,对手术室要求高,成像时间长,难以在术中普及。而超声则价格低廉,操作简便,成像迅速,可随时、动态、多方位观察病灶。随着超声技术的发展、颅脑专用高频探头应用、多种成像方式的引入以及经验的积累,越来越多的研究表明术中超声具有较高的实用价值:①除动脉瘤和颅底肿瘤外,超声对胶质瘤、转移瘤、神经鞘瘤、血管瘤、鞍区肿瘤、脑脓肿及动静脉畸形等均显示良好[4],对于癫痫相关的局灶性皮质发育不良的分辨率高于MRI[5];②在神经导航的基础上,使用术中超声时,颅内病灶的全切除率显著高于不使用任何术中影像技术[6];③一项荟萃分析显示术中超声对胶质瘤的定位成功率高达100%,全切除率约为77%[7];④另有荟萃分析表明术中B超虽对于残余胶质瘤的敏感度不足,但特异度较高[8,9],甚至略高于术中MRI及5-ALA荧光引导技术[9];⑤在转移瘤、海绵状血管瘤以及经鼻蝶垂体腺瘤切除术中,使用超声也收益显著[10~14]。
总结本文25例术中B超的应用经验,B超在大脑皮层功能区以及脑深部病变切除术中的价值主要体现在以下几点:①图像反应病灶的即时位置,可规避术中操作等原因造成的偏移,减少暴露病灶过程中造成的损伤,特别时当病变微小、位于深部或重要功能区时,首次深入即探查到病变显得尤为重要;②对于呈菜花样或分叶状等形态不规则,以及多发或具有卫星灶的病变,切除过程中脑组织塌陷极可能隐藏残余病变,术中B超可任意角度、实时探查以确认切除完全、没有遗漏,方法简便,优于术中MRI;③对于与正常组织分界不清的病变,特别是对于不能染色以确定其边界的肿瘤,B超协助确定切除范围,对良性病变周围的正常脑功能有保护作用[15];④运用B超可在关颅前探查有无硬膜下血肿等;⑤多普勒超声可展示病灶血供与周围血管的关系,避免损伤大血管,减少出血。而术中B超的局限性在于:①探查深度有限,一般距脑表面不超过5 cm;②B超扫查范围取决于骨窗的大小及位置,小骨窗可能干扰选用特殊手术入路,如避开功能区到达靶点的斜行手术通道;③病变切除后术腔周边急性水肿的组织也呈高回声,不易与病变组织相鉴别;④浸润性或侵袭性肿瘤常变现为边界不清,即使在超声上有明显的肿瘤边缘也可能是不真实的,而且可能与CT或MRI显示的边缘不符。
本文25例中,治疗效果不理想4例,均为高级别胶质瘤,尽管术中运用B超实时定位肿瘤,联合神经电生理监测、唤醒麻醉、5-ALA荧光引导等多技术,确保以最小的损伤为代价、最大程度地切除肿瘤,但术后仍然出现新增神经功能受损表现,或原有神经功能障碍加重,虽然其中2例经康复训练略有好转。可见,相比于其他脑功能区病变,如何在延长胶质瘤病人生存时间的同时提高生活质量,仍是临床面临的难题。本文22例术后MRI显示病变全切除中,1例胶质瘤随访期间复发,可能是未对切除边缘脑组织的行病理检查,非真正全切除。
总之,开颅前神经导航有助于脑皮层功能区和脑深部病变的精确定位,指导骨窗位置及大小的设计,甚至达到开颅术“锁孔化”;但面对开颅后深部、微小病灶的“脱靶”,术中B超则可以弥补神经导航这一不足,协助定位、规划最佳入路,特别是对于形态不规则、且不能染色的病变,术中B超可随时确认切除程度,便捷程度明显优于MRI,但对高级别胶质瘤的神经功能保护未见显著作用,可能是因为高级别胶质瘤呈浸润性生长,形态多不规则,手术很难沿肿瘤边界切除而不影响周围重要神经结构。
