MMP2在胃癌干细胞中表达水平变化意义
2021-07-29马果果马志强李忍萍
马果果,马志强,李忍萍
(河南科技大学第二附属医院消化内科,河南 洛阳 471000)
我国是胃癌(gastric carcinoma)高发国家,每年新发病例占全球的40%[1]。近年来,随着对恶性肿瘤研究的不断深入,越来越多的学者认为,肿瘤干细胞也具有固体肿瘤特征,胃癌可能是一种干细胞疾病[2]。因此研究胃癌干细胞内的自我更新相关分子信号通路,对于胃癌的针对性治疗具有重要意义。胃癌的高侵袭性、高转移性及高复发性是本病高致死率的主要因素。基质金属蛋白酶-2(matrix metalloproteinase-2,MMP-2)是基质金属蛋白酶之一,能降解细胞外基质。MMP-2是肿瘤侵袭、转移以及肿瘤供血血管新生过程中的重要参与因子[3]。研究显示[4],MMP2可能是肿瘤干细胞生物学活性的重要促进因子。但是MMP2对胃癌干细胞的影响,以及在胃癌发生发展中的作用机制少有报道,因此本研究探讨MMP2在胃癌干细胞中表达水平的意义,报告如下。
1 材料与方法
1.1 胃癌细胞系 选取胃癌MNK28细胞系,购自第四军医大学西京医院全军消化研究所。
1.2 实验方法
1.2.1 细胞培养 胃癌细胞系MKN28解冻后,置于含有10%胎牛血清的RPMI-1640培养基内进行培养,培养环境如下:37℃饱和湿度,CO 2体积分数为5%,每两天传代一次。2.5g/L胰蛋白酶进行消化、传代。
1.2.2 无血清悬浮培养 取胃癌细胞系MKN28对数生长期的细胞制成单细胞悬液,PBS洗两次之后,置于含EGF(15ng/ml)、bFGF(8ng/ml)、B27(1∶50)的DMEM/F12无血清培养基内,随后以500个/孔接种于低黏附24孔板中,在37℃、50ml/L CO2孵箱中培养,每4d换液1次。
1.2.3 质粒转染 取胃癌细胞系MKN28对数期生长的细胞,铺到6孔板,每孔35万个细胞,使用LipofectaminTM 2000转染,操作步骤参照相应说明书。
1.2.4 Western blot检测 将无血清培养1周后发育成形的悬浮球取出,置于15 ml离心管中,选用细胞裂解液进行裂解,纯化后采用4~12% Bis-Tris蛋白质进行电泳凝胶操作,电泳电压120V,当溴酚蓝前沿接触到分离胶底部时停止。30V室温下进行转膜操作,持续1h,5%脱脂奶封闭,TBST漂洗后进行一抗操作,试剂为MMP2(sc-80210)小鼠抗人单克隆抗体(1∶500),内参为MMP2(1∶2000),4℃过夜孵育,随后选用HRP偶联进行二抗,室温环境中孵育1h,TBST漂洗,按ECL化学发光试剂盒(Santa Cruz公司)内附说明书进行显色,采用Alpha Imager 2200软件对结果进行分析。
1.2.5 无血清悬浮培养成球实验 取MKN28胃癌细胞样本接种到96孔板中,每孔1000个细胞。无血清环境悬浮培养,时长1周,随后记录每个孔悬浮球数目。
1.2.6 平板克隆实验 将MKN28胃癌细胞样本接种至8 cm细胞培养皿内,每孔细胞数约2000个。培养2周后,克隆计数。
1.3 统计学处理 统计采用SPSS19.0软件,MMP2相对表达等资料采用()表示,组间比较使用方差分析,检验水准α为0.05。
2 结果
2.1 悬浮球细胞和普通贴壁细胞MMP2表达MKN28胃癌细胞在无血清、低粘附环境内,依然有较少数细胞可形成悬浮球体,随培养时间延长,球体增大。悬浮球MKN28细胞MMP2表达量明显高于贴壁MKN28细胞(P<0.05),见表1、图1。

表1 悬浮球细胞和普通贴壁细胞MMP2表达

图1 Western blot检测图(A:悬浮球细胞;B:贴壁细胞)
2.2 质粒转染后MMP2表达 转染组MMP2表达量明显低于对照组和空白转染组(P<0.05)。见表2、图2。

图2 Western blot检测图(A:转染组;B:空白转染组;C:对照组)

表2 质粒转染后MMP2表达
2.3 质粒转染后细胞悬浮成球率 转染组细胞悬浮成球率明显低于对照组和空白转染组(P<0.05)。见表3、图3。

表3 质粒转染后细胞悬浮成球率
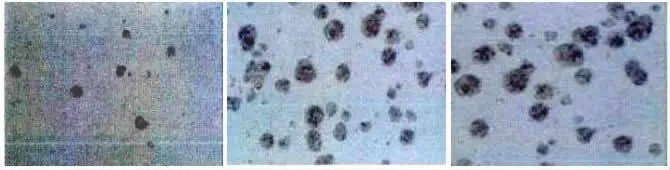
图3 细胞悬浮成球率检测图(A:转染组;B:空白转染组;C:对照组)
2.4 质粒转染后细胞克隆形成率 转染组细胞细胞克隆形成率为(2.82±0.89)%,明显低于对照组和空白转染组(P<0.05)。见表4、图4。

表4 质粒转染后细胞克隆形成率

图4 细胞克隆形成率检测图(A:转染组;B:空白转染组;C:对照组)
3 讨论
肿瘤,尤其是恶性肿瘤复发是本病治疗难点之一,随着对恶性肿瘤发病机制研究的深入,大量研究表明[5,6],肿瘤本质可能是一种干细胞疾病。肿瘤干细胞(cancer stem cells,CSCs)是一种可进行自我更新,并可启动肿瘤生成的细胞,虽仅占肿瘤细胞的极少部分,但是由于其具有对放化疗的抵抗、高转移等特点,因此肿瘤干细胞活性对于对肿瘤的存活、增殖、转移及复发有着重要作用。目前研究显示[7,8],肿瘤干细胞存在于多种恶性肿瘤中,例如结肠癌、肝癌、乳腺癌以及肺癌等。研究肿瘤干细胞内具有自我更新作用的相关子信号通路对于阐明肿瘤干细胞的调控机制,带来肿瘤治疗疗效的突破具有重要意义。
研究显示[9],胃干细胞是一种具有自我更新、复制能力细胞。胃癌的侵袭和转移机理与胃干细胞自我更新能力有一定相关性。基质金属蛋白酶家族与上皮间质转型(epithelial mesenchymal transition,EMT)过程息息相关,而EMT与恶性肿瘤侵袭、转移能力密切相关。细胞外基质(extracellular matrix,ECM)屏障则是肿瘤细胞侵入其他血管的必要过程,而MMPs促进ECM降解。研究显示[10,11],MMPs改变了肿瘤细胞的微环境,促进了肿瘤的侵袭和转移。MMP2与胃癌密切相关的一种基质金属蛋白酶,MMP2可以降解Ⅳ型胶原,它是脉管基底膜的一种重要的组成成分。研究显示[12],MMP2表达水平直接影响着胃癌浸润深度、淋巴结转移程度,MMP2促进淋巴结转移。Jiang[13]等研究显示,MMP2可以增强胃癌的侵袭、转移能力。但是目前尚未证实MMP2在胃癌肿瘤干细胞自我更新中的作用机制。因此本研究设计一系列实验探讨MMP2在胃癌干细胞中表达水平的意义。体外克隆球生成能力是当前应用最广的肿瘤干细胞鉴定方案。细胞在体外无血清、低粘附培养条件下,如该细胞可生成克隆球则表示其具有自我更新能力[14],即属于肿瘤干细胞表现型。本组研究发现,MKN28胃癌细胞在无血清、低粘附培养条件下,依然有较少数细胞可形成悬浮球体,证实了该细胞属于肿瘤干细胞表现型。Western blot检测发现,悬浮球MKN28细胞MMP2表达量明显高于贴壁MKN28细胞(P<0.05);表明MMP2在胃癌干细胞样细胞中呈现高表达,进一步证实本研究所分离的是干细胞样亚群。与Rybarczyk[15]等研究结果相一致。通过对转染组转染MMP2干扰质粒,空白转染组转染空白质粒,结果显示,转染组MMP2表达量明显低于对照组和空白转染组(P<0.05);转染组细胞悬浮成球率明显低于对照组和空白转染组(P<0.05);转染组细胞细胞克隆形成率明显低于对照组和空白转染组(P<0.05)。表明MMP2在胃癌干细胞样细胞中的高表达特征与干细胞自我更新能力和增殖能力密切相关,但具体的作用机制尚需进一步研究。
综上所述,MMP2在胃癌干细胞样细胞内存在明显高表达现象,并且与干细胞自我更新和增殖能力密切相关。
