萎缩性胃炎Hp感染与血清PGR、OPN及胃粘膜G细胞数量的关系
2021-07-29仇瑞莉胡威刘江波
仇瑞莉,胡威,刘江波
(1.南阳医学高等专科学校第一附属医院消化内科,河南 南阳 473000;2.郑州大学第五附属医院消化内科,河南 郑州 45000 0;3.南阳市中心医院心血管内科,河南 南阳 473000)
萎缩性胃炎是临床常见消化系统疾病,主要是幽门螺旋杆菌感染导致,有报道指出萎缩性胃炎是胃癌癌前状态,萎缩程度与部位同胃癌发生具有重要的关联,而且慢性萎缩性胃炎的发病率呈现明显升高趋势,早期开展对萎缩性胃炎筛查寻找敏感性高、特异性强的的诊断标记物对于明确患者病变程度和避免恶性肿瘤发生具有重要意义[1]。常规的临床检查方法是采取胃镜等有创手段,患者苦痛大,操作复杂,近年来血清胃蛋白酶原在临床筛查萎缩性胃炎方面优势明显,可以了解患者胃黏膜状态,而且同患者病情严重性具有密切关系,对早期发现并诊断胃癌具有重要价值,骨桥蛋白则是具有多种生物学活性的磷酸糖蛋白,在恶性肿瘤发生发展过程中起到重要作用,胃黏膜G细胞是人体最重要的内分泌细胞,可以分泌胃泌素增强黏膜屏障作用,而且有报道指出其浓度与幽门螺旋杆菌感染有一定关联[2]。本研究分析了萎缩性胃炎患者幽门螺杆菌(Hp)感染与患者血清胃蛋白酶原比值(PGR)、骨桥蛋白(OPN)及患者胃粘膜中G细胞数量变化的关系,以期为临床提供指导和依据,现报告如下。
1 资料与方法
1.1 临床资料 随机选取2016年1月至2018年12月就诊于我院消化内科的慢性胃炎患者,根据胃镜及病理结果,将确诊的慢性萎缩性胃炎90例患者作为慢性萎缩性胃炎组(CAG组),将确诊的慢性非萎缩性胃炎且HP感染阴性的90例患者作为对照组。CAG组,年龄32~75岁,平均47.4±10.6岁,男49例、女41例;Hp感染阳性58例、Hp感染阴性32例,病变程度:轻度萎缩20例、中度萎缩47例、重度萎缩23例。对照组,年龄28~75岁,平均45.7±12.0岁,男44例、女46例。两组研究对象年龄、性别比较,差异均无统计学意义(P>0.05)。入选标准:⑴慢性萎缩性胃炎患者的诊断及病情标准参考《中国慢性胃炎共识意见(2012年,上海》中的诊断标准;⑵患者年龄范围19~75岁;⑶均经过胃镜取活组织经病理学检查证实;⑷本研究符合《赫尔透辛基宣言》相关伦理及保密原则。排除标准:⑴胃癌患者;⑵排除合并有消化性溃疡、食管胃底静脉曲张、消化道肿瘤、消化道出血及穿孔、严重的肝肾功能损伤及心肺疾病、严重的感染性疾病;⑶胃穿孔、肠道梗阻、消化道大出血;⑷严重的肝肾功能及感染性疾病患者。
1.2 血清PGⅠ、PGⅡ、OPN水平检测方法 抽取患者空腹静脉血5ml,2500r/min离心20min分离血清待检,采用胶乳增强免疫比浊法测定PGⅠ、PGⅡ、PGR浓度变化,采用酶联免疫吸附法测定患者OPN浓度,按照试剂盒说明书操作,试剂由南京森贝伽生物科技有限公司提供。
提取患者胃黏膜组织采取石蜡切片和水化,加入50μl过氧化酶阻断溶液试剂A孵育10min,缓冲液冲洗后加入50μl非免疫性动物血清试剂B孵育10min,缓冲液冲洗后加入50μl第一抗体即胃泌素抗体孵育1h,缓冲液冲洗后加入50μl生物素标记第二抗体试剂C孵育10min,缓冲液冲洗后加入50μl链霉素抗生物素-过氧化物酶溶液孵育10min,加入100μl新鲜配制的DAB显影观察。
1.3 统计学方法 采用美国IBM SPSS公司的统计软件包SPSS21.0版本对本研究的数据进行统计学处理,采用表示符合正态分布的计量资料,两组间分析采用t检验、三组间分析采用单因素方差分析法;计数资料组间分析采用χ2检验;P<0.05为差异具有统计学意义。
2 结果
2.1 两组血清PGⅠ、PGⅡ、PGR、OPN水平及胃粘膜组织中的G细胞数量比较CAG组患者的血清OPN水平高于对照组(P<0.05),CAG组患者的血清PGⅠ、PGR水平及胃粘膜组织中的G细胞数量低于对照组(P<0.05)。见表1。
表1 两组血清PGⅠ、PGⅡ、PGR、OPN水平及胃粘膜组织中的G细胞数量比较(
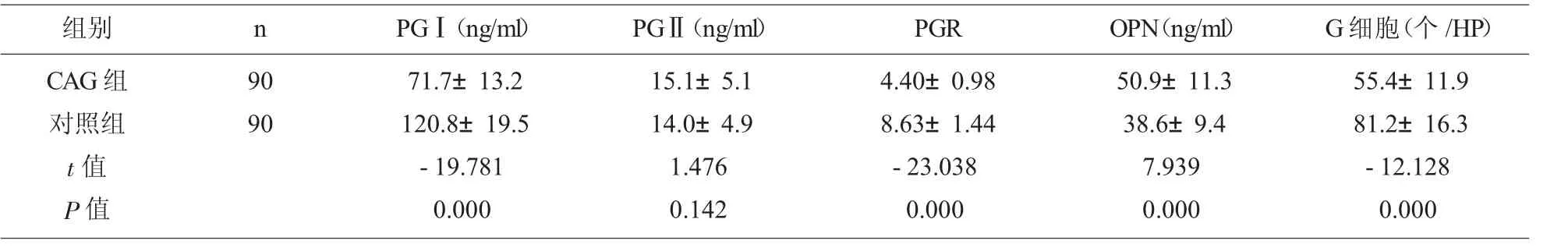
表1 两组血清PGⅠ、PGⅡ、PGR、OPN水平及胃粘膜组织中的G细胞数量比较(
组别 n PGⅠ(ng/ml) PGⅡ(ng/ml) PGR OPN(ng/ml) G细胞(个/HP)CAG组对照组t值P值90 90 71.7±13.2 120.8±19.5-19.781 0.000 15.1±5.1 14.0±4.9 1.476 0.142 4.40±0.98 8.63±1.44-23.038 0.000 50.9±11.3 38.6±9.4 7.939 0.000 55.4±11.9 81.2±16.3-12.128 0.000
2.2 不同Hp感染结果的CAG组患者血清PGⅠ、PGⅡ、PGR、OPN水平及胃粘膜组织中的G细胞数量比较Hp感染阳性的CAG患者的血清OPN水平高于Hp阴性患者(P<0.05),Hp感染阳性的CAG患者的血清PGⅠ、PGR水平及胃粘膜组织中的G细胞数量低于Hp阴性患者(P<0.05)。见表2。
表2 不同Hp感染结果的CAG组患者血清PGⅠ、PGⅡ、PGR、OPN水平及胃粘膜组织中的G细胞数量比较()

表2 不同Hp感染结果的CAG组患者血清PGⅠ、PGⅡ、PGR、OPN水平及胃粘膜组织中的G细胞数量比较()
Hp感染结果 n PGⅠ(ng/ml) PGⅡ(ng/ml) PGR OPN(ng/ml) G细胞(个/HP)+-58 32 t值P值64.8±11.4 84.0±10.3-7.908 0.000 15.2±5.0 14.8±4.8 0.368 0.713 4.39±0.74 5.68±0.91-7.286 0.000 53.7±10.8 47.5±8.6 2.793 0.006 51.2±10.6 62.8±9.4-5.168 0.000
2.3 不同病情程度的CAG组患者血清PGⅠ、PGⅡ、PGR、OPN水平及胃粘膜组织中的G细胞数量比较 胃粘膜轻度、中度及重度萎缩的CAG患者的血清OPN水平在三组间呈逐渐升高的趋势(P<0.05),胃粘膜轻度、中度及重度萎缩的CAG患者的血清PGⅠ、PGR水平及胃粘膜组织中的G细胞数量呈逐渐降低的趋势(P<0.05)。见表3。
表3 不同病情程度的CAG组患者血清PGⅠ、PGⅡ、PGR、OPN水平及胃粘膜组织中的G细胞数量比较()
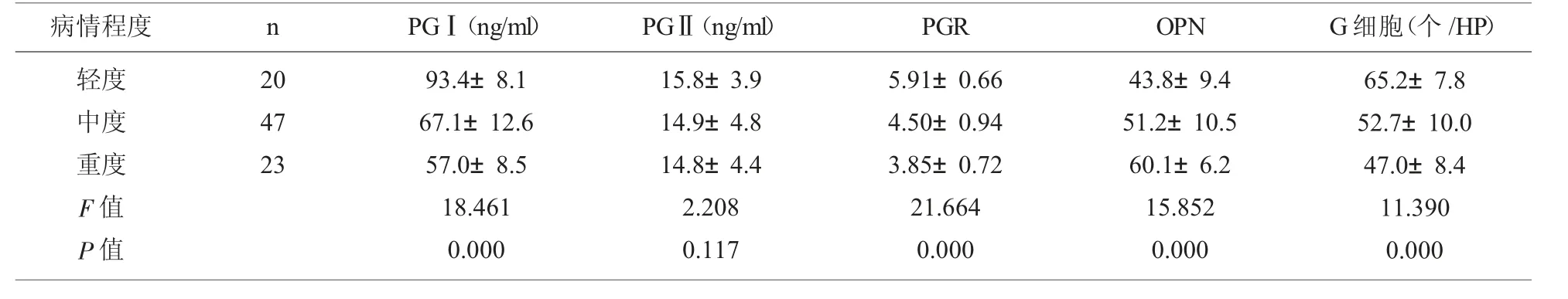
表3 不同病情程度的CAG组患者血清PGⅠ、PGⅡ、PGR、OPN水平及胃粘膜组织中的G细胞数量比较()
?
3 讨论
近年来我国慢性萎缩性胃炎的发病率逐年升高,已成为消化系统最为常见的疾病,影响患者身心健康和生活质量,本病发病机制较为复杂,具体的发病原因并不明确,考虑和幽门螺杆菌感染、胆汁反流、免疫因素、血管活性因子及细胞因子改变等有关[3]。Hp感染属于世界范围内最为常见的细菌感染之一,通过成功治疗Hp可以有效防治消化性溃疡、预防胃癌发生,研究显示幽门螺旋杆菌感染同慢性胃炎、消化性溃疡发病关系密切,伴随着年龄增加患者幽门螺旋杆菌检出率呈现升高趋势,尤其在老年人群中Hp检出率可高达95%,研究显示Hp可以分泌多种不同功能酶,尿素酶可以反应后产生氨,对胃黏膜上皮细胞造成损伤,而且Hp具有很强的黏附活性,同胃黏液中糖蛋白紧密结合后破坏了胃黏膜屏障功能[4]。萎缩性胃炎主要的发病原因临床认为是幽门螺旋杆菌感染导致,Hp的粘附会造成腺体出现萎缩,同时幽门螺旋杆菌可以让尿素酶生成氨,同时炎症细胞能生成自由基、蛋白酶均会破坏细胞,这些因子的产生会在体内发生交叉效应,最后加快了腺体的萎缩与破坏[5]。幽门螺旋杆菌在致病过程中会产生尿素酶,造成尿素缓慢水解,产生的氨会对胃黏膜造成直接损伤,当机体持续被其感染后,便可以从最初的浅表胃炎,逐渐过渡到萎缩性胃炎,甚至出现不典型增生、肠上皮化生等现象[6]。目前临床主要通过彻底消除幽门螺旋杆菌感染来改善胃黏膜慢性炎症,以有效逆转胃黏膜萎缩、肠上皮化生及不典型增生,阻断癌前病变进展[7]。目前临床对于早期诊断萎缩性胃炎并明确患者病理变化对评估患者疾病进展情况以及预后具有重要意义,传统的通过病理学检查方法重复性差,而且属于有创操作,患者耐受性降低,因此寻找可靠的血清学指标一直是临床研究的热点[8]。
胃蛋白酶原属于胃蛋白酶前提物质,成熟后能够分解胃内食物中的蛋白,胃蛋白酶原主要是人体的胃黏膜腺体细胞所分泌,PGI为胃底腺颈黏液细胞与主细胞所分泌,在胚胎胃黏膜中高度表达[9];PGII则还可以由十二指肠腺与幽门腺分泌,胃蛋白酶原会在分泌后进入到腺腔内,经胃液活化形成胃蛋白酶,而胃蛋白酶则很少进入血液循环,因此可以通过其浓度评估胃损伤程度与功能变化情况[10]。PG I、PGII及PGR能够对胃黏膜萎缩情况进行反应,胃蛋白酶原多数来自于胃黏膜,当黏膜发病后分泌胃蛋白酶原细胞病变导致人体血清中上述指标浓度变化,黏膜萎缩范围越广泛则血清中PG含量升高幅度越大[11]。OPN则是具有多种功能的分泌型钙结合磷酸化糖蛋白,其羧基端含有特异可以同细胞黏附的序列,通过与多种受体结合进行信号传递,促进了细胞发生趋化、黏附与迁移[12]。研究显示幽门螺旋杆菌感染胃黏膜组织中OPN显著升高,感染程度越重其浓度越高,主要是由于炎症介导单核细胞与巨噬细胞浸润增多造成了OPN分泌增加,因此提示了OPN在萎缩性胃炎发病并朝向恶性肿瘤演变的过程中起到了协同作用[13,14]。现代医学证实人体胃酸主要是胃壁细胞分泌,受到多种胃肠激素调节,胃G细胞则主要分泌上述激素,在人体胃窦部黏膜与腺体分布大量的胃G细胞,一般呈现锥形或卵圆形,G细胞可以分泌胃泌素刺激壁细胞胃泌素受体造成胃酸分泌增多,同时还可以刺激人体细胞分泌组胺,激活了壁细胞氢离子受体导致泌酸增加,促进了胃黏膜增生过程[15,16]。目前研究发现幽门螺旋杆菌一方面能够诱导PG基因表达造成胃蛋白酶原分泌增加,胃黏膜发生炎症反应,同时可以减少胃G细胞数量,减弱了对于胃酸和胃蛋白酶原分泌的抑制作用,造成体内PG浓度升高;另一方面幽门螺旋杆菌导致的炎症反应会造成壁细胞破坏,萎缩性胃炎逐渐形成,随着病情进展胃酸降低,体内形成恶性循环导致胃腺体萎缩引发PG分泌增加造成幽门腺化生,而且还可以刺激胃窦部位G细胞分泌胃泌素浓度升高[17]。
本研究显示,CAG组患者的血清OPN水平高于对照组,CAG组患者的血清PGⅠ、PGR水平及胃粘膜组织中的G细胞数量低于对照组,说明在萎缩性胃炎患者中存在OPN水平升高,PGⅠ、PGR水平下降,G细胞数量减少。Hp感染阳性的CAG患者的血清OPN水平高于Hp阴性患者,Hp感染阳性的CAG患者的血清PGⅠ、PGR水平及胃粘膜组织中的G细胞数量低于Hp阴性患者,说明在幽门螺旋杆菌阳性患者体内上述指标变化更为显著。胃粘膜轻度、中度及重度萎缩的CAG患者的血清OPN水平在三组间呈逐渐升高的趋势,胃粘膜轻度、中度及重度萎缩的CAG患者的血清PGⅠ、PGR水平及胃粘膜组织中的G细胞数量呈逐渐降低的趋势,说明随着病情严重程度的加重,CAG患者OPN水平逐渐升高,而PGⅠ、PGR水平逐渐降低,G细胞数量逐渐下降。本研究优势在于证实了萎缩性胃炎患者血清PGⅠ、PGⅡ、PGR、OPN及胃粘膜组织中的G细胞数量存在明显变化,而且和Hp感染以及疾病严重程度之间具有明显的关联,为临床合理选择检测指标提供了依据,但是本研究随访时间短,入组病例少,因此还需扩充样本量长期随访深入研究。
综上所述,Hp感染与萎缩性胃炎患者血清PGR、OPN及胃粘膜G细胞数量有一定的关系,同时血清PGR、OPN及胃粘膜G细胞数量变化可反应患者的病情严重程度。
