Foxp3基因在URSA患者外周血中的表达及其临床意义
2021-07-29张小燕李晓丽李雪华黄娟
张小燕,李晓丽,李雪华,黄娟
(1.平顶山市第一人民医院产房,河南 平顶山 467000;2.平顶山市第一人民医院妇一科,河南 平顶山 467000)
复发性流产是临床常见的一种妊娠并发症,已严重影响人类生殖健康,其病因较为复杂,其中一半以上复发性流产患者病因不明,因而称为原因不明复发性流产(unexplained recurrent spontaneous abortion,URSA)[1,2]。调节性T细胞 (regulatory T cell,Treg)在正常妊娠的维持中发挥重要调控作用,其中叉头样转录因子P3(Forkhead box P3,Foxp3)在Treg细胞中特异性表达并可作为标志性分子[3]。既往研究显示Foxp3基因多态性与URSA的发生密切相关[4,5]。但Foxp3基因在URSA发生过程中的调控作用尚未阐明。因此,本研究主要探讨Foxp3基因在URSA患者外周血中的表达及其临床意义,为URSA的诊断及治疗提供科学依据。
1 资料与方法
1.1 一般资料 选取2017年9月-2018年9月本院收治的55例URSA早孕妇女作为研究组,所有研究对象符合相关诊断标准:连续2次或超过2次自然流产;无死产、活产史;检查后无与流产相关的常见发病原因[6]。研究组患者年龄25~45岁,平均年龄33.49±6.12岁。同时选取同期50例正常早孕妇女为对照组,所有妇女均无遗传与自然流产史,无死胎或解剖,无内分泌异常,怀孕期间未发生生殖道感染,年龄25~42岁,平均年龄32.46±5.29岁。两组研究对象年龄比较差异无统计学意义(P>0.05),具有可比性。本研究经本院伦理委员会批准,所有患者知情且签署同意书。纳入标准:无自然流产史;月经周期规律。排除标准:甲状腺功能异常者;自身免疫性疾病患者;血小板增多症患者。
1.2 方法
1.2.1 采集样本及分离单核细胞 抽取两组研究对象次日清晨空腹静脉血5ml,4℃条件下经3000r/min离心5min,收集血液样本置于抗凝管内,放入-20℃冰箱内保存。采用Ficoll密度梯度离心法分离外周血单个核细胞(PBMCs),调整细胞密度为1×106个/mL。
1.2.2 实时荧光定量聚合酶链反应(Quantitative Real-time PCR,qRT-PCR)检测外周血中Foxp3 mRNA的表达水平 采用Trizol法(北京全式金生物技术有限公司)提取外周血中的总RNA。应用Nanodrop2000c超微量分光光度计检测RNA浓度与纯度。根据反转录试剂盒(北京天根生化科技有限公司)说明书操作将总RNA反转录为cDNA。Foxp3正向引物5’-CATCCGCCACAACCTGAGTC TG-3’,反向引物5’-CCTGTTCGTCCATCCTCCTT TCCT-3’;β-actin正 向 引 物5’-GCACCACACCTTCTACAATGAGC-3’,反向引物5’-GGATAGCACAGCCTGGATAGCAAC-3’,引物由上海生工生物工程股份有限公司设计合成。参照qRT-PCR试剂盒(北京天根生化科技有限公司)说明书配置反应体系,反应条件:95℃预变性2min,95℃变性15s,60℃退火30s,72℃延伸30s,共40次循环。Foxp3以β-actin为内参,采用2-ΔΔCt法计算Foxp3 mRNA的相对表达量。
1.2.3 酶联免疫吸附试验 (enzyme linked immunosorbent assay,ELISA)检测免疫细胞因子水平采用ELISA法检测免疫细胞因子白细胞介素17(interleukin-17,IL-17)、白细胞介素6(interleukin-6,IL-6)、转化生长因子-β(transforming growth factor-β,TGF-β)的水平,检测试剂盒购自上海酶联生物科技有限公司,严格按照试剂盒说明书进行操作。
1.2.4 检测Th1/Th2型细胞因子水平 采用ELISA法检测Th1/Th2型细胞因子白细胞介素2(interleukin-2,IL-2)、α干扰素(interferon α,IFN-α)、γ干扰素(interferon γ,IFN-γ)、白细胞介素4(interleukin-4,IL-4)、白细胞介素10(interleukin-10,IL-10)的水平,检测试剂盒购自北京鼎国生物科技有限公司,严格按照试剂盒说明书进行操作。
1.2.5 流式细胞术检测外周血PD-1、Tim-3的表达水平 收集PBMCs悬液100μl分别加入5μl CD14-FITC、PD-1-PE、Tim-3-PE,设置同型对照,室温避光孵育15min,加入2ml Buffer洗涤,4℃条件下经3000r/min离心10min,弃上清,加入Buffer重悬细胞500μl,应用流式细胞仪检测CD14+单核细胞上T细胞免疫球蛋白和黏蛋白结构域3(T cell immuno-globulin and mucin domain 3,Tim-3)与程序性细胞死亡分子-1(programmed death-1,PD-1)的表达,采用百分比表示。鼠抗人CD14-FITC与PD-1-PE购自美国eBioscience公司;Tim-3-PE购自美国BioLengend公司;同型对照鼠抗人IgG1-FITC/PE购自武汉艾美捷科技有限公司。
1.3 统计学处理 采用统计学软件SPSS21.0进行分析,符合正态分布的计量资料以均数±标准差()表示,两组间比较采用独立样本t检验;计数资料采用检验,采用Pearson法分析URSA患者外周血中Foxp3与免疫细胞因子、Th1/Th2型细胞因子、PD-1及Tim-3的相关性,P<0.05为差异具有统计学意义。
2 结果
2.1 两组受试者外周血Foxp3基因表达量比较与对照组比较,研究组外周血Foxp3 mRNA的表达水平显著降低(P<0.05),见表1。
表1 两组受试者外周血Foxp3基因表达量比较()

表1 两组受试者外周血Foxp3基因表达量比较()
注:与对照组比较,*P<0.05。
组别 n对照组研究组50 55 t P Foxp3 mRNA 1.00±0.20 0.52±0.15*13.991 0.000
2.2 两组受试者外周血免疫细胞因子水平比较与对照组比较,研究组外周血IL-17、IL-6水平显著升高,TGF-β水平显著降低(P<0.05),见表2。
表2 两组受试者外周血免疫细胞因子水平比较()
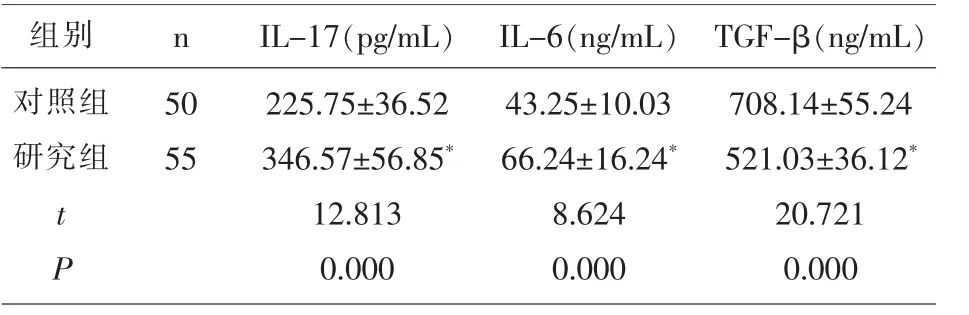
表2 两组受试者外周血免疫细胞因子水平比较()
注:与对照组比较,*P<0.05。
组别 n对照组研究组50 55 tP IL-17(pg/mL)IL-6(ng/mL)225.75±36.52 346.57±56.85*12.813 0.000 43.25±10.03 66.24±16.24*8.624 0.000 TGF-β(ng/mL)708.14±55.24 521.03±36.12*20.721 0.000
2.3 两组受试者外周血Th1/Th2型细胞因子水平比较 与对照组比较,研究组外周血IL-2、IFN-α、IFN-γ水平显著升高(P<0.05),IL-4、IL-10水平显著降低(P<0.05),见表3。
表3 两组受试者外周血Th1/Th2型细胞因子水平比较(,μg/L)

表3 两组受试者外周血Th1/Th2型细胞因子水平比较(,μg/L)
注:与对照组比较,*P<0.05。
组别 n IL-2 IFN-α IFN-γ IL-4 IL-10对照组研究组50 55 t P 4.21±0.52 8.32±1.27*21.310 0.000 5.46±1.13 30.21±5.21*32.882 0.000 503.21±46.57 695.48±46.16*21.227 0.000 26.19±3.21 11.71±2.13*27.464 0.000 28.46±3.16 16.58±3.58*17.952 0.000
2.4 两组受试者外周血PD-1、Tim-3的表达水平比较 与对照组比较,研究组外周血PD-1、Tim-3的表达水平显著降低(P<0.05),见表4。
表4 两组受试者外周血PD-1、Tim-3的表达水平比较(
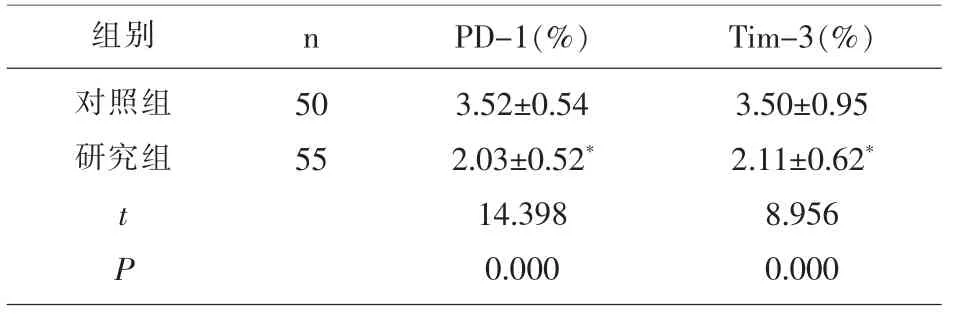
表4 两组受试者外周血PD-1、Tim-3的表达水平比较(
注:与对照组比较,*P<0.05。
组别 n对照组研究组50 55 t P PD-1(%)3.52±0.54 2.03±0.52*14.398 0.000 Tim-3(%)3.50±0.95 2.11±0.62*8.956 0.000
2.5 URSA患者外周血Foxp3与免疫细胞因子、Th1/Th2型细胞因子、PD-1及Tim-3的相关性分析 采用Pearson法分析URSA患者外周血中Foxp3与免疫细胞因子、Th1/Th2型细胞因子、PD-1及Tim-3的相关性,结果显示Foxp3与IL-17、IL-6、IL-2、IFN-α、IFN-γ呈负相关(P<0.05),而与TGF-β、IL-4、IL-10、PD-1、Tim-3呈正相关(P<0.05),见表5。
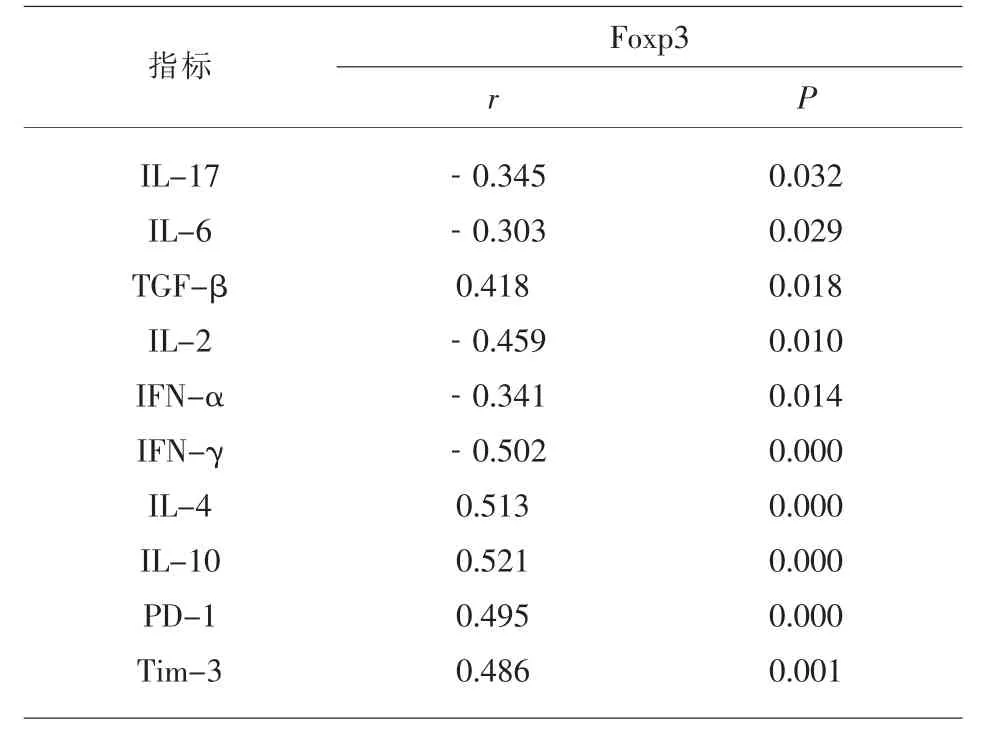
表5 Foxp3与免疫细胞因子、Th1/Th2型细胞因子、PD-1及Tim-3的相关性分析(r/P)
3 讨论
Th1/Th2、Th17/Treg等细胞因子失衡可引起免疫系统异常从而参与自身免疫性疾病等多种疾病的发生及发展过程,研究表明URSA的发生与Th17/Treg细胞失衡有关[7,8]。因而探究Foxp3基因与Th1/Th2、Th17/Treg等免疫细胞因子的相关性具有重要意义。
Foxp3基因位点多态性可增加原发性高血压发生的风险[9]。研究表明Foxp3基因表达改变可参与自身免疫性疾病的发生过程[10-12]。本研究结果显示Foxp3基因在URSA患者外周血中表达下调,提示Foxp3基因表达下调可能促进URSA的发生。研究表明Th17/Treg细胞相关因子IL-17、IL-6、TGF-β表达异常与母体及胎儿间免疫耐受、良好的妊娠结局密切相关[13]。本研究结果显示研究组患者外周血中IL-17、IL-6水平显著升高,而TGF-β水平显著降低,进一步分析显示Foxp3基因与IL-17、IL-6呈负相关,Foxp3基因与TGF-β呈正相关,说明Foxp3基因可能通过作用于IL-17、IL-6、TGF-β细胞调节URSA患者免疫抑制性。提示Foxp3基因的直接或间接调节可能是由于Th17/Treg细胞免疫功能障碍的作用,进而影响URSA患者的Th17/Treg细胞平衡。Th1/Th2型细胞失衡与妊娠状态密切相关,正常妊娠状态时母体趋向于Th2型细胞因子参与细胞免疫应答,而病理性妊娠状态时母体趋向于Th1细胞因子参与细胞免疫应答,母体Th1型细胞因子过度表达可促进自然流产的发生,Th1型细胞因子主要为IL-2、IFNα、IFN-γ,其中IL-2可增强T细胞杀伤活性并可诱导T细胞分泌IFN-α、IFN-γ等,IFN-γ还可抑制人绒毛膜外滋养层细胞的侵入从而导致胚胎着床失败[14]。Th2型细胞因子主要包括IL-4、IL-10,IL-4可影响自然杀伤细胞的应答及淋巴因子的杀伤活性,IL-10属于抗炎抑制并可参与参与机体免疫反应及炎症反应,Th2型细胞因子可抑制Th1型细胞因子的表达,研究表明Th2型细胞因子在维持正常妊娠过程中发挥重要调控作用[15]。本研究结果显示研究组患者外周血中IL-2、IFN-α、IFN-γ水平显著升高,IL-4、IL-10水平显著降低,说明妊娠刺激母体免疫系统后促使免疫系统分泌异常从而促进URSA的发生。本研究进一步分析显示Foxp3基因与IL-2、IFN-α、IFN-γ呈负相关,Foxp3基因与IL-4、IL-10呈正相关,提示Foxp3基因表达量降低可能通过引起免疫平衡失调而增加危险因子及减少保护因子从而促进URSA的发生及发展。相关报道指出PD-1、Tim-3属于T细胞负性调节因子,并可负性调节T细胞反应,Tim-3可抑制巨噬细胞活化而参与早期免疫反应,阻断Tim-3表达可降低PD-1基因表达,进一步研究显示PD-1、Tim-3在URSA患者外周血中表达量降低,并可能通过调节细胞免疫及体液免疫从而促进URSA的发生[16-19]。与上述研究结果相似,本研究结果显示研究组患者外周血中PD-1、Tim-3的表达水平显著降低,进一步分析显示Foxp3基因与PD-1、Tim-3呈正相关,提示Foxp3基因表达量降低可能通过抑制PD-1、Tim-3表达而调控细胞免疫及体液免疫从而促进URSA的发生及发展。
综上所述,URSA患者外周血中Foxp3基因表达量降低,其表达量与Th17/Treg细胞因子、Th1/Th2型细胞因子、PD-1、Tim-3密切相关,推测Foxp3基因可能通过调节细胞免疫及体液免疫而参与URSA的发生及发展过程,可为URSA的免疫治疗提供理论依据。但Foxp3基因在URSA的发生及发展过程中的作用机制尚未阐明,本研究将进一步探究Foxp3基因对URSA患者外周血单核细胞功能的影响,以期从免疫反应的启动阶段给予干预进而促使免疫反应向有利的方向发展。
