外源Ca对Cd胁迫下旱柳Cd吸收、亚细胞分布和化学形态的影响
2021-07-28薛文秀尚晓硕钟滨霞邹金华
蒋 艺,薛文秀,尚晓硕,钟滨霞,邹金华
(1.天津师范大学生命科学学院,天津300387;2.天津师范大学天津市动植物抗性重点实验室,天津300387)
镉(cadmium,Cd)是重金属污染中毒性最大、分布最广泛的污染物之一[1].Cd是植物非必需的矿物质元素,被植物根系吸收后会在植物体内进行一系列的迁移和积累,长期的Cd积累会对植物产生一定的毒害作用,过量的Cd则会导致细胞损伤,使植物生长受到抑制,形态发生改变,衰老甚至死亡.Ca是植物生长发育所必需的大量元素,不仅与植物营养器官的发育有关,而且关系到花粉萌发和果实器官的脱落[2].Ca直接参与细胞分裂过程,Ca缺乏会降低细胞分裂指数,从而影响植物生长[3].同时Ca2+在众多的第二信使中处于枢纽地位,参与真核细胞跨膜信号转导途径,细胞质内的Ca2+对细胞的生存与凋亡具有重要作用[4].相关研究表明,外源Ca对处于逆境胁迫下的植物有重要缓解作用,它可以减轻植物在低温胁迫、盐胁迫、干旱胁迫等逆境中受到的伤害[5].
柳属(Salix)植物资源丰富,对于生态环境的适应性极强,广泛分布于全世界.在我国约有200多种,分布于东北、西北和华北地区.柳树对多种重金属有较高的耐受性和累积量,并且培养周期短,易进行无性繁殖,可作为植物修复的候选物种.旱柳(Salix matsudanaL.)作为柳属常见品种,在重金属污染土壤和水体的植物修复方面具有广阔的发展前景和生态效应[6].在利用旱柳进行野外Cd污染土壤的植物修复实践中,提高Cd污染区植株的成活率和缓解Cd对植物生长发育的毒害作用至关重要.为了探究添加外源Ca对旱柳中Cd毒害的缓解作用机理,本研究利用差速离心技术、化学试剂逐级提取法及电感耦合等离子体发射光谱(ICP-AES),分析不同Cd和Ca处理条件下旱柳各器官中Cd、Fe、Mn的含量以及根、叶不同亚细胞组分和不同化学形态的Cd含量,从而为植物修复重金属污染实践提供一定的理论依据.
1 材料和方法
1.1 材料
在天津师范大学生物科技园内选取长势较好、粗细均匀的旱柳,剪取20 cm长的枝条.
1.2 方法
1.2.1 植物培养与处理
选取长势较好的旱柳短枝分成4组,每组32枝,把短枝固定在KT板上,分别放置于4个容量相同的盛有6 L自来水的培养盆(60 cm×40 cm)中进行生根培养,每隔1周更换1次自来水.水培2周后,在每盆中注入6 L的Hoagland营养液培养1周.在观察到旱柳长势一致后,设置4个处理组,每组处理设置3个重复.在每个培养盆中加入等体积(6 L)的蒸馏水,再分别加入不同量的Cd(NO3)2和CaCl2溶液,使其浓度分别为0、50 mmol/L Ca、50μmol/L Cd、50 mmol/L Ca+50μmol/L Cd.用气泵持续通气,每天观察旱柳生长情况,定期换水,处理7、14、21、28 d后对各处理组旱柳进行取材和实验.
1.2.2 旱柳各器官中Cd、Fe、Mn含量的测定
在每个时间间隔(7、14、21和28 d)从每个处理组中分别取根、茎和叶.去除坏死组织和腐烂组织后,用流水彻底清洗15 min,再用蒸馏水冲洗3次,之后用ddH2O清洗旱柳各器官表面附着的Cd和Ca离子.将根、茎和叶分别放置在培养皿中,样品在45℃下干燥3 d,在80℃下干燥1 d,在105℃下于烘箱中干燥12 h至恒重.每个样品用万分之一天平称取0.200 0 g,放置在干净烧杯中,加入5 mL浓硝酸,将烧杯放至电热板上150℃下进行湿法消化.待样品消化变白,冷却后加入2 mL高氯酸,继续加热至样品完全变干.进行消解后的样品用10%的稀硝酸溶解,转移到25 mL容量瓶中定容.每个样品重复3次.用原子吸收光谱仪(Analyst 400,美国PerkinElmer公司)测定根、茎、叶中Cd、Fe、Mn的含量.
1.2.3 旱柳根和叶亚细胞中Cd含量的测定
在处理7 d和28 d后分别取单一Cd处理组和Cd+Ca处理组中的旱柳叶片和根系,用ddH2O将样品冲洗干净并吸干表面水分.用天平准确称量待测样品4.000 g,加入20 mL组分提取液,在冰上充分研磨直至匀浆,然后转移至50 mL离心管中离心(2 000 r/min,10 min),每个处理进行3次重复.离心后分离出上清液,下层沉淀为细胞壁及破碎残渣部分.将离心提取到的上清合并后在4 000 r/min下离心15 min,再次分离出上清,上清液即为可溶性组分,所得沉淀为细胞核和叶绿体组分.以上操作均于4℃条件下进行.用湿法消化各亚细胞组分,用10%的稀硝酸定容于10 mL容量瓶,用原子吸收光谱仪测定各组分的Cd含量.
1.2.4 旱柳根、叶中Cd的化学形态分析
在处理7 d和28 d后分别取单一Cd处理组和Cd+Ca处理组中的旱柳叶片和根系,样品冲洗干净并吸干表面水分.准确称量2.000 g样品于研钵中,加入20 mL提取剂,研磨成匀浆后转移入50 mL离心管中连续浸提,于25℃恒温震荡22 h,5 000 r/min离心10 min,倒出上清液.再在离心管中加入10 mL提取剂,25℃恒温震荡1 h,5 000 r/min离心10 min,将2次上清合并.每个处理进行3次重复.依次采用5种提取剂逐步提取重金属Cd:①80%乙醇,主要是提取硝酸盐、氯化物为主的无机盐以及醇溶性蛋白质、氨基酸盐为主要形态的Cd(CdE);②ddH2O,主要提取水溶性的有机酸盐类的Cd(CdW);③1 mol/L NaCl溶液,主要提取果胶酸盐态、与蛋白质结合态或吸附态的Cd(CdNaCl);④2%醋酸,主要提取难溶于水的磷酸盐类Cd(CdHAC);⑤0.6 mmol/L盐酸,主要提取草酸盐类Cd(CdHCl);⑥其余为残留态Cd(CdR).
1.2.5 数据分析
采用SigmaPlot 12.5软件处理所有数据并作图,采用SPSS 17.0对数据进行统计学检验.
2 结果与分析
2.1 外源Ca对旱柳各器官中Cd的积累和分布的影响
添加外源Ca后,随着处理时间的延长,旱柳各器官内Cd的积累与分布情况如表1所示.
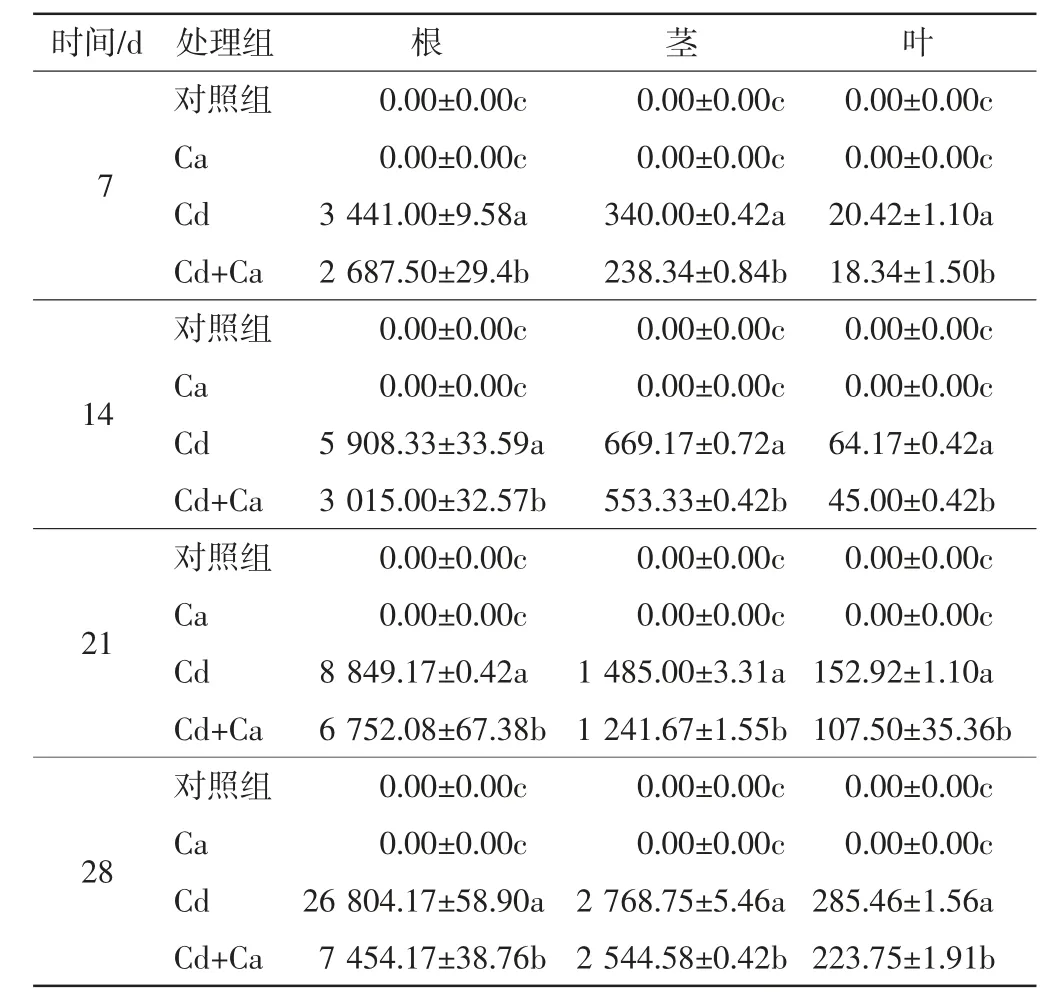
表1 不同处理组中旱柳各器官内的Cd含量Tab.1 Cd contents in different organs of S.matsudana in different treatment groups μg/g
由表1可以看出,与对照组相比,Cd处理组中旱柳各器官内的Cd含量均随处理时间的延长而增加,Cd含量表现为根>茎>叶.将Cd处理组与Cd+Ca处理组进行对比,发现在整个实验周期内Cd+Ca处理组中旱柳各器官内的Cd含量均显著低于Cd处理组中的含量(P<0.05).这些结果表明,添加外源Ca能够降低Cd胁迫下旱柳各器官的Cd含量.
2.2 外源Ca对旱柳各器官中Fe的积累和分布的影响
添加外源Ca后,随着处理时间的延长,旱柳各器官内Fe的积累与分布情况如表2所示.
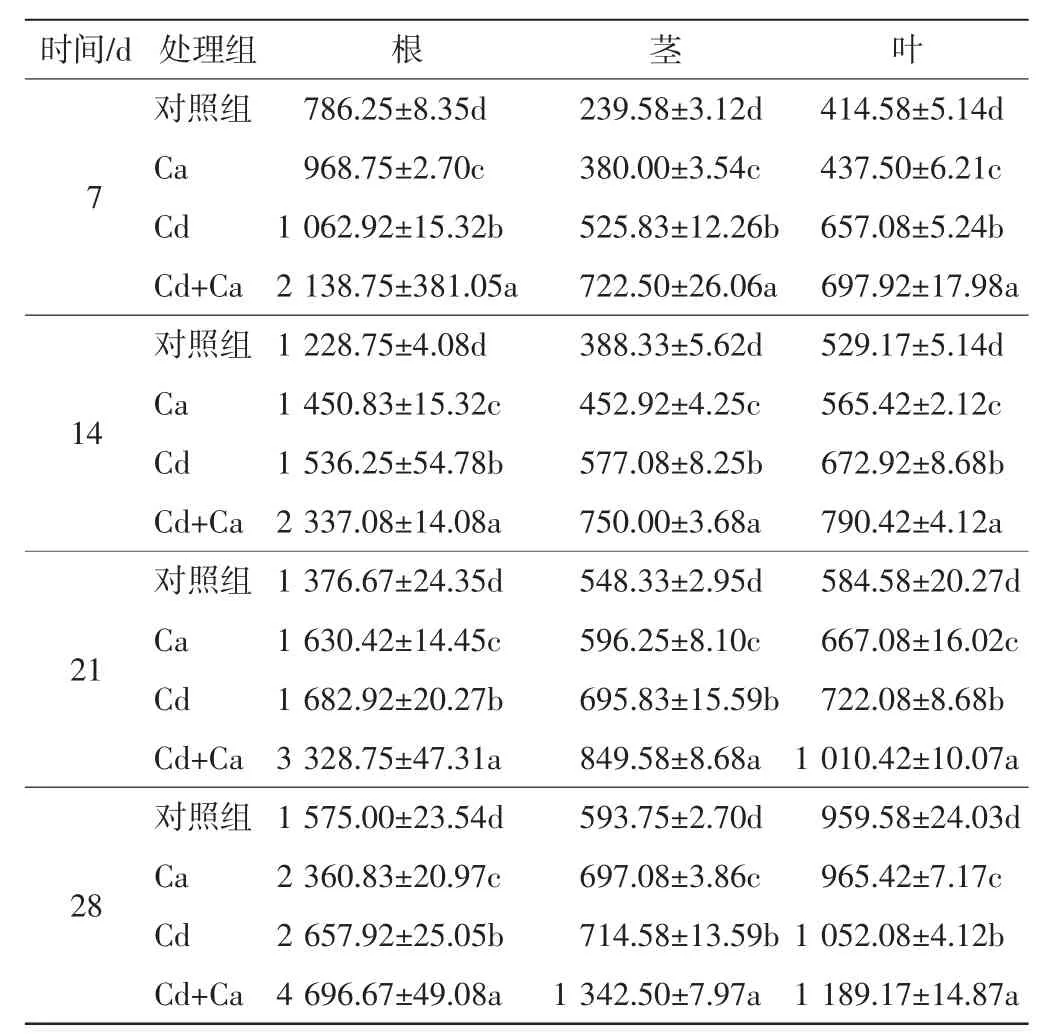
表2 不同处理组中旱柳各器官内的Fe含量Tab.2 Fe contents in different organs of S.matsudana in different treatment groups μg/g
由表2可以看出,在整个实验周期内,对照组中旱柳的Fe含量始终处于最低水平,且随着处理时间延长,Fe含量逐渐增加.外源Ca的添加提高了旱柳各器官对Fe的吸收与积累,Cd的添加也显著增加了旱柳对Fe的积累,并随着培养时间的延长,积累量逐渐增加.在Cd+Ca处理组中,旱柳各器官内Fe的积累量始终处于最高水平,且与对照组和Cd处理组之间的差异具有统计学意义(P<0.05).这些结果表明:外源Ca对Cd胁迫下旱柳各器官内Fe的吸收和积累在一定程度上有促进作用.
2.3 外源Ca对Cd胁迫下旱柳各器官中Mn的积累和分布的影响
添加外源Ca后,随着处理时间的延长,旱柳各器官内Mn的积累与分布情况如表3所示.由表3可以看出,随着处理时间的延长,对照组中旱柳的Mn含量处于稳定增长趋势;Ca处理组中旱柳各器官内Mn的含量始终显著高于对照组中的含量(P<0.05),Cd处理组中旱柳各器官内Mn的含量显著低于对照组中的含量(P<0.05),也显著低于其他处理组中的含量(P<0.05);而Ca+Cd处理组中旱柳各器官内Mn的含量显著高于Cd处理组中的含量(P<0.05).这些结果表明,Cd对旱柳吸收积累Mn元素有一定的抑制作用,而外源Ca能够缓解这种作用.
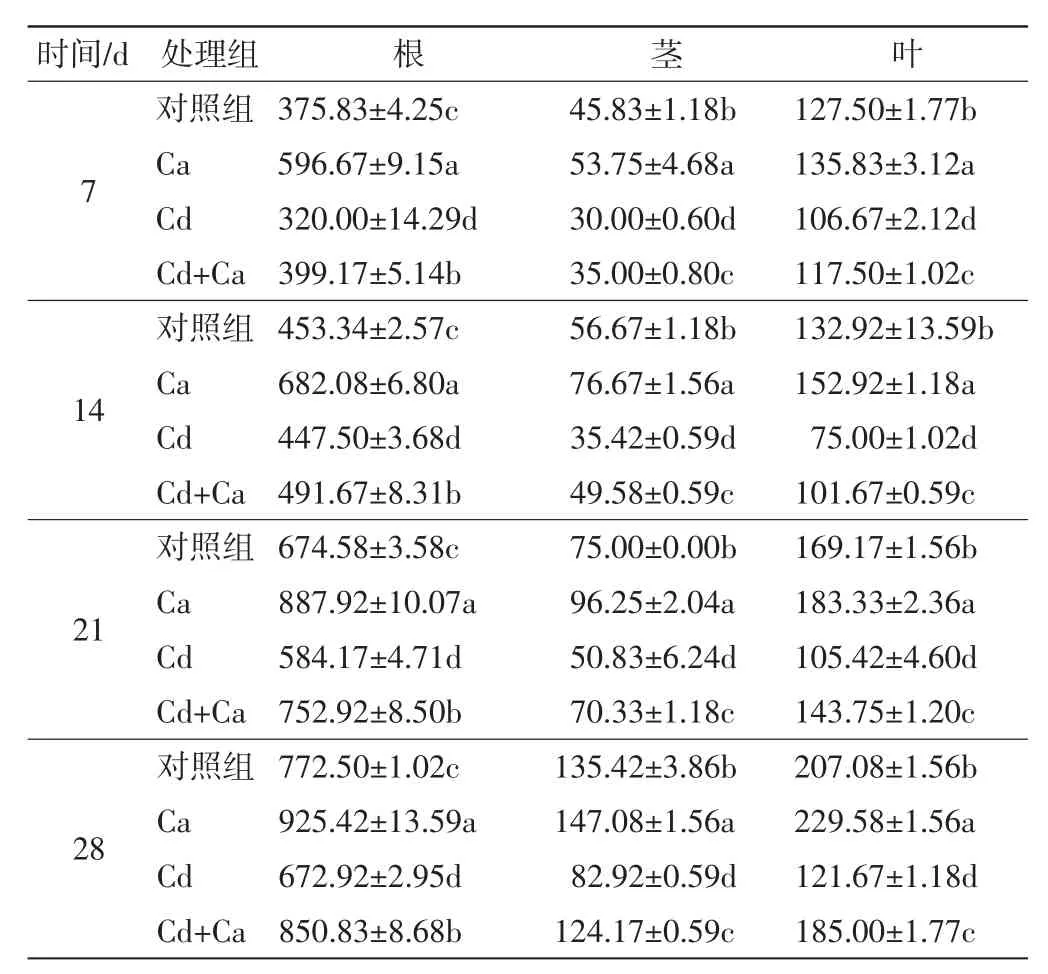
表3 不同处理组中旱柳各器官内的Mn含量Tab.3 Mn contents in different organs of S.matsudana in different treatment groups μg/g
2.4 外源Ca对旱柳根系和叶片不同亚细胞组分Cd含量的影响
不同处理组中旱柳根系和叶片亚细胞组分的Cd含量如表4所示,Cd在各亚细胞组分中所占的比例如图1所示.
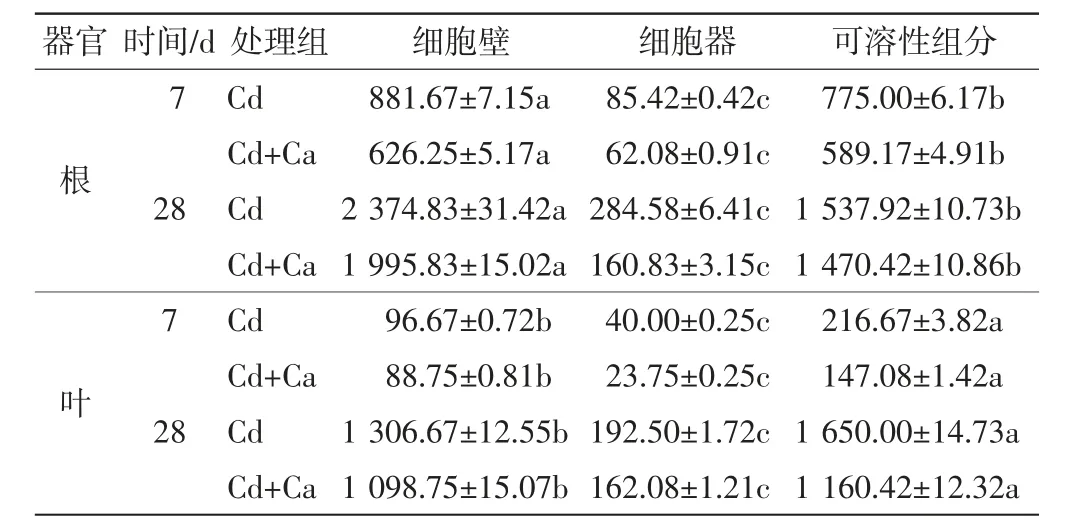
表4 不同处理组中旱柳各亚细胞组分的Cd含量Tab.4 Subcellular Cd contents in the cells of S.matsudana in different treatment groups μg/g
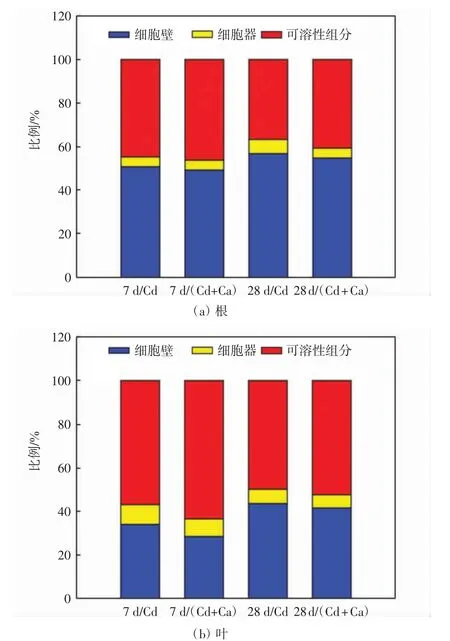
图1 不同处理组中旱柳根和叶内不同亚细胞组分中Cd所占比例Fig.1 Percentage of Cd of different subcellular components in roots and leaves of S.matsudana in different treatment groups
由表4可以看出,随着培养时间的延长,根系各亚细胞组分的Cd含量显著增加,不同亚细胞组分中Cd含量的排序为细胞壁>可溶性组分>细胞器.与Cd处理组相比,Cd+Ca处理组中根系各亚细胞组分的Cd含量均显著降低(P<0.05).由图1(a)可以看出,与Cd处理组相比,Cd+Ca处理组中根系可溶性组分Cd所占比例较高(P<0.05),而细胞壁组分和细胞器组分的Cd所占比例较低(P<0.05).旱柳叶片中各亚细胞组分的Cd含量也随着培养时间的延长显著增加,不同亚细胞组分中Cd含量的排序为可溶性组分>细胞壁>细胞器.在处理7 d和28 d时,Cd处理组各亚细胞组分的Cd含量均显著高于Cd+Ca处理组的含量(P<0.05).由图1(b)可以看出,与Cd处理组相比,Cd+Ca处理组中可溶性组分的Cd所占比例较高(P<0.05),而细胞壁组分和细胞器组分的Cd所占比例则较低(P<0.05).综上所述,添加外源Ca后,旱柳根和叶片各亚细胞组分的Cd含量显著降低(P<0.05),且各亚细胞组分Cd所占比例出现了变化,即可溶性组分Cd所占比例增加,而细胞壁组分和细胞器组分Cd所占比例下降.
2.5 外源Ca对旱柳根和叶细胞内Cd不同化学形态的影响
不同处理组中旱柳根、叶不同化学形态的Cd含量如表5所示.在整个实验过程中,根系不同化学形态的Cd含量显著高于叶片中的含量(P<0.05);在根和叶中NaCl提取态的Cd含量始终处于最高水平,醋酸和盐酸提取态Cd含量次之,再次是水溶态Cd含量和乙醇提取态Cd含量,残留态Cd含量始终处于最低水平.添加外源Ca后,Cd+Ca处理组中各化学形态的Cd含量均显著低于Cd处理组的含量(P<0.05),NaCl提取态Cd含量仍在各提取态之中占主要地位,醋酸和盐酸提取态Cd含量次之.Ca对不同化学形态Cd的吸收抑制作用存在差异,不同处理组中根和叶不同化学形态的Cd所占比例如图2所示.由图2可以看出,不论是单一Cd处理组还是Ca+Cd处理组,根和叶片中的NaCl提取态Cd所占的比例均随着培养时间的延长下降,醋酸提取态和盐酸提取态Cd的比例增加.同单一Cd处理组相比,添加外源Ca后,根和叶片中NaCl提取态Cd的比例增加,醋酸提取态和盐酸提取态Cd的比例降低.
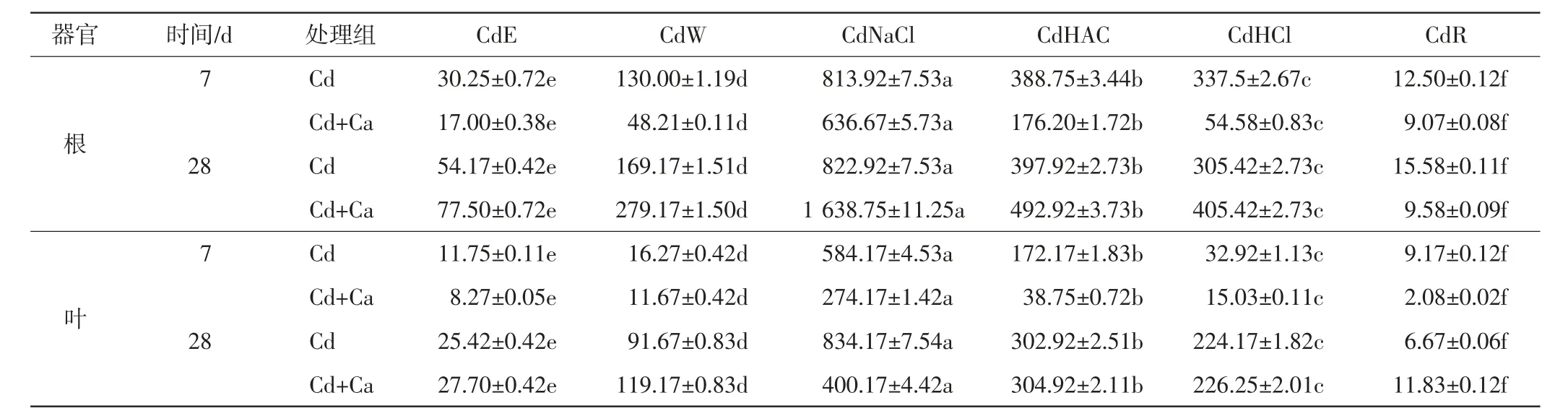
表5 旱柳根系和叶片细胞内不同化学形态的Cd含量Tab.5 Cd contents of different chemical forms in cells of root and leaves of S.matsudana μg/g

图2 不同处理组旱柳根和叶中不同化学形态的Cd所占比例Fig.2 Percentage of Cd of different chemical forms in roots and leaves of S.matsudana in different treatment groups
3 讨论与结论
Cd是生物毒性最强的重金属元素之一[7],迁移性很强,且极易被植物吸收并积累.Cd在植物体内积累的量和存在部位因植物种类不同而存在差异.本研究发现在旱柳3种营养器官中Cd的积累水平为根>茎>叶,旱柳中Cd主要富集在根部,Cd胁迫下旱柳各个器官的Cd含量均随培养时间的延长而升高.该结果与欧阳洁等[8]的研究结果一致.在外源Ca添加后,旱柳各器官的Cd含量均显著降低,并且随着处理时间的延长Ca对Cd吸收的抑制作用更加明显.外源Ca能缓解Cd的毒害是因为Ca与Cd具有相似的化学性质,当环境中同时存在Ca和Cd时,由于二者存在竞争关系,使得Ca可以显著降低植物对Cd的吸收与积累,从而减轻Cd的毒害作用[9].Cd元素的存在会影响植物体对矿质元素的摄取,引发体内微量元素代谢失衡.本研究中旱柳对Cd的吸收积累影响了植物对Fe和Mn的吸收.Fe是植物体进行光合作用、生物固氮和呼吸作用中的细胞色素和非血红素铁蛋白的组成成分.本研究结果显示,Cd胁迫下旱柳体内Fe含量显著增加,这可能与植物体内的离子运输机制有关.Kovács等[10]认为,Fe离子可能与Cd离子竞争相同的植物细胞膜结合(运输)位点,足够的Fe离子供应会减轻植物对Cd的吸收,这可能是植物应对Cd胁迫做出的适应性反应.Cd胁迫能够促进旱柳对Fe离子的吸收和积累,但会抑制对Mn的吸收和积累,这与孙盛等[11]对黄瓜幼苗的研究结果一致.Mn是植物体内重要的矿物质元素,在植物生长过程中起到重要作用.外源Ca的添加能够显著促进旱柳对Fe和Mn的吸收与积累.
植物细胞壁主要由半纤维素、纤维素、果胶以及蛋白质等组成,纤维素和半纤维素是细胞壁中主要的结构性多糖,起到维持细胞形状以及抗压的作用[12].半纤维素中含有大量的羧基、羰基、巯基等官能团[13],对Cd具有较强的络合与螯合能力.旱柳根系中Cd的富集可能是因为Cd大量沉淀在细胞壁上,从而减弱了Cd对细胞器等生命活动核心组件物质的毒害作用,是旱柳根系细胞缓解Cd毒害作用的解毒机制之一.Liu等[14]、Zare等[15]也指出,植物根系细胞壁对重金属具有一定的沉积作用,是重金属进入植物体的第一道屏障,也是重金属的主要蓄积场所.在旱柳叶片细胞中可溶性组分的Cd含量始终最高,说明叶细胞中可溶性组分是Cd富集的主要部位.植物的可溶性组分由细胞质和液泡组成,细胞质是细胞进行新陈代谢的主要场所,而液泡的功能主要是参与细胞水分代谢,液泡中含有的多种蛋白质、有机酸、有机碱等物质都能与Cd结合[16],即液泡区室化也是植物抵抗重金属毒害和参与重金属解毒的重要机理之一.与单一Cd处理相比,在外源Ca添加后旱柳叶细胞壁组分和细胞器组分中的Cd含量均下降,而可溶性组分中的Cd含量上升,说明添加Ca可能启动了植物体内的钙信号,引发植物产生一系列的生物化学反应,液泡区室化承担了更大的Cd解毒作用[17].
在旱柳根系和叶片中不同化学形态的Cd含量均表现出CdNaCl>CdHAC>CdHCl>CdW>CdE>CdR,即Cd主要赋存的化学形态为NaCl提取态、醋酸提取态和盐酸提取态,水溶态、乙醇提取态和残渣态含量较少.NaCl提取态的Cd占优势,这与游少鸿等[18]在香蒲中的研究结果一致.林晓燕等[19]研究发现NaCl提取态的Cd主要是能与蛋白质结合的呈吸着态的Cd,这表明进入植物体内的Cd多与一些螯合蛋白质(如金属硫蛋白、植物螯合肽等一些富含巯基的蛋白质)相结合,这主要是因为这些蛋白质中的巯基与Cd离子之间有很强的亲和力.在外源Ca添加后,与单纯Cd处理相比,NaCl提取态的Cd比例增加,而醋酸提取态和盐酸提取态Cd比例降低,这也表明添加外源Ca可能启动了植物体内的钙信号,促进富含巯基蛋白的表达以及Cd与这些蛋白的结合,从而降低Cd对旱柳的毒害作用.
综合上述结果,对Cd胁迫下的旱柳添加外源Ca,确实能够通过降低各器官的Cd含量、调整各亚细胞组分Cd含量和Cd化学形态的方式,缓解环境中的Cd对旱柳的毒害作用.
