抑制miR-21-5p表达通过靶向FOXP2调控肺癌细胞增殖和凋亡
2021-07-27崔艳红张轩斌赵江金博李克芳张伟杰
崔艳红 张轩斌 赵江 金博 李克芳 张伟杰
(1南阳市中心医院呼吸内科二病区,河南 南阳 473000;2郑州大学第一附属医院肿瘤一科)
肺癌的发病率和死亡率呈逐年上升趋势,对患者及社会造成严重的威胁〔1〕。微小RNA(miRNA)是一类广泛存在的内源性非编码RNA,参与细胞的增殖、分化、凋亡等重要病理生理过程〔2〕。越来越多的研究证明,miRNA与肿瘤细胞的增殖、凋亡有密切联系,全基因组表达谱系显示,miR-21在结肠癌、乳腺癌、肺癌、胃癌等肿瘤组织中高表达,且可增强淋巴瘤细胞迁移能力〔3~5〕。研究显示,下调miR-21的表达,可抑制肺癌H460细胞的生长,增加细胞的凋亡〔6〕。与正常乳腺组织相比,叉头蛋白P2抗体(FOXP2)在乳腺癌组织中的表达显著降低,可抑制乳腺癌细胞的迁移和侵袭〔7〕。但FOXP2在肺癌细胞中的表达及其对肺癌细胞增殖和凋亡的影响未见报道,且miR-21-5p是否靶向调控FOXP2的表达影响肺癌细胞的增殖和凋亡目前还尚未可知。故本研究通过分子生物学技术探究miR-21-5p、FOXP2在肺癌细胞中的表达及其靶向关系,为临床分子靶向治疗提供理论依据。
1 材料与方法
1.1试剂与仪器 肺癌细胞株A549、NCl-H460、H1299、正常肺上皮细胞BEAS-2B均购自中国科学院上海细胞库;Trizol试剂盒、LipofectamineTM2000转染试剂均购自美国Invitrogen公司;胎牛血清、DMEM培养基均购自美国Gibco公司;荧光定量试剂盒购自大连TaKaRa公司;FOXP2、细胞周期蛋白(Cyclin)D1、p21、p27、GAPDH一抗均购自美国Abcam公司;B细胞淋巴瘤(Bcl)-2、Bcl-2相关X蛋白(Bax)、酶切含半胱氨酸的天冬氨酸蛋白水解酶(caspase)3一抗均购自美国CST公司;荧光素酶活性试剂盒购自Promega公司。
1.2实验方法
1.2.1细胞的培养及模型的建立 肺癌细胞株A549、NCl-H460、H1299及正常肺上皮细胞BEAS-2B在含有10%胎牛血清的DMEM培养基,5%CO2、37℃条件培养箱中传代培养。
1.2.2实时荧光定量-聚合酶链反应(qRT-PCR)检测miR-21-5p、FOXP2的表达 肺癌细胞株以5×104个/ml接种于6孔板中常规培养24 h,收集细胞,Trizol提取总RNA,检测RNA的浓度和纯度;反转录为cDNA进行qRT-PCR,qRT-PCR程序为95℃ 2 min,95℃ 15 s,60℃ 20 s,72℃ 20 s,共40个循环;反应体系为20 μl:2×SYBR Mix10 μl,上下游引物各0.5 μl,10×cDNA模板1 μl,H2O 8 μl。引物序列:miR-21-5p:正义链5′-GTGCAGGGTCCGAGGT-3′,反义链5′-GCCGCTAGCTTATCAGACTGATGT-3′;U6:正义链5′-CTCGTTCACGAATTTGCCT-3′,反义链5′-TCACGAATTTGCGT-3′;FOXP2:正义链5′-GGTCATGACCCCTGATTAGG-3′,反义链5′-AGTCCTCTAGAGGCTTCAT-3′;β-actin:正义链5′-CAG CGA CAC CCA CTC CTC-3′,反义链5′-TGA GGT CCA CCA CCC TGT-3′。分别以U6、β-actin为miR-21-5p、FOXP2的内参基因计算相对表达量。
1.2.3Western印迹检测蛋白表达情况 肺癌细胞株以5×104个/ml接种于6孔板中贴壁培养24 h,收集细胞,RIPA裂解液冰上裂解5 min提取总蛋白,测定总蛋白浓度,蛋白与样品缓冲液混合后煮沸5 min变性蛋白;10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)跑胶,转膜至聚偏氟乙烯(PVDF)膜,5%脱脂奶封闭1.5 h;一抗4℃孵育过夜,TBST清洗3次/5 min;稀释二抗室温孵育1 h,TBST清洗3次/5 min;ECL显影液显影,GIS凝胶成像仪采集图片,以GAPDH为内参计算蛋白表达水平。
1.2.4双荧光素酶实验检测miR-21-5p 对FOXP2的影响 扩增FOXP2基因的转录本3′UTR,构建野生型FOXP2-3′UTR(WT-pGL3-FOXP2 3′UTR)质粒;采用定点突变技术,将3′UTR上的与miRNA结合的核心区域突变构建突变型FOXP2-3′UTR(MUT-pGL3-FOXP2-3′UTR)质粒;将两种质粒分别转染至肺癌细胞,转染48 h后检测荧光强度。
1.2.5细胞转染 转染前24 h将细胞接种于24孔板中,使细胞贴壁密度约80%。设计并合成miR-21-5p mimic、anti-miR-21-5p及其对应阴性序列,使用lip2000将合成序列分别转染肺癌细胞,空白对照(NC)组不做任何处理,无血清DMEM培养6 h,换完全培养基培养18 h后进行功能试验,并继续培养筛选稳定低表达miR-21-5p的细胞株。
设计并退火获得si-con、si-FOXP2、pcDNA-con、pcDNA-FOXP2的shRNA序列,由吉凯公司进行慢病毒包装,并进行滴度测定;添加相应的慢病毒于完全培养基中转染生长状态良好的细胞,培养箱中培养24 h换液,筛选稳定过表达或干扰FOXP2的细胞,NC组不做任何处理;另外在稳定低表达的miR-21-5p的基础上沉默FOXP2基因,获得稳定低表达FOXP2 的anti-miR-21-5p+si-FOXP2细胞株。
1.2.6四甲基偶氮唑蓝(MTT)比色法检测细胞增殖情况 2.5%胰蛋白酶消化肺癌细胞,调整细胞浓度为2×104个/ml,接种于6孔板中,分别转染miR-21-5p mimic、anti-miR-21-5p、pcDNA-FOXP2及其阴性序列或共转染anti-miR-21-5p、si-FOXP2;转染48 h后弃去旧培养基,加入MTT 20 μl 混匀,培养4 h;然后每孔加DMSO溶液100 μl 混匀,培养15 min;采用酶标仪检测吸光值,每组3个复孔。
1.2.7流式细胞仪检测细胞凋亡 转染后A549细胞培养48 h后,弃去培养基,磷酸盐缓冲液(PBS)清洗2次;加入500 μl 1×结合缓冲液,5 μl Annexin V-FITC,避光孵育15 min;加入2.5 μl PI,孵育5 min,流式细胞仪检测细胞凋亡情况。
1.3统计学方法 采用SPSS22.0软件进行t检验、单因素方差分析。
2 结 果
2.1miR-21-5p和FOXP2在肺癌细胞和正常肺上皮细胞中的表达 与正常肺上皮细胞BEAS-2B比较,肺癌细胞株A549、NCl-H460、H1299中miR-21-5p表达水平均显著升高,FOXP2 mRNA及蛋白水平均显著降低(均P<0.05),见图1、表1。选择A549细胞进行后续实验。

图1 FOXP2蛋白表达

表1 miR-21-5p和FOXP2在肺癌细胞和正常肺上皮 细胞中的表达
2.2miR-21-5p靶向调控FOXP2的表达 生物信息学软件预测显示,miR-21-5p与FOXP2 3′UTR存在碱基互补序列见图2,双荧光素酶报告实验显示,miR-21-5p组WT-FOXP2表达水平显著低于miR-NC组(P<0.001),见表2。提示miR-21-5p与FOXP2 3′UTR区域特异性结合。Western印迹进一步证实miR-21-5p对FOXP2的影响,miR-21-5p组FOXP2蛋白表达水平(0.29±0.03)显著低于miR-NC组(0.62±0.06),anti-miR-21-5p组FOXP2蛋白表达水平(0.94±0.08)显著高于anti-miR-NC组(0.61±0.05,均P<0.05),见图3。进一步证实了 miR-21-5p可与FOXP2结合负向调控FOXP2水平。
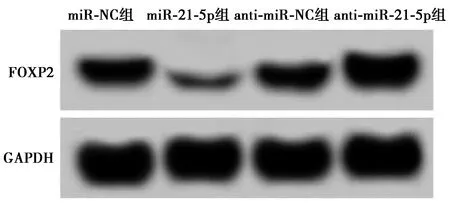
图3 miR-21-5p靶向调控FOXP2的表达

表2 双荧光素酶报告实验
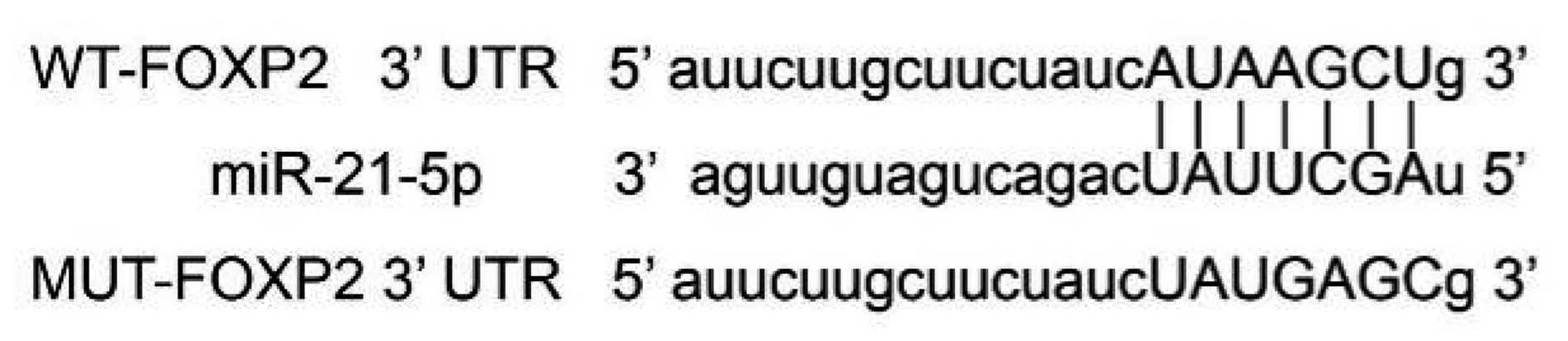
图2 FOXP2的3′UTR中含有与miR-21-5p互补的 核苷酸序列
2.3抑制miR-21-5p表达对肺癌A549细胞增殖的影响 与anti-miR-NC组比较,anti-miR-21-5p组miR-21-5p水平显著降低,48 h、72 h OD值显著降低,CyclinD1蛋白水平显著降低,p21、p27蛋白水平显著升高(均P<0.05)。见图4、表3。

图4 增殖相关蛋白表达

表3 抑制miR-21-5p表达对肺癌A549细胞增殖的影响
2.4抑制miR-21-5p表达对肺癌A549细胞凋亡的影响 与anti-miR-NC组比较,anti-miR-21-5p组细胞凋亡率显著升高,Bcl-2蛋白水平显著降低,Bax、酶切caspase3蛋白水平显著升高(均P<0.05)。见图5、表4、图6。

图5 凋亡相关蛋白表达

表4 抑制miR-21-5p表达对肺癌A549细胞凋亡的影响
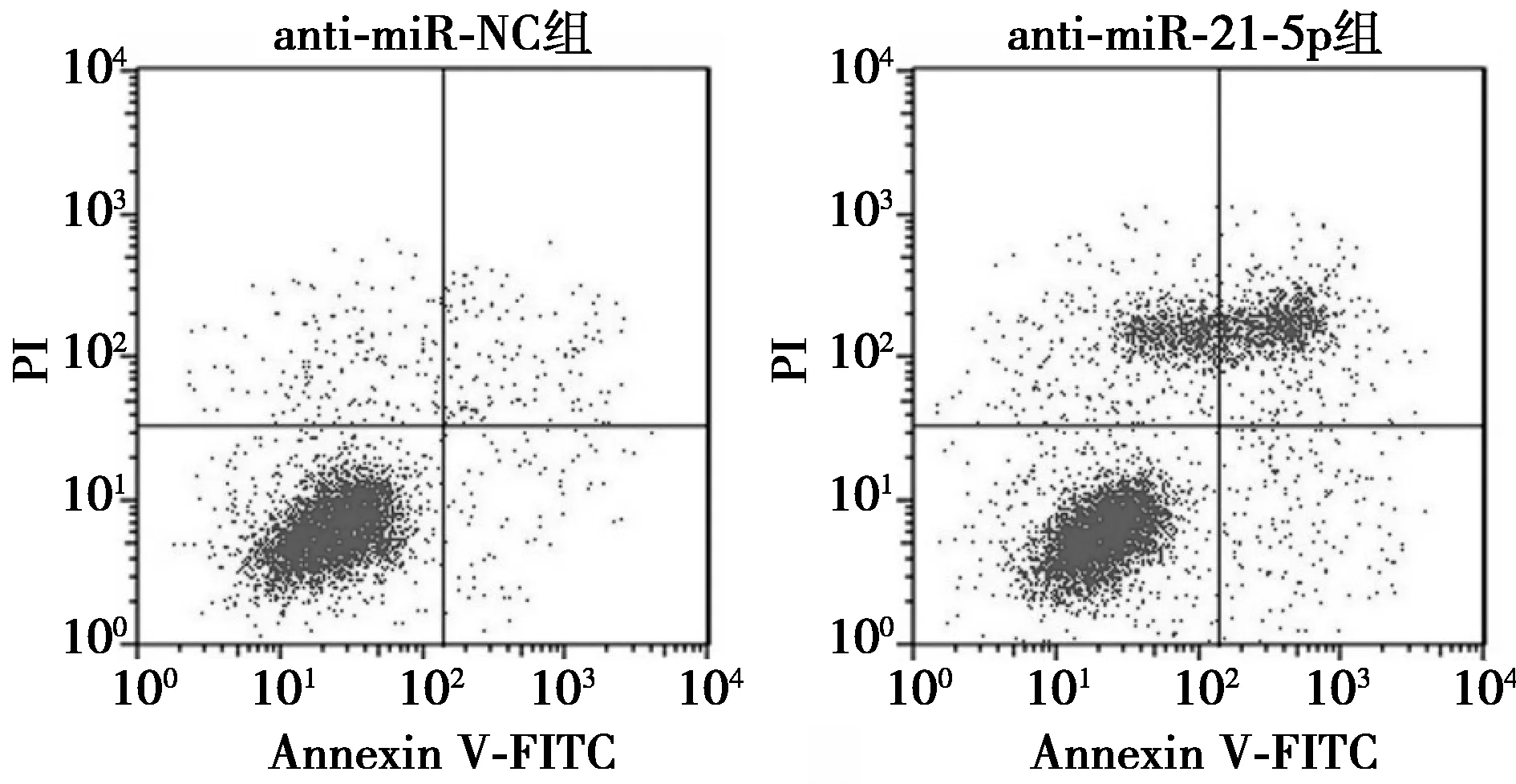
图6 抑制miR-21-5p表达对肺癌A549细胞凋亡的影响
2.5FOXP2过表达对肺癌A549细胞增殖和凋亡的影响 与pcDNA组比较,pcDNA-FOXP2组FOXP2水平显著升高,48 h、72 h OD值显著降低,CyclinD1蛋白水平显著降低,p21蛋白水平显著升高(均P<0.05);流式细胞仪检测细胞结果显示,与pcDNA组比较,pcDNA-FOXP2组细胞凋亡率显著升高,Bcl-2蛋白水平显著降低,Bax蛋白水平显著升高(P<0.05)。见图7、表5。

图7 FOXP2和增殖、凋亡相关蛋白表达

表5 FOXP2过表达对肺癌A549细胞增殖和凋亡的影响
2.6干扰FOXP2表达逆转了抑制miR-21-5p表达对肺癌A549细胞增殖和凋亡的作用 与anti-miR-21-5p+si-NC组比较,anti-miR-21-5p+si-FOXP2组FOXP2水平显著降低,48 h、72 h OD值显著升高,细胞凋亡率显著降低,CyclinD1、Bcl-2蛋白水平显著升高,p21、Bax蛋白水平显著降低(均P<0.05)。见图8、表6。
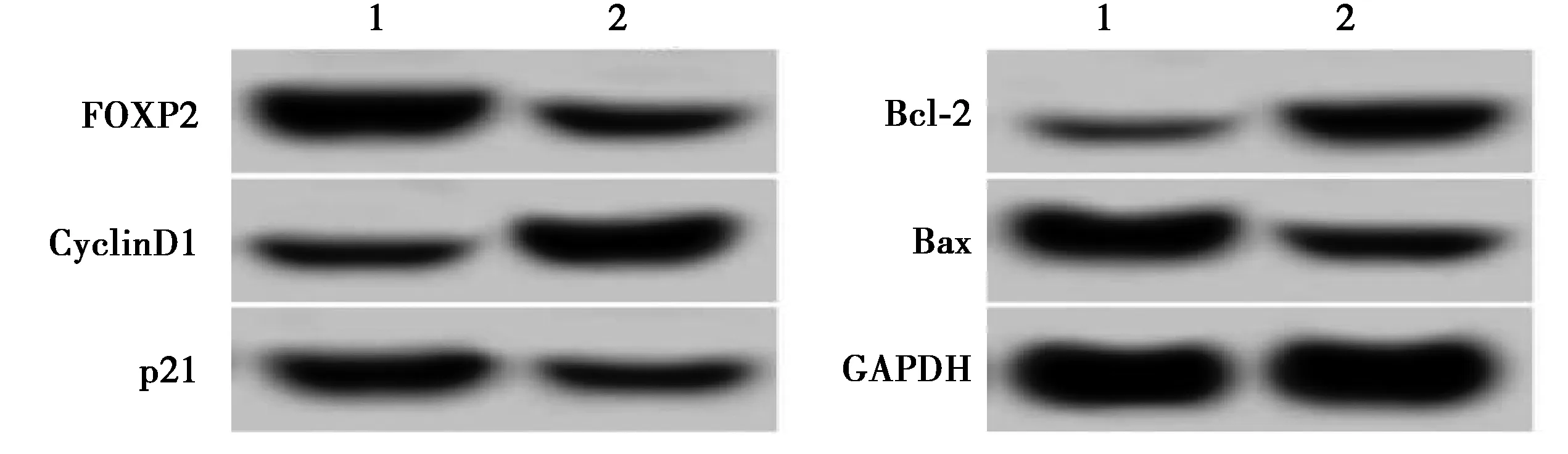
1~2:anti-miR-21-5p+si-NC组、anti-miR-21-5p+si-FOXP2组图8 FOXP2和增殖、凋亡相关蛋白表达

表6 干扰FOXP2表达逆转了抑制miR-21-5p表达对肺癌A549细胞增殖和凋亡的作用
3 讨 论
miRNA广泛存在与真核生物中,其通过与靶基因mRNA 的 3′UTR区域结合,抑制mRNA的翻译,调控基因的表达〔8〕。miR-21已被证明与多种癌症的发生相关,非小细胞肺癌组织中miR-21表达显著高于配对癌旁组织,与非小细胞肺癌的发生、转移密切相关〔9〕。MiR-21在肺癌细胞HBE、H460、A549和H446中高表达,抑制MiR-21的表达,细胞增殖率下降〔10〕。本研究结果提示miR-21-5p是肺癌发生、发展过程中的关键因子。
研究显示,miR-21参与多种癌症的进展,如胃癌、结肠癌、肾细胞癌、食管癌等,其在多种癌症中表达上调〔11~13〕。miR-21在胆管癌细胞中表达升高,miR-21通过抑制PECK的表达促进胆管癌细胞的侵袭能力〔14〕。miR-21在肺癌NCI-H446细胞中高表达,抑制miR-21的表达可增加细胞凋亡率〔15〕。本研究结果提示miR-21-5p在肺癌A549细胞中可能促进细胞的增殖、抑制细胞凋亡,促进肺癌的发展。另外还发现,抑制miR-21-5p表达后,FOXP2水平显著升高,提示miR-21-5p可能与FOXP2表达相关。本研究提示miR-21-5p可能调控FOXP2的表达,miR-21-5p可通过与FOXP2 3′UTR区域直接结合负性调控FOXP2的表达。
miR-494-3p在肿瘤细胞的增殖、迁移、侵袭、凋亡等过程中发挥重要作用〔16〕。FOXP2在胃癌细胞中显著低表达〔17〕。FOXP2在胰腺癌组织中下调表达,miR-23a通过调控FOXP2的表达促进胰腺癌细胞的增殖和侵袭〔18〕。乳腺癌中敲除FOXP2基因促进乳腺癌细胞的增殖、肿瘤的发生和转移,FOXP2表达水平的降低是恶性临床乳腺癌的显著特征,与患者生存率低显著相关〔19〕。FOXP2 通过调控AKT信号通路抑制肝细胞癌增殖〔20〕。本研究提示过表达FOXP2可抑制细胞的增殖,促进细胞的凋亡;抑制FOXP2的表达可部分逆转低表达miR-21-5p对肺癌细胞的增殖抑制、凋亡促进作用,FOXP2在肺癌细胞中低表达,发挥抑制细胞增殖和凋亡的作用。
