宫腔镜下宫颈锥切术在宫颈锥切术后宫颈上皮内瘤变中的应用价值
2021-07-24效小莉付凤仙
效小莉 付凤仙
(航天中心医院妇产科,北京 100049)
宫颈上皮内瘤变(cervical intraepithelial neoplasia,CIN)有发展为宫颈浸润癌的风险,高级别宫颈鳞状上皮内病变(high-grade squamous intraepithelial lesion,HSIL)目前首选的治疗方案为宫颈锥切术,锥切方式主要包括宫颈冷刀锥切术(cold knife conization,CKC) 和宫颈环形电切除术(loop electrosurgical excision procedure,LEEP),能够起到明确诊断和治疗的双重作用[1]。对于一些宫颈锥切术后患者,由于宫颈阴道部明显短缩,甚至完全消失,再次手术困难,手术范围相对不足,且发生副损伤风险高。随着医疗技术水平的提高及患者对生活质量要求的提高,疾病的治疗逐渐个体化、微创化,对具有二次宫颈手术指征的患者,如何选择一种安全、有效、简单微创的治疗方案,是我们主要探索的方向。2017 年1 月~2019 年12 月我科对54 例有宫颈锥切术史的CIN 行宫腔镜下宫颈锥切术(transcervical resection of cervical lesion,TCRC),报道如下。
1 临床资料与方法
1.1 一般资料
本组54 例,年龄28~75 岁,(50.9 ±3.5)岁。31 例首次宫颈锥切术后定期复查诊断CIN,19 例首次宫颈锥切术后因接触性出血阴道镜活检诊断CIN,4 例CINⅢ锥切术后切缘阳性。生育期16 例(CIN2 6 例,CIN3 10 例);围绝经期8 例(CIN1 1例,CIN3 7 例);绝经后30 例(CIN1 14 例,CIN2 16例),绝经时间1~25 年,中位绝经时间8 年。本次手术距离上次锥切手术(76 ±5)月。38 例上次手术采用LEEP,16 例采用CKC,其中CIN3 宫颈锥切术后切缘阳性4 例。CIN1 15 例,CIN2 22 例,CIN3 17例。54 例术前均进行HPV 分型检测,高危型HPV感染44 例(单一亚型感染39 例,混合型感染5 例),高危型HPV 阴性10 例。54 例术前接受液基薄层细胞学检查(thinprep cytologic test,TCT),异常45例。54 例阴道镜下宫颈病理为CIN1~3。
病例选择标准:既往因CIN1~3 行宫颈LEEP或CKC,妇科内诊宫颈阴道部明显短缩,甚至与阴道穹隆无明显界限,宫颈阴道部长度仅0~0.5 cm,再次实施LEEP 或CKC 困难。
1.2 方法
1.2.1 器械 Olympus 公司4.5 mm F27被动式可旋转连续灌流宫腔30°检查镜及8.5 mm 宫腔12°电切镜,设置切割功率为140 W,凝固功率为100 W;超声诊断仪T2600 实时线阵超声仪及PT3000 扇扫超声仪(中国通用电气医疗系统有限公司,探头频率7.5 Hz) 。
1.2.2 手术方法
1.2.2.1 TCRC 术前30 min 静脉推注间苯三酚注射液80 mg,膀胱截石位。静脉全身麻醉。腹部超声检查了解膀胱适度充盈后常规消毒铺巾,暴露宫颈。术前于宫颈阴道涂抹5% 卢戈碘液,判断移行带及病灶范围。手术开始时宫颈旁4 或8 点处缓慢注射间苯三酚注射液40 mg(刺入约1.5 cm,抽吸无回血后),持续时间0.5 min。设置膨宫压力为80~100 mm Hg,灌流液为0.9% 生理盐水,流速260 ml/min。腹部超声监护下,无须扩宫,4.5 mm 宫腔检查镜镜体在膨宫液的冲注引导直视下从子宫颈外口插入,如果宫腔检查镜镜体难以进入宫颈管,在腹部超声监护引导下探针进入宫颈管及宫腔,且逐步扩张宫颈管(从4~6 号扩宫棒) 。全面检查宫颈鳞柱交界处及宫颈管,继续将镜体插入宫腔,观察宫腔情况。检查完毕后逐步扩张宫颈管至11 号扩宫棒,置入宫腔电切镜,将可疑子宫内膜病变从宫腔内切除,然后自宫颈6 点位开始,顺时针方向用环状电极自组织学内口向外,环形切除包括鳞柱交接区的宫颈组织,终止于病变外缘3~5 mm 处,直至完成锥高20~30 mm 多条状宫颈锥形切除,切割深度及范围根据病变深浅、范围而不同。在切割创面出血处电凝止血,按照切除宫颈组织的位置(1~12点)分点送组织病理学检查。
1.2.2.2 全子宫切除术 对于有病灶残留高危因素,特别是年龄较大无生育要求者,且自身条件不适合再次行锥切术(处于围绝经期、绝经后、合并子宫其他病变需要切除子宫)行全子宫切除术[2]。
1.3 术后随访
常规妇科检查,注意宫颈创面的愈合情况,TCT、HPV 核酸分型检测。随访间隔时间:术后2~3 个月第1 次复查,之后每3~6 个月复查1 次,根据随访结果决定下一步处理方案及随访间隔时间,如持续无异常,随访间隔可延长至6~12 个月1 次,2 年后仍持续无异常则回归到正常女性随访队列。随访过程中若出现细胞学异常,或高危型HPV 持续感染,再次行阴道镜下宫颈活检,送检病理以明确诊断。
1.4 手术治疗结果判断
以活检病理、宫颈锥切病理、TCRC 病理及全子宫切除病理中最高的病变级别作为最终诊断。术后6 个月内细胞学结果正常为治愈;术后6 个月内细胞学结果异常,活检病理CIN1~3 为残留;术后无CIN 残留,但术后6 个月后细胞学结果异常,活检病理证实异常为复发[3]。术前HPV 阳性者为感染,术后HPV 复查阴性者为转阴。宫颈锥切术后病理结果变化的判定:宫颈锥切术后病理升级是指锥切术后病理结果较阴道镜下活检病理结果严重;未升级是指宫颈锥切术后病理检查结果较阴道镜下活检病理结果轻微或无变化[4]。
2 结果
2.1 围手术期情况
手术过程均顺利,术中无子宫穿孔、宫腔假道形成、前列腺电切综合征、膀胱直肠损伤等并发症发生,术后无感染及宫颈出血。手术操作时间(14.3 ±2.2)min,术中出血量(4.8 ±1.4)ml。切除宫颈组织长度20~30 mm,平均25.9 mm。术后未行阴道填塞纱布,围手术期经过顺利,术后2~3 d顺利出院。
2.2 术前后病理情况
术前 CIN 分级与 TCRC 术后病理见表1。TCRC 术后病理与术前活检病理相比未升级51 例,因宫颈病变的诊断标准为以最重的病理结果为诊断,术前病理与术后病理符合率为94.4%(51/54),见表2。
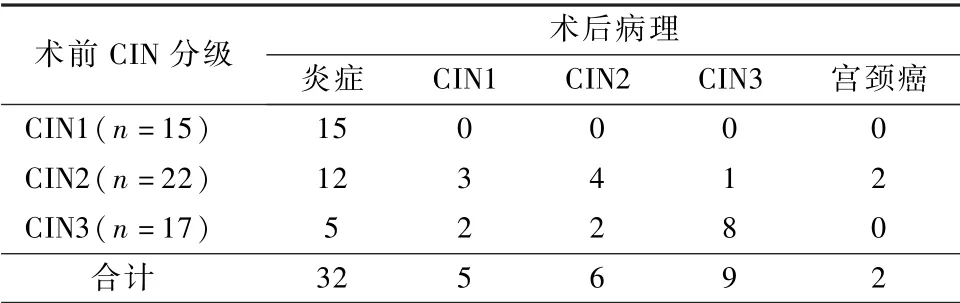
表1 54 例TCRC 术后病理情况

表2 54 例术前CIN 分级与TCRC 术后病理
2.3 术前后HPV 情况
47 例术后12 个月HPV 分型检测:HPV16 型持续感染1 例,2 例HPV16 型转为其他12 种高危HPV感染(TCT 阴性);2 例HPV18 型术后转阴,1 例HPV18 型转为其他12 种高危HPV 感染(TCT 阴性);其他12 种高危HPV 持续感染5 例;3 例HPV阴性,TCT 为明确诊断意义的不典型鳞状细胞(atypical squamous cell of undetermined significance,ASCUS);1 例TCT 为LSIL,HPV 阴性。13 例HPV、TCT 异常者复查阴道镜均为阴性。TCRC 术后12个月HPV16 型和18 型转阴率75.0% (12/16),总HPV 转阴率为79.5% (35/44),见表3、4。
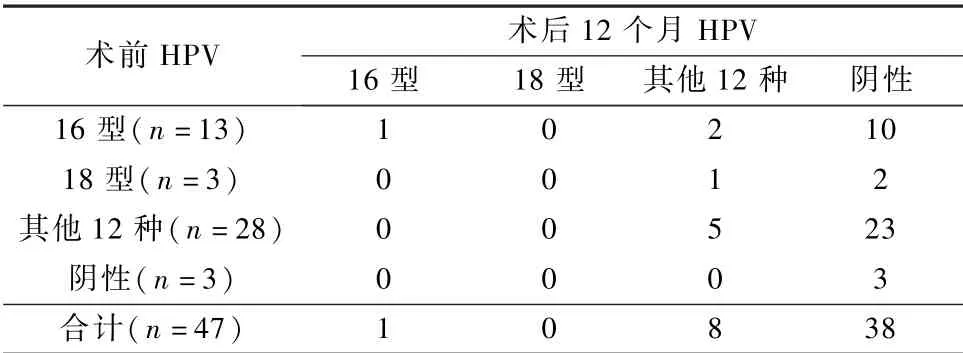
表3 47 例TCRC 术前后HPV 对比情况

表4 术后6、12 个月TCT、HPV 及阴道镜情况
2.4 全子宫切除术情况
9 例行腹腔镜全子宫切除术,年龄48~62 岁,(55.4 ±3.0)岁。2 例宫颈微浸润癌行全子宫切除术,其余7 例因CIN3 或子宫内膜病变行全子宫切除术,二次手术在TCRC 术后3 个月内。9 例全子宫切除术中,宫颈浸润癌2 例,术后宫颈残端病理为宫颈炎;CIN3 6 例(恐癌心理,随访条件差),子宫切除术后宫颈残端病理为CIN2 1 例,其余均为宫颈炎;CIN2(TCRC 术后子宫内膜复杂性增生)1 例,子宫切除术后宫颈残端病理为CIN1。9 例全子宫切除术后病理均无升级,2 例子宫切除术后宫颈残端阳性(CIN1 和CIN2 各1 例),见表5。8 例术后定期随访,每3~6 个月随访1 次,随访时间3~27 个月,中位随访时间6 个月,均恢复良好。

表5 9 例全子宫切除术情况
3 讨论
宫颈锥切术后宫颈阴道部明显短缩,甚至与穹隆无明显界限,对于围绝经期及绝经后患者尤为明显。如果选择子宫切除,术后病理升级为宫颈癌,存在手术范围不足、治疗不规范问题;若术后病理提示无病灶(未见CIN 及癌变),可能导致过度治疗的问题。故有宫颈锥切术史的CIN 患者的治疗尽量采用宫颈锥切术[5]。Cohen 等[6]研究表明CKC 和LEEP 治疗CIN3 时,二者在切缘状态、标本大小方面无统计学差异,但CKC 术后并发症高于LEEP。CKC 或LEEP 切除深度过深,术中发生邻近脏器如阴道壁、膀胱、直肠等副损伤风险高,缝合止血较为困难;切除深度过浅,容易出现手术范围不足、切缘阳性、病灶残留,无法达到治愈目的[7]。锥切术后切缘阳性不包括切缘为微小浸润癌及以上的病例,子宫切除术后多数病理为炎症,若患者无其他切除子宫指征,不建议优先选择全子宫切除术[8]。针对这类患者如何选择安全有效的治疗方案,成为近年研究热点。宫颈切除是安全有效的手术方式[9],但需要沿宫颈剪开宫颈筋膜,上推膀胱及直肠,必要时切断主骶韧带[10],对操作者手术技巧要求较高,不易掌握。宫腔镜具有高质量的可视化功能,并具有独特的电切和凝血功能,是子宫腔内疾病诊断和治疗的金标准,逐渐被应用于宫颈疾病的诊治。TCRC治疗CIN,具有术中出血少、手术时间短、患者恢复快等优点[11]。
3.1 TCRC 治疗CIN 的有效性
对宫颈锥切术后CIN 需要再次手术的患者,为保证CIN 的有效治疗及足够的手术范围,我们在征得患者同意后行TCRC。所有患者术前妇科检查均见宫颈阴道部明显短缩,甚至消失,长度仅0~0.5 cm。自移行带外0.5 cm 处切开宫颈病变组织,并且要达到>2 cm 的锥切高度,极其困难。我们施行的TCRC 可将宫腔镜置入宫腔内,直视宫颈管内病变情况,通过宫腔镜放大作用,改善肉眼对病变组织观察的局限性,并可发现、切除宫颈深部病变,保证切除宫颈长度均达20~30 mm,满足Ⅲ型转化区的病变切除深度,从而弥补LEEP 和CKC 不足。本研究术后病理与阴道镜病理符合率为94.4%(51/54),术后病理虽未行切缘情况检查,但TCRC术后12 个月HPV16 型和18 型转阴率75.0%(12/16),总HPV 转阴率为79.5%(35/44),TCT 或HPV 单项阳性患者再次复查阴道镜均为阴性,二次手术切除子宫的9 例中,1 例宫颈残端CIN1,1 例宫颈残端CIN2。由此可见,TCRC 术能够保证足够的切除范围,术后HPV 转阴率高,切缘阳性率、病灶残留均非常低,甚至可以接近于全子宫切除术的治愈率水平(94.7%)[12],提示TCRC 是一种有效的保守性治疗术式。
3.2 TCRC 治疗CIN 的安全性
本组均无术中并发症发生,术后无明显疼痛感,与传统CKC 的患者相比,无需缝合宫颈创面,手术时间明显缩短,出血量明显减少,术后恢复快。TCRC 采用高频混合电流,达到对宫颈组织切割同时凝固止血目的,膨宫液可冲洗创面,既可以在直视下迅速、准确地电凝宫颈的活动性出血点,有效止血,又可以保证术野清晰,减少切割电极对宫颈的热损伤。夏恩兰[13]认为TCRC 术后组织病理学检查显示,宫颈组织切除边缘仅表面1~2 层细胞变形、变性,不仅减少病变残留,不影响切除宫颈组织切缘病理学检查。Chen 等[14]报道经阴道超声诊断CIN合并宫腔病变的发生率16%,TCRC 术中发现合并宫腔异常约26.7%,TCRC 同时可以实现宫腔病变的诊断和治疗。本研究中,1 例围绝经期患者意外发现子宫内膜复杂性增生。利用宫腔镜的优势,无需宫颈缝合,操作简单,患者术后处理同普通宫腔镜手术,无一例发生术后感染及出血,相对于LEEP 或其他宫颈锥切术降低后术后结痂脱落时出血的风险。
3.3 TCRC 术后随访的重要性
CIN 行宫颈锥切或子宫颈切除术后切缘阳性的病变级别高、持续HPV 感染是宫颈锥切切缘阳性患者病变残留或复发的高危因素,故术后的随访十分重要[15]。本组50 例CIN 为再发病变,4 例CINⅢ锥术后切缘阳性,44 例为高危型HPV 持续感染,1 例全子宫切除术后随访15 个月HPV16 型仍为阳性,HPV 持续感染、年龄[16]等是宫颈病变术后复发的高危因素,故我们更应注重术后的定期随访。
总之,针对宫颈锥切术后切缘阳性以及再发宫颈病变的患者,如何选择更安全、更有效、更微创的治疗方案愈发重要。我们认为TCRC 既保证足够的手术范围、提高治愈率,又明显降低病变残留及复发率,可同时完成宫腔及宫颈病变的诊断和治疗,未增加术后出血及感染风险。可见,TCRC 对于上述患者是一种安全、有效、相对微创的手术方式,值得在临床上进一步推广。由于本研究为回顾性分析,TCRC 是否适用于非宫颈短缩的高级别宫颈上皮内病变患者,还需要进一步大样本临床研究。
