新型冠状病毒疫苗:现状与展望
2021-07-23杨天涵张晓燕徐建青
杨天涵,张晓燕,徐建青
(复旦大学附属公共卫生临床中心,上海 201508)
新型冠状病毒肺炎(coronavirus disease 2019, COVID-19)是由新型冠状病毒(SARS-CoV-2,severe acute respiratory syndrome coronavirus 2)引起的全球广泛流行的急性呼吸道传染病。截至2021年2月25日,SARS-CoV-2已感染全球超过112 200 000人,导致249万以上的人死亡[1]。部分COVID-19康复者可出现长期疲倦,嗅觉或味觉丧失等后遗症[2]。
SARS-CoV-2是单股正链RNA病毒,属冠状病毒科,通过两种途径侵染细胞。病毒表面分布着棘突蛋白(Spike,S),在病毒与宿主细胞靠近时,S蛋白受体结合区(receptor binding domains,RBD)与其受体血管紧张素转化酶2(human angiotensin-converting enzyme 2,ACE2)结合,并受到辅助受体NRP1、B族I型清道夫受体SR-B1、硫酸乙酰肝素和酪氨酸蛋白激酶受体AXL等的帮助[3-4]。之后细胞对病毒内吞形成囊泡,囊泡内部不同的环境(如较低的pH)和组织蛋白酶cathepsin L的切割促使S蛋白发生构像变化,S蛋白内部HR1区插入宿主细胞膜,S蛋白随之发生折叠,HR1与HR2结构域在折叠后互相锚定,促使病毒囊膜与内吞泡膜发生融合,从而将病毒遗传物质释放至细胞胞质中。另外一条入侵机制是S蛋白可以被宿主表达于膜表面的跨膜丝氨酸蛋白酶2(transmembrane protease serine 2,TMPRSS2)切割,直接诱导病毒与宿主细胞膜的融合,释放病毒遗传物质进入胞质[5]。S蛋白作为SARS-CoV-2表面最重要的膜蛋白,成为了疫苗和药物设计的核心靶点。
在COVID-19疫情暴发后,全球多家疫苗生产商加入到新型冠状病毒疫苗(简称新冠疫苗)的研发中。目前,全球已有102种候选疫苗进入临床试验,其中18款已进入III期临床试验[6]。新冠疫苗技术路线包括灭活疫苗、重组亚单位疫苗、病毒载体疫苗和核酸疫苗。其中重组亚单位疫苗包括单纯重组蛋白或纳米颗粒等不同形式,病毒载体疫苗有腺病毒载体、痘病毒载体、流感病毒载体等,核酸疫苗有DNA疫苗、非复制型mRNA疫苗和复制型mRNA疫苗等。
1 新冠疫苗技术路线
1.1 灭活疫苗 新冠灭活疫苗是通过对病原体进行培养,收获,浓缩,灭活,纯化等一系列工艺制成的疫苗。具有研发、生产工艺成熟的优势,且仅需保存于4℃环境下,对冷链运输要求较低,易于快速并大量分配至不发达地区。但其主要工艺中,病毒培养需要分离野毒株,筛选出滴度较高,遗传性状稳定的毒株,同时需要摸索合适的培养条件,如适应大规模生产的细胞株、温度、pH和培养基等,使得灭活疫苗的研发流程相对复杂。同时筛选,培养灭活疫苗所需病毒需要P3实验室和相同生物安全等级的生产车间,因此大多数国家都没有生产条件。北京科兴中维公司、国药集团中国生物技术股份有限公司下属的武汉生物制品研究所和北京生物制品研究所等分别研发了新冠灭活疫苗。新冠灭活疫苗为SARS-CoV-2全病毒灭活铝佐剂疫苗,在III期临床试验中,两剂次间隔21 d接种,接种人群为18周岁以上成人。国药集团北京生物制品研究所研发的新冠灭活疫苗进展较快,于2020年底获得国家药监局批准附条件上市。灭活疫苗在II期和III期临床试验中都表现出良好的安全性,在III期临床试验中表现出了较高的疫苗保护效力,武汉生物制品研究所研发的新冠灭活疫苗中和抗体阳转率达99.1%,对COVID-19的保护效力为72.5%,于2021年获批上市[7]。国药集团生产的新冠灭活疫苗大规模接种后,总体不良反应发生率为1.06%,全身不良反应发生率为0.69%,局部不良反应发生率为0.37%,显示出较高的安全性[8]
1.2 病毒载体疫苗 军事医学研究院和康希诺研发了基于腺病毒血清5型(Ad5)载体的新冠疫苗Ad5-nCoV。利用基因改造过的非复制型Ad5作为载体,插入SARS-CoV-2的S蛋白基因制成的腺病毒载体疫苗。Ad26.COV2.S疫苗采用腺病毒血清26型(Ad26)载体,单剂接种14 d后对中度至重度COVID-19保护率为66.9%,对重症COVID-19保护率为76.7%,接种28 d后对COVID-19引起的死亡保护率为85.4%[9]。在前期临床试验中,发现单剂次疫苗接种即可激起较强的免疫反应并提供较好的保护,故此疫苗和Ad5-nCoV都仅需接种单剂次。单剂次疫苗较多剂次疫苗优势在于一方面产能相似时可以满足更多人群的接种需求,同时人群较快产生足够的免疫力,没有多剂次之间免疫保护较弱的时期,利于更快地在人群中建立免疫屏障,另一方面减少剂次提高了接种者的顺应性,避免多剂次可能的脱落。 此外,一种基于流感载体的新冠疫苗在2020年9月进行了I期临床试验注册。这种流感载体疫苗的构建方式曾用于中东呼吸综合征(MERS),通过对流感NS1基因的改造减毒,同时插入新冠RBD片段,通过鼻喷的方式进行接种,期待能够同时诱导人体对SARS-CoV-2和流感病毒的免疫[10]。
AZD1222疫苗采用黑猩猩腺病毒载体,其中一个优势为此血清型在人群中阳性率较低,相应抗载体反应也较低。此疫苗中期分析数据显示,首剂一半剂量,第二剂完整剂量的接种方式疫苗有效率达90%,但两剂次完整剂量保护率仅62.1%,若将完全剂量的两剂接种间隔从小于6周延长至12周以上,则保护率从55.1%升高至81.3%。单剂标准剂量疫苗接种后90 d内对有症状感染保护率为76%,但对无症状感染没有保护[11-12]。无症状感染者较有症状者传播能力较低,但仍是病毒传播链中重要部分,显示单剂AZD1222疫苗不足以抑制SARS-CoV-2在人群中传播[13]。俄罗斯卫星V疫苗同样采用腺病毒载体,包含编码全长S蛋白的基因,但首剂使用Ad26载体,第二剂使用Ad5载体,减少首剂接种后抗载体免疫反应对第二剂的影响。以上的腺病毒载体疫苗均已在多个国家上市。
1.3 亚单位疫苗 NVX-CoV2373是由SARS-CoV-2重组三聚体全长S蛋白辅以Matrix-M1佐剂制成,S蛋白由昆虫细胞表达。ZF2001是一种使用CHO细胞进行生产的重组亚单位新冠疫苗,于2020年11月下旬注册III期临床试验,这种重组亚单位疫苗的有效成分主要是RBD区形成的二聚体蛋白,于2021年2月在中国上市。另一款新冠疫苗同样使用RBD重组蛋白作为疫苗主要成分,但采用SF9昆虫细胞生产,在糖基化水平和种类方面与CHO细胞来源蛋白有较大不同,最终可能导致免疫原性或疫苗保护效果的不同。重组S蛋白三聚体SCB-2019以无佐剂组、CpG/铝佐剂组和AS03组进行的I期临床试验显示其不良反应发生率和血清抗体滴度均依次上升,CpG/铝佐剂组和AS03组都诱导了明显的Th1偏向T细胞免疫反应[14]。重组蛋白疫苗对运输,储藏要求较低,可以在2~8℃条件下保持较长时间。
1.4 核酸疫苗 针对SARS-CoV-2设计的两种mRNA疫苗:编码分泌型三聚体RBD的BNT162b1、编码全长S的BNT162b2。I期临床试验显示,在不同年龄组中两种疫苗诱导了相似滴度的中和抗体,但BNT162b2组有更低的不良反应发生率和全身性不良反应强度,最终采用BNT162b2进行II和III期临床试验[15]。此mRNA疫苗已在英国等获得紧急使用授权,但这种疫苗需保存在-70℃的环境下。而mRNA-1273疫苗可以在-20℃的环境下保存6个月。mRNA-1273更易保存,在疫苗运输、分配和接种时具有更大的优势。BNT162b2在以色列大规模接种后表现出很高的保护效果,在两剂次接种7 d后,对总体感染保护率为95.3%,对无症状感染保护率达91.5%,有症状感染则达97%[16]。BNT162b2和mRNA-1273均已在北美,欧盟的多个国家上市。 云南沃森、苏州艾博和军事医学研究院合作的mRNA疫苗于2020年10月刚进入Ib期临床试验,进展较慢。目前BioNTech的新冠mRNA疫苗(BNT162b2)在美国已批准紧急使用,合作方复星医药也于2020年11月在国内注册II期临床试验。
在上述四条技术路线中,灭活疫苗工艺路线最为成熟,亚单位形式的疫苗出现也较早,但具体组成在不断发展,从蛋白质单体到多种纳米颗粒形式,并且发展出了较多佐剂。这两种疫苗形式通常可以在2~8℃条件下保存数月,现有疫苗运输、储存条件可以满足其要求,且以液体剂型运输,减少了配制过程,可以降低污染风险。灭活疫苗可以诱导良好体液免疫,但无法诱导较强的细胞免疫,且免疫反应偏向Th2型,含有特定佐剂的重组亚单位疫苗可以诱导Th1/Th2平衡的免疫反应[17]。灭活疫苗采用的铝佐剂已有将近百年的应用历史,具有很高的安全性,可以有效增强体液免疫,刺激白细胞介素4(IL-4)产生,促使免疫反应偏向Th2型[18]。ZF2001在铝佐剂基础上增加了CpG佐剂,CpG是一种Toll样受体9(TLR9)配体,可以有效提高细胞免疫强度并诱导免疫反应偏向Th1型[19]。ISCOMATRIX佐剂之前在流感疫苗临床试验中表现出较好效果,其由皂角苷,胆固醇及磷脂组成,通过多种方式促进抗原呈递,同时可以招募免疫细胞,诱导较强的体液免疫和细胞免疫[20]。腺病毒载体疫苗可在体内高效表达外源基因。由于受体广泛表达于多种细胞,腺病毒可以感染大多数类型的细胞,同时由于抗载体免疫反应,腺病毒难以持续存在于人体,提高了安全性[21]。核酸疫苗是一种新型疫苗形式,mRNA疫苗仅在细胞内短暂表达目标抗原后即被降解,没有整合风险,可以诱导更为均衡的体液免疫和细胞免疫,近年来得到了快速的发展[22]。新冠疫苗首次将mRNA疫苗技术应用于人体,免疫持续时间和长期安全性尚待进一步观察。
2 疫苗有效性
2.1 突变毒株对疫苗的影响 在COVID-19大流行中,2020年2月即出现突变株D614G,此突变株在感染、复制上具有更高的效率,且保持了与原始毒株相似的致病力,很快成为主要流行毒株。之后SARS-CoV-2在多个地区发生了多种适应性突变,如首次在英国发现的B.1.1.7突变株,在南非发现的B.1.351突变株和在巴西发现的P.1突变株[23]。这三种突变株都在S蛋白RBD区域产生了突变,其中,N501Y突变存在于三种毒株上。RBD区域的突变提高了SARS-CoV-2对ACE2的亲和力,同时这些突变降低了针对突变位点的中和抗体结合能力,可能对疫苗的预防效果和单克隆抗体的治疗效果产生不利影响[24]。B.1.1.7突变株在S蛋白上有9个氨基酸突变,其传染性较英国第一波疫情毒株升高了30%~60%,给公共卫生防治措施带来了更大挑战。突变株的致病性也可能产生变化,有研究表明B.1.1.7突变株可能导致更严重的症状和更高的致死率[25]。恢复者血清对B.1.1.7突变株和B.1.351突变株的中和能力均出现下降,对B.1.351突变株的中和滴度降低更明显,且出现症状后8个月患者血清中和效果明显低于出现症状早期(5~33 d)患者血清中和滴度,8个月后对B.1.1.7突变株和B.1.351突变株分别有40%或90%患者血清中和滴度低于阈值[26]。 新冠疫苗对几种主要流行突变株的效力见表1。
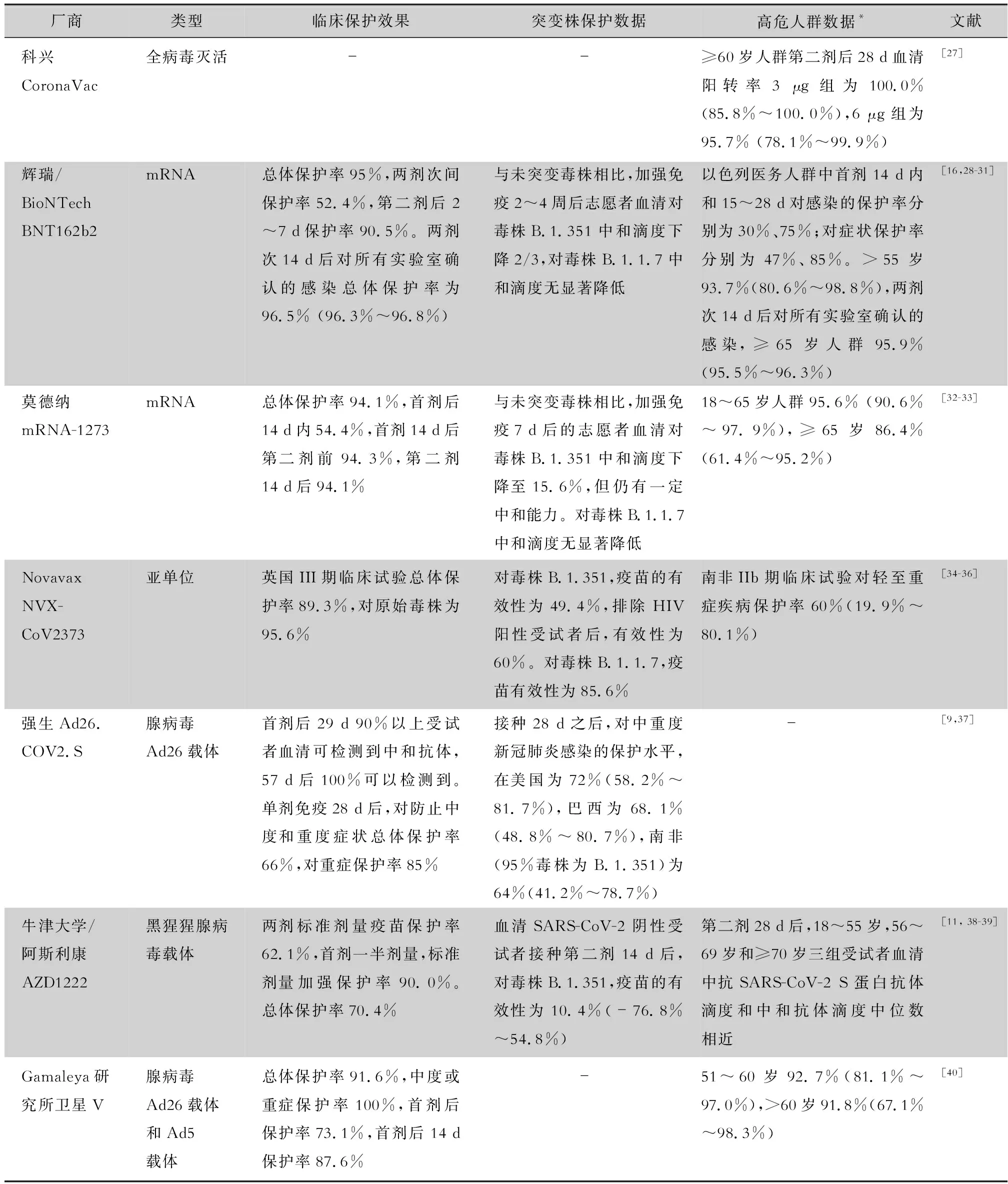
表1 新冠疫苗有效性数据
Muik等[41]通过假病毒中和实验,检测BNT162b2 加强免疫21 d后受试者血清对B.1.1.7突变株的中和滴度为原始毒株的79%,没有明显降低。Shen等[34]对比恢复者血清、mRNA-1273免疫血清、NVX-CoV2373免疫血清、多种靶向RBD的单克隆抗体对B.1.1.7突变株和早期突变株D614G的中和能力,发现虽然疫苗免疫后血清仍然可以中和B.1.1.7突变株和D614G,但中和能力下降。与D614G株相比,疫苗接种者血清对于B.1.1.7突变株半数抑制稀释度ID50平均降低了50%以上。具体来说,对于D614G株与B.1.1.7突变株ID50比值,mRNA-1273免疫后血清比值范围为0.36~8.62,NVX-CoV2373免疫血清ID50比值范围从0.85至20以上,大部分血清样本对B.1.1.7突变株ID50均出现不同程度下降。而不同的单克隆抗体受到的影响不同,其半数抑制浓度IC50从基本不变到升高10倍以上,提示突变株对部分单克隆抗体有更显著的逃逸。Tada 等[42]发现BNT162b2免疫后血清对在英国,南非,美国,欧洲分离的SARS-CoV-2突变株都具有中和能力。血清对B.1.1.7突变株的中和滴度与早期毒株D614G相似,对B.1.351突变株中和滴度降低至33%,但仍然高于恢复者血清平均滴度。检测SARS-CoV-2自然感染或疫苗接种后血清对B.1.1.7突变株的有效性,发现其更难被中和,进一步研究发现,N501Y突变影响了抗体轻链与S蛋白的结合[43]。通过向S蛋白NTD区域引入缺失或将RBD区域替换为突变株对应区域,再测试抗体与其结合能力,研究发现RBD区域发生的突变对血清抗体中和能力的影响大于NTD区域的突变[30]。
B.1.351突变株S蛋白有10个氨基酸突变,集中分布于NTD和RBD区域,其中E484K突变被证明可降低抗体对病毒的中和能力,SARS-CoV-2感染恢复者血清对B.1.351突变株中和能力也显著降低[44]。比较感染早期毒株或B.1.1.7突变株恢复者血清、AZD1222免疫血清、BNT162b2免疫血清和多种单克隆抗体对B.1.351突变株和早期毒株Victoria株的中和能力:中和滴度与Victoria株相比,早期恢复者血清平均下降93%,B.1.1.7突变株恢复者血清下降近70%,AZD1222免疫血清近下降90%,而BNT162b2免疫血清下降87%,20种单抗中的14种中和滴度降低90%以上[45]。另一项研究中,BNT162b2免疫血清和mRNA-1273免疫血清对B.1.1.7突变株的中和活性分别降低了90%和92%[46]。在南非进行的临床试验中,由于南非的主要流行毒株为B.1.351突变株,NVX-CoV2373疫苗的有效性低至49.9%,在排除了HIV阳性受试者后,有效性为60%,而在流行毒株为B.1.1.7的英国进行临床试验时,NVX-CoV2373有效性为89.3%[35]。
一项研究测试了新冠灭活疫苗BBIBP-CorV 加强免疫28 d后受试者血清和重组疫苗ZF2001接种第3剂14 d后受试者血清对B.1.351突变株的中和滴度,与原始毒株相比,中和滴度仅降低了33%~38%[47]。由于全病毒灭活疫苗采用SARS-CoV-2活病毒灭活纯化后制成,除病毒主要抗原S蛋白外还含有核蛋白N、膜蛋白M和包膜蛋白E等病毒多种结构蛋白,这些结构蛋白的加入可能有利于诱导机体产生针对新冠病毒多种蛋白的抗体,从而减轻病毒突变对疫苗保护效果的影响。
2.2 疫苗在高风险人群中的使用 SARS-CoV-2感染的高风险人群包括从事医疗、物流、检疫工作,以及在机场、港口等人员流动大,物资运输频繁区域工作的人员,以上人群有更高概率接触并感染SARS-CoV-2。对高危人群的优先接种可以在感染高风险场所建立第一道免疫屏障。
孕妇同样是高风险人群,严重的SARS-CoV-2感染可导致孕妇妊娠期高血压、产后出血和早产等风险因素升高,孕妇感染后有更高的重症和机械通气率[48]。尽管孕妇面临更高的风险,在早先大部分临床试验中却并未包括该人群,对此人群的临床试验正待开展。一项针对接种BNT162b2或mRNA-1273疫苗孕妇的早期安全性研究中由于缺乏合适的对照,使得研究数据无法说明疫苗的安全性,需要更长时间的追踪和更大的样本量[49]。
另外,60岁以上老年人、患基础疾病人群和免疫抑制人群同样属于高风险人群,此高危人群由于免疫力下降,更易感染SARS-CoV-2,且感染后更容易发展成为重症病例,需优先考虑对该人群的保护。老年人由于代谢能力下降,持续提供刺激的免疫因子发生改变等而产生免疫衰退,固有免疫和适应性免疫反应均下降,且在SARS-CoV-2感染后产生更多炎症因子。受到固有免疫刺激时,老年人的单核细胞更少产生IFN-α、IFN-γ和IL-1β等细胞因子,但会高表达TNF和CXCL8等炎症基因,进而激活NF-κB、炎症小体和MAPK信号通路[50]。基础疾病如心脑血管疾病、糖尿病、高血压等会显著干扰人体免疫功能。糖尿病患者在感染SARS-CoV-2后,住院和死亡风险更高,在重症和死亡病例中,男性和低收入者比例较高[51]。一项包括230项美国新冠临床试验的横断面调查[52]显示,临床试验尤其是III期临床试验常存在受试者老年人群比例过低,不能有效反映真实人口学数据。而现有新冠疫苗III期临床试验数据也存在部分人群样本量不足,导致统计效能不足,数据变异增大(见表1)。BNT162b2在16~55岁人群中保护率达95.6%,>55岁人群保护率93.7%,≥65岁人群保护率94.7%,但随着人群年龄段升高,亚组人数明显减少,统计学效力下降[29]。BNT162b2在以色列进行大规模接种后的研究纳入了更多受试者,70~79岁人群疫苗接种组和对照组均超过5万人,80岁以上人群各组也超过2万人,且研究包含较多高风险人群,如心脏病,肥胖,2型糖尿病等,而结果显示接种两剂疫苗7 d后在各人群中均表现出较好保护效果[31]。 免疫抑制人群,如HIV感染者,由于免疫系统受到不同程度的损害,在感染SARS-CoV-2后可能出现较其他人群更为严重的临床症状。但有研究发现疾病得到较好控制的HIV感染者出现严重症状的可能性并不高于其他人群[53]。在多个疫苗的临床试验中都包含部分高危人群,但总量较少,难以达到具有统计学意义的受试人数。这一人群对部分疫苗的不良反应发生率较其他人群高,在疫苗上市使用时,这些人群可能不符合疫苗接种条件而无法获得直接保护。针对这一问题,一方面可以通过尽量提高符合疫苗接种条件人群的接种率来提高整体人群的接种率,起到间接保护的效果;另一方面应及时开展疫苗在老年人、患基础疾病人群、孕妇和免疫抑制人群中的临床试验,获得疫苗在这一人群中的免疫原性和安全性数据,通过增加此类人群的样本量,获得现有疫苗更为有效的数据。这些数据可以指导疫苗在该人群中的科学使用,帮助确定适合此类人群的疫苗类型、剂量和免疫程序等。
研究指出,感染SARS-CoV-2恢复后感染者体内靶向S蛋白的IgG抗体水平可以稳定6个月以上,6个月时S蛋白特异的记忆B细胞数量多于感染后1个月,特异性CD4+和CD8+T细胞半衰期约3~5个月[54]。在一项探索延长AZD1222两剂接种间隔时间的研究中,间隔6周内疫苗保护率为55.1%,9~11周为72.2%,12周以上为80.0%,首剂标准剂量疫苗接种后22~90 d保护率为76.0%,但尚无首剂接种3个月后的数据[55]。
3 结语
目前,已有多个疫苗III期临床试验数据发表,同时在多个国家与地区投入使用。但这些临床试验入组人群通常不包括孕妇,包含较少的老年人群,进行亚组分析时由于样本量较少使得统计效能下降,无法准确评估疫苗在真实世界中的保护效果。SARS-CoV-2的广泛传播也使得病毒突变更为常见,对疫苗的有效性提出了挑战[56-57]。此外,疫苗保护效果的持续时间,病毒不同位点突变对疫苗效果的影响等问题都缺乏相应数据和研究。进一步探究突变位点与抗体中和、免疫识别和疫苗实际保护效果间的关系,持续监测突变毒株对疫苗效力的影响,阐释临床指标与疫苗效力的联系可以更好地应对持续的大流行。
