超高效液相色谱串联质谱法测定玉米中莠去津及其代谢物的残留量和风险评估
2021-07-22杨志富欧晓明梁贵平刘义珂于琴琴
杨志富,欧晓明,梁 骥,梁贵平,刘义珂,于琴琴
(1.湖南化工研究院有限公司 国家农药创制工程技术研究中心,湖南 长沙 410014;2.农用化学品湖南省重点实验室,湖南 长沙 410014;3.湖南加法检测有限公司,湖南 长沙 410014)
莠去津(Atrazine,ATZ),化学名称为2-氯-4-二乙胺基-6-异丙胺基-1,3,5-二嗪,是一种人工合成的选择性内吸传导型三嗪类除草剂,主要用于防除旱地一年生禾本科杂草和阔叶杂草,因其对玉米有较好的选择性,广泛用于玉米地杂草的防治[1]。ATZ虽是低毒型除草剂,但由于其溶解性好、残效期长,随着施用量的增大,会造成环境污染[2]。同时,ATZ作为内分泌干扰物,会影响生物体内的内分泌系统、中枢神经系统以及免疫系统,对人类的生殖和发育也会产生不利影响[3-5]。
莠去津施用后,在化学、光照及微生物等作用条件下可被降解,其主要的降解产物有脱乙基莠去津(Deethyl-atrazine,DEA)、脱异丙基莠去津(Deisopropyl-atrazine,DIA)、脱乙基脱异丙基莠去津(Deethyl-deisopropyl-atrazine,DDA)、2-羟基莠去津(Hydroxyatrazine,HYA)[1],DEA、DIA、DDA、HYA与ATZ具有相同的毒性模式,对生态环境和人类健康造成了严重威胁[6]。
目前,莠去津的残留检测方法主要有气相色谱[7-8]、液相色谱[9-10]以及气相色谱-串联质谱法(GC-MS/MS)[11-12]、液相色谱-串联质谱法(LC-MS/MS)[13-14]等,涉及到的样品基质主要为水[15-16]、土壤[17]、米[18]、玉米[19-20]、茶叶[21]等,检测莠去津母体的居多,鲜有玉米基质中同时对莠去津及其代谢物的检测方法、残留特性及安全性的报道。受农药生产企业委托,本文以30%苯唑草酮·莠去津·辛酰溴苯腈可分散油悬浮剂在玉米上的残留登记试验项目为背景,建立了超高效液相色谱串联质谱同时测定玉米基质中莠去津及其代谢物DEA、DIA、DDA、HYA的残留分析检测方法,并对其在玉米中的长期膳食摄入进行了风险评估,以期为玉米中莠去津及其代谢物残留量的检测和安全合理使用提供参考。
1 材料与方法
1.1 试剂和仪器
1.1.1 试剂 ATZ标准品(98.1%),DEA、DIA、DDA、HYA标准品(99.0%,98.9%,97.8%,96.8%),甲醇(质谱纯),甲酸(质谱纯),乙腈(色谱纯),二氯甲烷、氯化钠、无水硫酸钠(分析纯),水(超纯水)。
1.1.2 仪器 Agilent1290/G6470三重四级杆液质质联用仪(配有Agilent EC-C18,2.1×100mm×2.7μm色谱柱);SPS 402F型电子天平(0.01g);AL204型电子天平(0.000 1g);Hei-vap型旋转蒸发仪。
1.2 田间试验 按照NY/T 788-2018《农作物中农药残留试验准则》[22]和《农药登记残留田间试验标准操作规程》[23]并结合《农药登记残留试验区域指南》[24]要求设计,于2020年分别在辽宁沈阳、内蒙古呼和浩特、陕西西安、北京顺义、河北石家庄、山东青岛、河南郑州、江苏南京、湖南浏阳、广西玉林、贵州贵阳、广东佛山进行,供试作物为玉米,被试物为30%苯唑草酮·莠去津·辛酰溴苯腈可分散油悬浮剂。
1.2.1 最终残留试验 按农作物中农药残留试验准则要求设计2个试验小区:1个处理小区和1个对照小区,每个小区面积100m2。对照小区设置在水流和风向的上部,并和处理小区之间设缓冲带以避免交叉污染,施清水对照,采集对照样品。施药时期为玉米3~6叶期,以450g a.i/ha(制剂100g/667m2)的剂量喷雾施药1次,于鲜食玉米收获期采集鲜食玉米和秸秆、成熟玉米收获期采集成熟玉米籽粒和秸秆。
1.2.2 样品采集、制备与储存 鲜食玉米(包含玉米轴和籽粒)样品:在小区中用随机方式采集2个平行样品,从>12株玉米上至少采集12个玉米穗,去除苞叶及花丝,取≥2kg样品装入样本容器中包扎妥当,8h内运回实验室。将鲜食玉米沿纵向均匀地切成四瓣,取不相邻的两瓣,切碎,加干冰粉碎样品,待干冰挥发后,取150g样品2份分别装入封口样品容器中,容器内外贴好标签,-18℃以下冰箱中保存。
成熟玉米籽粒样品(简称玉米样品):在小区中用随机方式采集2个平行样品,从>12株玉米上采集≥12个玉米穗,去除苞叶及花丝,取≥1kg样品装入样本容器中包扎妥当,8h内运回实验室。将玉米田间样本脱粒,籽粒混匀,加干冰粉碎,待干冰挥发后,取150g样品2份分别装入封口样品容器中,容器内外贴好标签,-18℃以下冰箱中保存。
秸秆样品:与鲜食玉米和成熟玉米同时采集,在小区中用随机方式采集2个平行样品,采样点数≥12株,取样部位为地上部分玉米整株秸秆,每株分成上、中、下3个等长的小段(带叶),均匀取样,≥2kg,装入容器中,8h内运回实验室。将秸秆田间样本切碎至1cm以下小段,在不锈钢盆中混匀,加干冰粉碎,待干冰挥发后,取150g样品2份分别装入封口样品容器中,容器内外贴好标签,-18℃以下冰箱中保存。
1.3 分析方法
1.3.1 样品前处理 分别称取已制备的鲜食玉米、玉米、秸秆样品10g (精确至0.01g)于250mL塑料离心瓶中,加入50mL乙腈-甲酸溶液(9:1,V/V)溶液,超声提取10min,3 500r/min离心5min,移取10mL上清液至分液漏斗中,加入30mL二氯甲烷、20mL 5%氯化钠水溶液萃取,二氯甲烷层经无水硫酸钠过滤于100mL圆底烧瓶中,水层再用30mL二氯甲烷萃取一次,合并二氯甲烷层,于45℃水浴减压浓缩至干,用2mL甲醇-0.1%甲酸/水溶液(1:1,V/V)定容,经0.22μm有机相滤膜过滤,待UPLC-MS/MS检测。
1.3.2 仪器条件 柱温:35℃;进样量:10μL;流动相A为0.1%甲酸-水溶液,B为甲醇;流速:0.3mL/min。梯度洗脱条件:0~0.01min,20%B;0~7.00min,20%~60%B;7.00~7.01min,60%~95%B;7.01~9.00min,95%B;9.00~9.01min,95%~20%B;9.01~10.00min,20%B。
离子源:ESI;扫描方式:正离子扫描;检测方式:多反应监测;离子喷雾电压:4 500V
雾化气压力:40psi;干燥气温度:300℃;干燥气流速:9.0L/min;离子监测参数(表1)。

表1 莠去津及其化合物的UPLC-MS/MS参数

续表
1.3.3 标准工作曲线 单个标准储备液:准确称取ATZ、DEA、DIA、DDA、HYA的标准品各0.025g(精确至0.000 1g),以甲醇溶解并定容至50mL,分别配制成质量浓度为500mg/L的单个标准储备液,于-20℃避光密封储存,备用。
混合标准溶液的配制:分别准确量取一定体积的单个标准储备液,用甲醇配制成质量浓度为10mg/L的ATZ、DEA、DIA、DDA、HYA的混合标准溶液,于-20℃保存,备用。定量测定时,用甲醇和鲜食玉米、成熟玉米、秸秆空白基质提取液配制溶剂和基质系列混合标准溶液,待基质效应考察结果确定定量标准工作曲线。
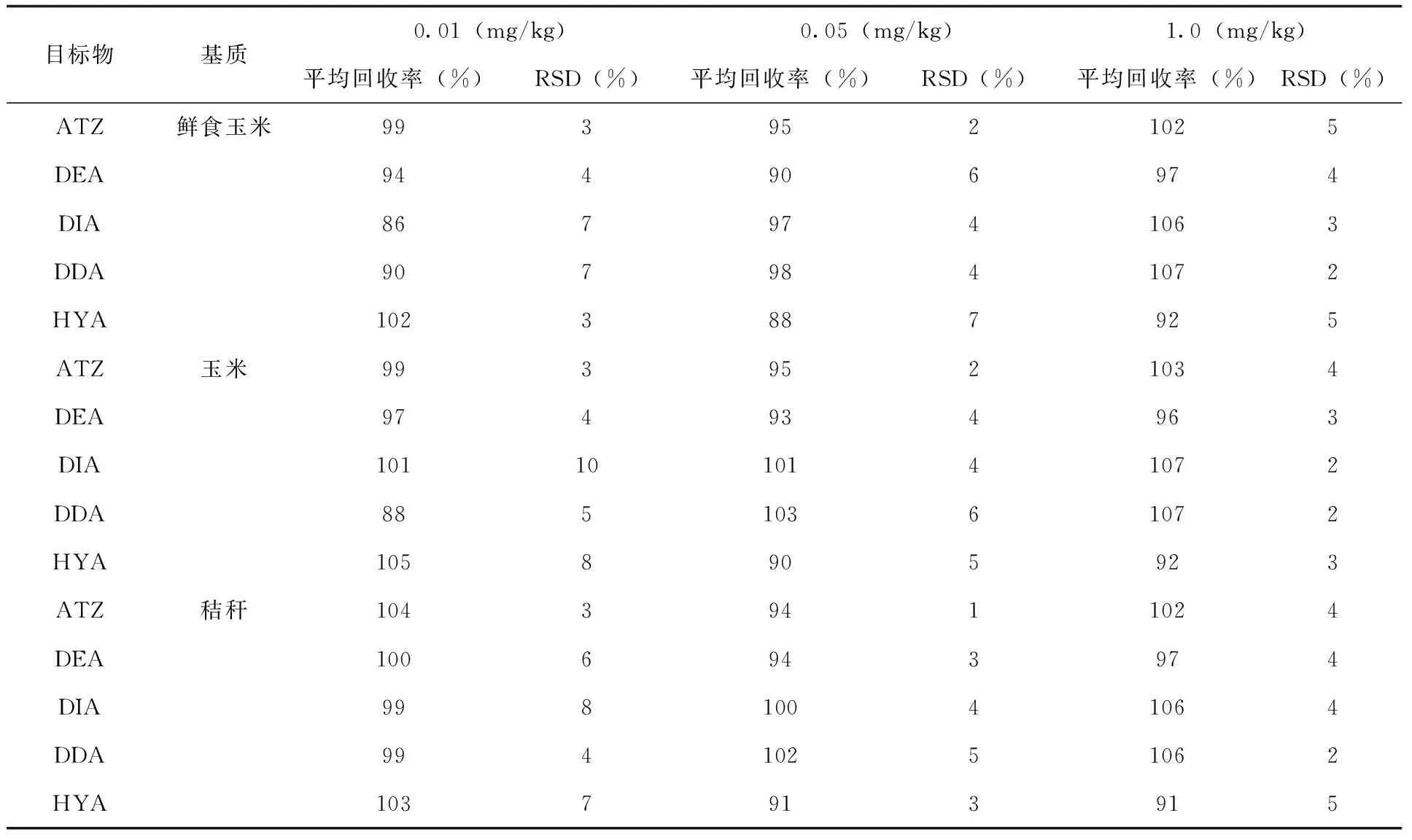
1.3.4 添加回收试验 分别在鲜食玉米、玉米或秸秆空白样本中添加3个不同质量分数ATZ、DEA、DIA、DDA、HYA的添加水平0.01mg/kg、0.05mg/kg、1.0mg/kg,每个添加水平5次重复,分别计算添加回收率平均值和相对标准偏差(RSD%)(表3)。
1.4 风险评估 长期膳食摄入风险评估根据规范残留试验中值(STMR)计算其国家估算每日摄入量(NEDI),按公式(1、2)进行计算[25-27]:
NEDI=∑[STMRi×Ei×Pi×Fi]/bw
(1)
RQ(%)=NEDI/ADI
(2)
式(1)中:NEDI为国家估算每日摄入量[μg/(kg·d)];STMRi为第i类农产品的规范试验残留中值(mg/kg);Ei和Pi分别为食品的可食部分因子和食品加工因子,本试验中均为1;Fi为不同人群对i类农产品的膳食消费量(g);bw为我国人均体重(kg),按63kg[28]计算。式(2)中:ADI为每千克体重的农药日允许摄入量(mg/kg);RQ为风险商,RQ≤1时,表示因膳食摄入所产生的农药对特定人群的健康影响处于可接受水平,RQ越小,风险越低。
2 结果与讨论
2.1 标准工作曲线的确定 玉米相关基质中含有一些杂质,可能对农药目标物产生基质效应,对检测结果造成影响。为验证基质效应,用甲醇和鲜食玉米、玉米、秸秆空白基质提取液分别配制0.005、0.01、0.05、0.1、0.5μg/mL的系列标准工作液进行比较,并按上文所述仪器条件平行测定3次,以目标物峰面积(y)对其质量浓度(x,μg/mL)绘制标准曲线,计算基质标液与溶剂标液的斜率比(表2)。
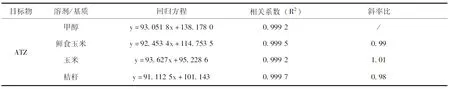
表2 5种目标物的溶剂标准曲线和基质标准曲线
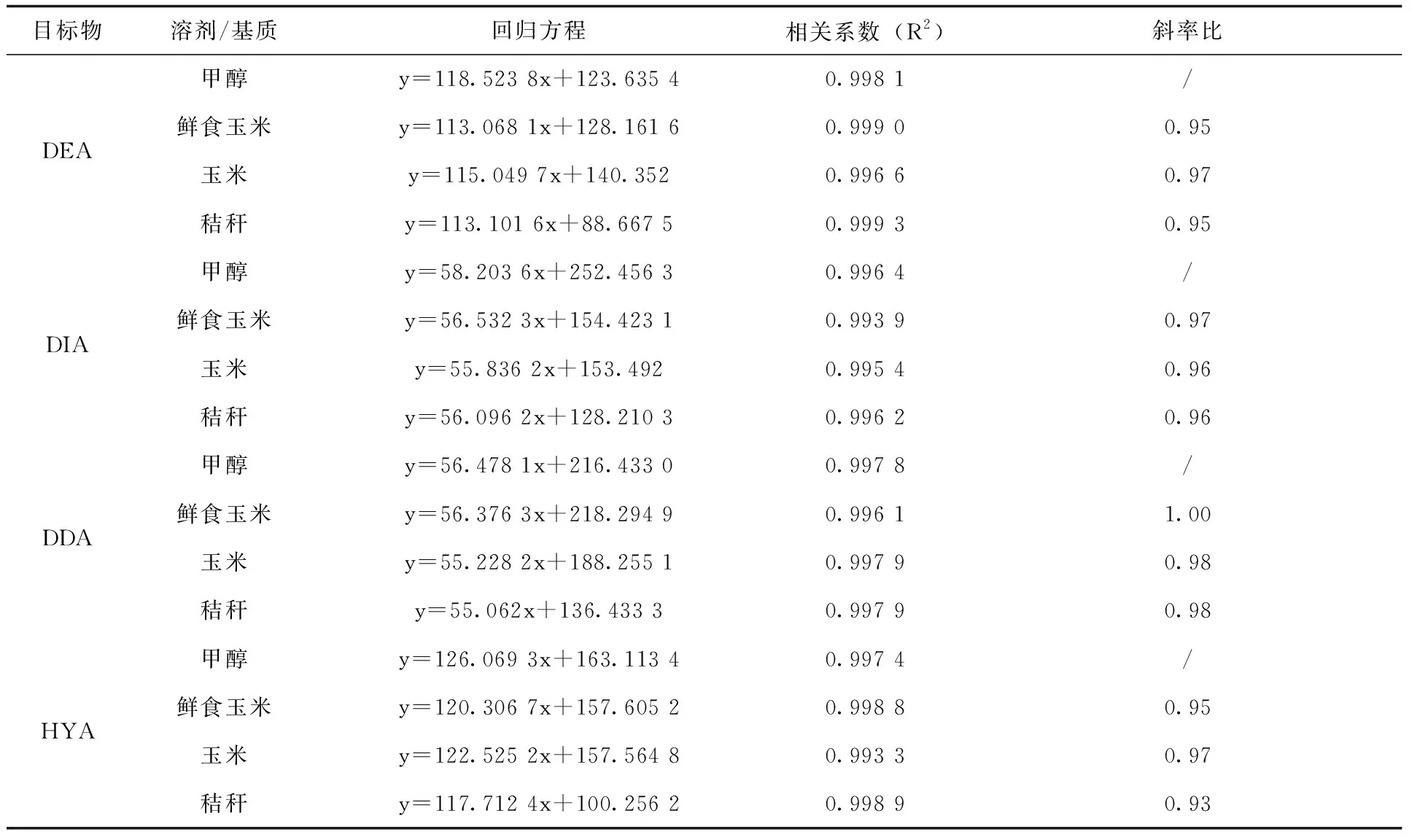
续表
基质效应(ME)=基质标准曲线斜率/溶剂标准曲线斜率,当ME>1.1时,表示基质增强效应;ME<0.9时,表示基质效应减弱;0.9 2.2 仪器条件的确定 配制0.1μg/mL的ATZ、DEA、DIA、DDA、HYA单一标准溶液,全扫确定母离子后,采用自动调谐对各目标化合物进行质谱条件优化,从而得到最优质谱测定条件。通过降低流速和调整流动相初始比例(前处理后得到的待测样品中各溶剂比例与流动相中各溶剂比例相适应),可使5种目标物获得较好的保留和峰形。适量加入甲酸可以提高5种目标物的离子化效率,进而提高响应,在上述仪器条件下,ATZ、DEA、DIA、DDA、HYA的分离效果及总离子流色谱图(图2)。 图2 ATZ、DEA、DIA、DDA、HYA的分离效果及总离子流色谱图(溶剂标0.05μg/mL) 2.3 回收率和精确度 按1.3的分析方法,在鲜食玉米空白样品中,添加水平浓度ATZ、DEA、DIA、DDA、HYA的平均回收率分别为95%~102%、90%~97%、86%~106%、90%~107%、88%~102%,相对标准偏差分别为2%~5%、4%~6%、3%~7%、2%~7%、3%~5%;在玉米空白样品中,ATZ、DEA、DIA、DDA、HYA的平均回收率分别为95%~103%、93%~97%、101%~107%、88%~107%、90%~105%,相对标准偏差分别为2%~4%、3%~4%、2%~10%、2%~6%、3%~8%;在秸秆空白样品中,ATZ、DEA、DIA、DDA、HYA的平均回收率分别为94%~104%、94%~100%、99%~106%、99%~106%、91%~103%,相对标准偏差分别为1%~4%、3%~6%、4%~8%、2%~5%、3%~7%。以上结果均满足NY/T 788-2018《农作物中农药残留试验准则》的要求,说明该检测方法可行(表3),玉米基质中ATZ、DEA、DIA、DDA、HYA空白和添加回收色谱图(图3~4)。 表3 ATZ、DEA、DIA、DDA、HYA在鲜食玉米、玉米、秸秆中的添加回收率(n=5) 图3 玉米基质中ATZ、DEA、DIA、DDA、HYA空白色谱图 图4 玉米基质中ATZ、DEA、DIA、DDA、HYA添加回收(0.01mg/kg)色谱图 2.4 最终残留 30%苯唑草酮·莠去津·辛酰溴苯腈可分散油悬浮剂以450g a.i/ha(制剂100g/667m2)的剂量于玉米3~6叶期茎叶喷雾施药1次,于鲜食玉米收获期采集鲜食玉米和秸秆、成熟玉米收获期采集成熟玉米籽粒和秸秆。莠去津的残留物监测定义为莠去津,膳食风险评估定义为莠去津、脱乙基莠去津、脱异丙基莠去津、脱乙基脱异丙基莠去津与2-羟基莠去津之和,以莠去津表示。莠去津(残留物监测定义)在鲜食玉米、玉米、秸秆中的残留量均<0.01mg/kg,莠去津(膳食风险评估定义)在鲜食玉米、玉米、秸秆中的残留量均<0.05mg/kg。 检测结果为莠去津及其代谢物的残留量均低于检测限,也低于GB/T 2763-2019[29]中制定的莠去津在玉米上的MRL值(0.05mg/kg),没有造成积累。表明按推荐GAP信息,莠去津在玉米地除草使用后,不同收获时期采集的玉米是相对安全的。 2.5 风险评估结果 通过中国农药信息网[30]查询到莠去津在我国已登记使用的农作物有玉米、高粱、糜子、大蒜、大葱、姜、苹果、梨、葡萄、甘蔗、茶叶等。本次试验结果为:鲜食玉米和玉米中莠去津残留中值均<0.01mg/kg。GB 2763-2019中莠去津的ADI值为0.02mg/kg。综合以上数据,以我国不同人群的膳食结构为基础,根据公式(1、2)计算国家估算每日摄入量和风险商值,判断其摄入水平。代入莠去津在不同农产品中的MRL值和本次规范残留试验的残留中值(STMR),计算出在不同农产品中的NEDI值为0.084μg/(kg·d),RQ值为0.4%。风险评估结果表明莠去津膳食风险很低,通常不会对一般人群健康产生不可接受的风险。 本文建立了鲜食玉米、玉米、秸秆中莠去津及其代谢物的超高效液相色谱-串联质谱法,该方法操作简单,回收率和精密度均较高,可同时检测玉米相关基质中ATZ、DEA、DIA、DDA、HYA的残留量,满足玉米中莠去津的监测和登记试验需求。据1年12地玉米中莠去津的农药规范残留试验数据,对莠去津在玉米上使用后进行风险评估,收获的鲜食玉米和成熟玉米其风险评估结果均远<100%,表明莠去津按推荐GAP使用后,残留量的风险在可控范围内,对一般人群的健康不会产生危险。


3 结论
