茄病镰刀菌对人角膜上皮细胞NOD2表达及相关炎症因子分泌水平的影响△
2021-07-22李豪亮朱然张希熹陆志峰钱晶晶梁舒
李豪亮 朱然 张希熹 陆志峰 钱晶晶 梁舒
真菌性角膜炎(FK)是由真菌入侵角膜产生免疫应答而引起的致盲性眼病[1]。FK导致的后果严重,是发展中国家劳动人群失明的主要原因之一,在中国某些地区成为角膜盲的首要原因[2-3]。FK的致病真菌在中国主要是镰刀菌属和曲霉菌属[4-5]。研究发现,角膜上皮细胞表达多种模式识别受体(PRRs),可介导并识别镰刀菌等真菌菌丝与孢子抗原诱导角膜上皮产生固有免疫反应,进而清除病原菌,在角膜上皮细胞抗真菌免疫调节中发挥首要作用。角膜上皮细胞表达的PRRs有Toll样受体、C型凝集素受体、甘露糖受体等,新近研究发现NOD样受体(NLRs)也表达于人角膜上皮细胞(hCEC)[6-7]。NLRs属于胞浆内PRRs,可识别胞内菌及其衍生物,具有细胞内免疫监视作用。当NLRs结合抗原后,丝氨酸/苏氨酸激酶2被激活并启动NF-κB、丝裂原活化蛋白激酶(MAPK)、Caspase-1等信号通路,介导炎症因子产生并诱导细胞凋亡[8-10]。
目前,国内外对曲霉菌性角膜炎的分子免疫机制研究较多,对镰刀菌性角膜炎的分子免疫机制研究较少,而NOD2在真菌感染中的作用相关研究罕见,尚未见有研究茄病镰刀菌对hCEC中NOD2表达的影响。因此,本研究采用灭活的茄病镰刀菌孢子刺激hCEC,观察不同浓度的茄病镰刀菌孢子刺激后对hCEC中NOD2及其下游炎症因子含量的影响,进而探索hCEC抗茄病镰刀菌的固有免疫机制,并为今后FK的治疗提供一种新的药物干预分子靶点。
1 材料与方法
1.1 试剂与仪器hCEC(冻存于南通大学附属医院眼科实验室)、茄病镰刀菌(北京北纳创联生物技术有限公司,菌种编号:BNCC121547),DMEM培养基、胎牛血清、双抗、2.5 g·L-1胰蛋白酶、D-Hank’s液、DMSO、PBS均购自Gibco公司(美国);沙氏培养板(安图生物工程,中国),NOD2兔抗人多克隆一抗(美国Signalway Antibody 公司)、HRP标记的鼠抗兔二抗、荧光二抗Alexa Fluor 488(英国Abcam公司);RNA提取试剂盒、逆转录试剂盒(赛默飞世尔科技公司);RIPA裂解液、蛋白酶抑制剂、磷酸化蛋白酶抑制剂、BCA蛋白浓度测定试剂盒(上海碧云天生物技术有限公司);白细胞介素-6(IL-6)、白细胞介素-8(IL-8)、肿瘤坏死因子-α(TNF-α)、ELISA试剂盒(深圳市达科为科技有限公司);紫外分光光度计(Thermo公司);荧光定量PCR仪、酶标仪(Gene Company Limited);荧光显微镜(Leica德国公司)。
1.2 细胞分组将hCEC用含体积分数10%胎牛血清的高糖DMEM培养基置于37 ℃、含体积分数5%CO2培养箱中培养。选取传3代之后的hCEC进行研究。将hCEC分为对照组(不加入真菌)与真菌刺激组(按照加入真菌孢子浓度不同再分为103、104、105、106CFU·mL-1茄病镰刀菌刺激组);按分组将PBS冲下的茄病镰刀菌孢子加入真菌刺激组。
1.3 方法
1.3.1 体外真菌感染hCEC模型制备将生长良好的hCEC接种至6孔板,每孔105个细胞,培养24 h 待细胞贴壁后,取出6孔板进入微生物实验室。PBS冲刷生长于沙氏培养基的茄病镰刀菌(27 ℃培养7 d),将冲下的真菌孢子稀释后计数并配制茄病镰刀菌孢子悬液。65 ℃ 1 h灭活真菌孢子后用纱布过滤至EP管,使母液浓度为10×106CFU·mL-1。将真菌刺激组根据加入茄病镰刀菌浓度再分为103、104、105、106CFU·mL-1刺激组,每组分别设置空白对照组(不加真菌组)。补足对照组及各真菌刺激组PBS体积,使各组所含PBS体积保持一致。
1.3.2 qRT-PCR检测各组hCEC中NOD2 mRNA表达于培养箱取出生长在培养瓶中无杂菌污染的hCEC,2.5 g·L-1胰蛋白酶消化后用培养液稀释并吹打成单细胞悬液,调整细胞浓度后均匀接种至12孔板,待细胞贴壁后吸取上清培养液,根据分组处理完毕,各孔分别于4 h、8 h、12 h、16 h提取细胞RNA后利用紫外分光光度仪检测细胞RNA浓度,逆转录仪逆转录成cDNA,于PCR仪检测各组hCEC中NOD2 mRNA表达。引物由上海生工生物有限公司合成,序列如下:β-actin 上游引物为CGT-GGA-CAT-CCG-CAA-AGA-CCT-G、下游引物为TGG-GAG-CCA-GAG-CAG-TGA-TCT-C,大小为22 bp; mNOD-2 上游引物为CCG-CAA-GCA-CTT-CCA-CTC-CAT-C、下游引物为AGC-CGC-TCC-TCC-TGC-ATC-TC,大小为20 bp。反应过程为:95 ℃预变性2 min,95 ℃变性15 s,60 ℃退火15 s,72 ℃延伸60 s,持续40个循环,最终延伸72 ℃ 7 min 。每组3个复孔,NOD2 mRNA的相对表达量以β-actin的表达为内参,采用2-△△Ct法计算。
1.3.3 Western blot检测各组hCEC中NOD2蛋白表达于培养箱取出生长在培养瓶中无杂菌污染的各组hCEC,2.5 g·L-1胰蛋白酶消化后用培养液稀释并吹打成单细胞悬液,血球计数板计数细胞,调整细胞浓度后均匀接种至6孔板,待细胞贴壁后吸取上清培养液,处理各孔细胞12 h、24 h、36 h后用RIPA裂解液提取细胞蛋白后用BCA蛋白定量检测各组hCEC中NOD2蛋白表达,经过配胶、电泳、转膜、封闭、一抗与二抗孵育、洗膜后显影。以GAPDH为内参蛋白,ImageJ软件计算GAPDH和NOD2蛋白的灰度值并量化。
1.3.4 细胞免疫荧光检测各组hCEC中NOD2的表达于24孔细胞培养板中每孔放置无菌细胞爬片(直径14 mm),调整制备的hCEC悬液浓度(无血清DMEM稀释),每孔接种3000个hCEC,细胞培养箱中培养6 h待细胞贴壁后取出24孔板,各真菌刺激组加入茄病镰刀菌孢子悬液,使每孔真菌孢子浓度为105mL-1,培养24 h后经过清洗、固定、封闭、一抗与二抗孵育、染色、封片,于荧光显微镜下拍照。
1.3.5 ELISA法检测各组hCEC上清液中IL-6、IL-8、TNF-α蛋白含量于培养箱取出生长在培养瓶中无杂菌污染的hCEC,2.5 g·L-1胰蛋白酶消化后用培养液稀释并吹打成单细胞悬液,调整细胞浓度后均匀接种至6孔板,待细胞贴壁后吸取上清培养液,根据分组处理各孔36 h后收取上清液,1000 r·min-1离心5 min后取上清,分别用IL-6、IL-8、TNF-α ELISA试剂盒检测各组hCEC上清液中不同炎症因子的蛋白含量。
1.4 统计学方法采用SPSS 23.0统计学软件进行数据处理,所有数据采用均数±标准差表示。整体间差异采用单因素方差分析,各组间差异采用独立样本t检验。检验水准:α=0.05。
2 结果
2.1 细胞和菌种形态特征及模型建立茄病镰刀菌接种于沙氏培养基,于27 ℃培养7 d后正面呈白色绒毛状,背面呈浅黄色(图1A、B)。真菌涂片检光镜下可见大量真菌分隔菌丝及孢子(图1C)。传代细胞接种于6孔板约3 h可贴壁,呈圆形;6 h开始细胞体积逐渐增大,逐渐变为长梭形,12 h开始进入对数生长期,48 h可见细胞生长形态趋于稳定,为多角短梭形、排列紧密的上皮样形态(图1D)。收集的真菌孢子灭活处理后调整浓度加入含hCEC的6孔板,建立真菌孢子刺激hCEC模型(图1E)。

图1 茄病镰刀菌和hCEC形态及茄病镰刀菌孢子感染hCEC模型 A:茄病镰刀菌菌落正面; B:茄病镰刀菌菌落背面;C:菌丝涂片,菌丝(蓝色箭头),假头状小分生孢子(红色箭头)(×200);D:hCEC培养48 h,细胞较多,呈多角形、单层生长,融合度达80%左右; E:茄病镰刀菌孢子感染hCEC,镜下可见hCEC周围存在大量镰刀状分生孢子。
2.2 各组hCEC中NOD2 mRNA表达103CFU·mL-1茄病镰刀菌孢子刺激hCEC 4 h、8 h、12 h、16 h后,hCEC中NOD2 mRNA相对表达水平分别为1.14±0.20、1.21±0.16、1.18±0.18、1.17±0.07,对照组为1.04±0.37,组间比较,差异无统计学意义(F=0.263,P>0.05)。104CFU·mL-1茄病镰刀菌孢子刺激hCEC 4 h、8 h、12 h、16 h后,hCEC中NOD2 mRNA相对表达水平分别为1.31±0.12、1.89±0.04、1.61±0.16、1.62±0.13,与对照组(1.03±0.29)比较,刺激4 h差异无统计学意义(t=-1.572,P>0.05),刺激 8 h、12 h、16 h差异均有统计学意义(t=-5.045、-3.016、-3.178,均为P<0.05)。105CFU·mL-1茄病镰刀菌孢子刺激hCEC 4 h、8 h、12 h、16 h后,hCEC中NOD2 mRNA相对表达水平分别为1.34±0.16、2.98±0.14、1.77±0.18、1.38±0.09,与对照组(1.01±0.18)比较,刺激4 h差异无统计学意义(t=-2.335,P>0.05),
刺激8 h、12 h、16 h差异均有统计学意义(t=-14.894、-5.158、-3.171,均为P<0.05)。106CFU·mL-1茄病镰刀菌孢子刺激hCEC 4 h、8 h、12 h、16 h后,hCEC中NOD2 mRNA相对表达水平分别为1.79±0.35、2.70±0.35、2.42±0.42、1.58±0.15,与对照组(1.04±0.35)比较,刺激4 h、16 h差异均无统计学意义(t=-2.625、-2.466,均为P>0.05),刺激8 h、12 h差异均有统计学意义(t=-5.794、-4.381,均为P<0.05)。
2.3 各组hCEC中NOD2蛋白表达105CFU·mL-1茄病镰刀菌孢子刺激hCEC 12 h、24 h、36 h,hCEC中NOD2蛋白相对表达水平分别为1.62±0.13、2.18±0.33、1.78±0.12,与对照组(1.00±0.06)相比,差异均有统计学意义(t=-7.379、-6.026、-10.023,均为P<0.05)(见图2)。105CFU·mL-1茄病镰刀菌孢子刺激hCEC 24 h后,hCEC中NOD2荧光分子表达量与对照组相比显著增强(见图3)。
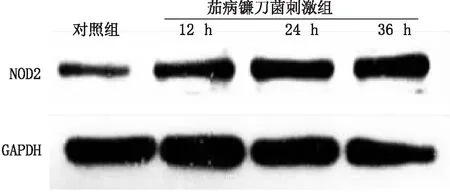
图2 105 CFU·mL-1茄病镰刀菌孢子刺激不同时间hCEC中NOD2 蛋白的表达变化
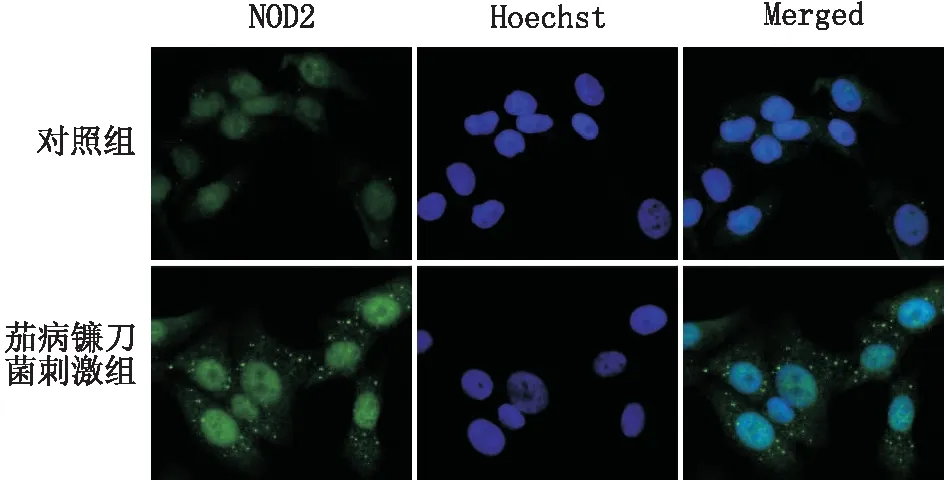
图3 105 CFU·mL-1茄病镰刀菌孢子刺激24 h后hCEC中NOD2 荧光分子的定位和表达
2.4 各组hCEC上清液中炎症因子IL-6、IL-8、TNF-α分泌103、104、105、106CFU·mL-1茄病镰刀菌孢子刺激hCEC 36 h后,IL-6蛋白含量与对照组相比,103CFU·mL-1刺激组差异无统计学意义(t=-1.091,P>0.05),104、105、106CFU·mL-1刺激组差异均有统计学意义(t=-20.663、-33.675、-39.778,均为P<0.05);IL-8蛋白含量与对照组相比,103CFU·mL-1刺激组差异无统计学意义(t=-0.01,P>0.05),104、105、106CFU·mL-1刺激组差异均有统计学意义(t=-18.957、-8.608、-10.671,均为P<0.05);TNF-α蛋白含量与对照组相比,103CFU·mL-1刺激组差异无统计学意义(t=-0.825,P>0.05),104、105、106CFU·mL-1刺激组差异均有统计学意义(t=-8.437、-6.182、-7.079,均为P<0.05)(见表1)。
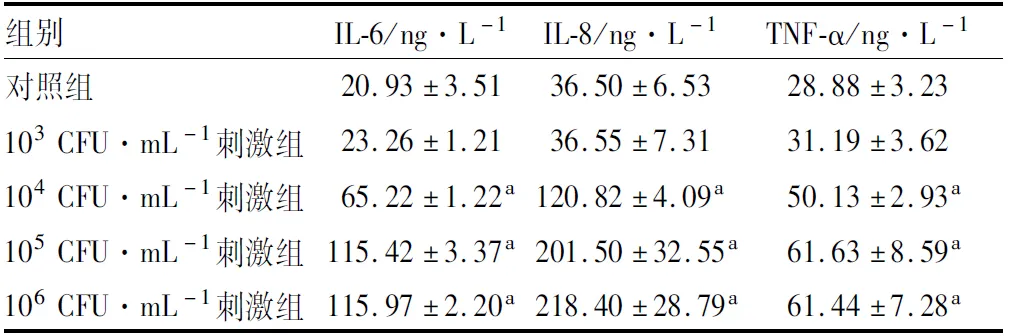
表1 各组hCEC上清液中IL-6、IL-8、TNF-α蛋白含量比较
3 讨论
在镰刀菌和曲霉菌感染的FK患者角膜组织中,NOD2 mRNA的相对表达量是正常角膜组织的上千倍[7]。有研究表明用灭活的烟曲霉菌孢子刺激hCEC可上调NOD2的表达[11],但尚无研究表明茄病镰刀菌在体外对hCEC中NOD2表达的影响。Jin等[12]用灭活的茄病镰刀菌刺激hCEC,检测了各型Toll样受体(TLRs)的表达差异,发现TLR2、3、4、6型mRNA及蛋白表达与对照组(未用真菌刺激组)比较均显著升高。又有研究表明TLR受体与NOD2受体之间亦存在直接联系,各型TLR受体的上调也会促进NOD2受体的表达[11,13-14]。因此,本研究用灭活的茄病镰刀菌孢子刺激hCEC进而检测NOD2表达具备充足的理论依据。
项目组先前的研究发现[15],未加热灭活的茄病镰刀菌与尖端赛多孢子菌在体外不同糖浓度环境下均能够通过上调hCEC中MMP-9 mRNA和蛋白表达,进而增加真菌对hCEC的黏附作用。而本研究为排除真菌的毒性和黏附力的影响,采用灭活的茄病镰刀菌孢子作为抗原刺激hCEC,发现灭活的真菌在体外亦能上调细胞中炎症因子的表达。随着灭活的茄病镰刀菌孢子刺激浓度的升高,hCEC中NOD2 mRNA表达逐渐增加,105CFU·mL-1茄病镰刀菌孢子浓度刺激8 h可达峰值,而用该浓度的茄病镰刀菌孢子刺激24 h NOD2蛋白表达可达高峰。随着茄病镰刀菌孢子浓度的升高,与NOD2介导有关的下游相关炎症因子的表达亦可升高。因此,本研究结果表明,灭活的茄病镰刀菌孢子在体外能上调hCEC中NOD2 mRNA及蛋白的相对表达,并促进下游炎症因子IL-6、IL-8、TNF-α的蛋白表达。
角膜损伤是感染FK的首要因素[16],当真菌入侵受损的角膜后,角膜缘血管活化并趋化中性粒细胞在内的炎症细胞参与对病原菌吞噬并介导炎症通路激活和炎症因子的释放。另外,hCEC作为抗真菌固有免疫的第一道屏障也参与其中。NLRs及其介导下游炎症通路激活的作用成为近年来研究的热点问题,以往NLRs在FK的发病机制中少有研究并认为其介导的炎症反应在FK中发挥次要作用,而近年来认为NLRs是参与FK的主要PRRs[6,17]。有研究表明,用灭活的烟曲霉菌感染hCEC后,NOD2 mRNA和蛋白表达峰值的时间点均小于本研究结果[11],其原因可能是刺激菌种、真菌孢子浓度等的不同而造成的差异。通过比较烟曲霉菌及茄病镰刀菌对NOD2表达峰值时间的差异,可能对分析二者的病程及预后有一定意义。镰刀菌及曲霉菌感染的FK患者预后都较差,陈懿等[18]研究认为镰刀菌感染的患者相对于曲霉菌感染的患者药物治愈的所需时间更长,这可能与本研究中hCEC对茄病镰刀菌的识别、介导炎症反应时间较长有一定关系。
在治疗FK时除运用抗真菌药物外,糖皮质激素和免疫抑制剂的选用和使用时机一直以来是研究的热点问题[19]。炎症反应是清除病原菌的重要保护机制,而过度的炎症反应将导致角膜结构和功能的紊乱,影响角膜透光性,严重时导致溃疡穿孔和失明。FK早期贸然应用免疫抑制药物将抑制中性粒细胞趋化导致感染扩散,甚至引起溃疡穿孔,而在炎症反应后期适时应用免疫抑制类药物将明显改善炎症相关细胞和因子对角膜的损伤。因此,对不同菌种造成角膜炎症反应时间峰值点的基础研究对FK临床诊治具有一定的意义。
综上所述,NOD2参与了hCEC抗茄病镰刀菌的固有免疫过程,因此NOD2介导的炎症反应在FK中发挥重要作用,故而在控制真菌感染的炎症后期同时抑制NOD2表达可能对治疗FK的炎症反应有一定效果,NOD2可能是治疗FK的新型靶分子。
