MiR-548d-3p调节过氧化氢刺激下人圆锥角膜成纤维细胞IL-1β的表达
2021-07-22王思佳宋一菲李晓娜侯心淏杨纪忠
王思佳,宋一菲,李晓娜,侯心淏,宋 婕,杨纪忠,
贺 瑞3b,陈维毅1,姚 蔚4
(1.太原理工大学 生物医学工程学院,太原 030024;2.韦仕敦大学 理学院,加拿大 伦敦 N6A 3K7;3.山西省眼科医院 a.角膜病科,b.准分子激光室,太原 030002;4.山西医科大学 口腔医学院,太原 030001)
圆锥角膜(keratoconus,KC)是一种以角膜基质变薄、失去正常弧度而发生锥形变形为特征的眼科临床常见的致盲疾病,在全球范围内的患病率约为1/2 000.除遗传因素外,揉眼、佩带角膜接触镜、紫外线等环境因素在圆锥角膜疾病的发生、发展中也发挥了重要作用[1-2]。
氧化应激是指体内氧化与抗氧化作用失衡的一种状态。正常生理条件下,细胞新陈代谢会不断产生活性氧自由基(reactive oxygen species,ROS)和活性氮自由基(reactive nitrogen species,RNS)等,自由基的产生和消除处于动态平衡状态。当细胞受到如紫外线、药物等过度刺激时,体内会产生过多的自由基,超出自身清除的能力,氧化与抗氧化系统平衡失调,致使氧化应激的发生[3]。角膜是位于眼球前壁的一层透明无血管组织,基质组织更新代谢的速率较慢。由于长期暴露于体表,吸收了绝大部分进入眼睛的紫外光线,使其更容易受到自由基的破坏,引起氧化应激水平升高[4]。健康角膜中由超氧化物歧化酶、过氧化氢酶、谷胱甘肽过氧化物酶和谷胱甘肽还原酶组成的酶抗氧化系统,可有效地消除氧化副产物。有研究发现,圆锥角膜抗氧化系统异常时,体外培养的圆锥角膜患者的角膜细胞、角膜组织及血清中氧化应激标志物和总氧化水平显著增高[5-8]。前期研究发现人正常角膜和圆锥角膜细胞中超氧化物歧化酶-2、抗氧化酶血红素氧合酶-1和NADPH氧化还原酶3种抗氧化酶的表达存在差异[9]。以上研究表明氧化应激参与了圆锥角膜的发生、发展过程。
尽管圆锥角膜一直以来被定义为非炎症进行性的角膜病变,但越来越多的实验研究表明圆锥角膜与炎症密切相关。与正常角膜对照发现,圆锥角膜患者泪液和血清中肿瘤坏死因子-α(tumor necrosis factor,TNF-α)、细胞间黏附分子-1(intercellular cell adhesion molecule-1,ICAM-1)、血管细胞黏附分子(vascular cell adhesion molecule-1,VCAM-1)、白介素(interleukin,IL)-1/-4/-5/-6/-8/-17等炎性因子表达均显著升高[10-12]。氧化应激可引起机体中炎症介质的过度释放,过度或慢性炎症刺激会引起组织蛋白酶表达增加,降解细胞外基质,破坏组织结构和微环境,使组织稳态失衡。氧化应激、炎性因子共同参与了圆锥角膜的发生、发展[13]。前期实验对体外培养的圆锥角膜患者角膜成纤维细胞添加100 μmol/L过氧化氢处理4 h后发现,圆锥角膜成纤维细胞中炎性因子IL-1β/-6/-8、ICAM-1和基质金属蛋白酶(matrix metalloproteinase,MMP)-1/-2/-3基因表达显著上调,其中IL-1β上调幅度最大[13]。IL-1β能诱导许多炎症相关基因的表达,在急性炎症中被视为一种重要的免疫成分。如PM2.5可作用于肺上皮细胞,促进ROS的释放,直接引起上皮细胞氧化损伤,促进巨噬细胞、肺泡上皮细胞中IL-1β、IL-6、TNF-α等炎性因子的分泌;氧化应激也可刺激心肌细胞中IL-1β表达升高,从而诱发心肌炎症反应[14-15]。但圆锥角膜中IL-1β表达调控机制尚不清楚。
微小RNA(microRNA,miRNAs)是一类由21-25个核苷酸组成的内源性非蛋白编码单链RNA,作为重要的基因表达调控因子,miRNAs通过3′-UTR(untranslated region)端互补结合降解mRNA或抑制 mRNA的翻译,在转录后水平对靶基因的表达进行调控。研究发现多种miRNAs在角膜组织中表达丰富,miRNAs的异常表达也在眼部疾病的发生、发展及预后中起重要作用[16-17]。此外,miRNAs参与调控机体内氧化应激水平,如在一定浓度过氧化氢诱导的人晶状体上皮细胞氧化应激中miR-34a表达水平显著增加,下调miR-34a表达后可增加人晶状体上皮细胞存活率[18];miR-506/miR-124通过靶向KLF4和KLF5抑制过氧化氢诱导的人心肌细胞中ROS表达[19]。机体内多种炎症反应与miRNAs密切相关,实验研究表明miRNAs可通过直接靶定或靶定其他通路调控IL-1β、IL-8、IL-6、TNF-α和ICAM-1等多种炎性因子的表达[20]。MiRNAs是否参与了圆锥角膜成纤维细胞中IL-1β的表达调控有待深入研究。
本文通过生物信息学方法预测与IL-1β靶定的MiRNAs,研究过氧化氢刺激下人圆锥角膜成纤维细胞中MiRNAs对IL-1β及下游与基质重塑相关基因的表达的影响,探讨MiRNAs在圆锥角膜发生、发展中的调控作用,为圆锥角膜发病机制及诊治提供新的潜在靶点。
1 实验材料与方法
1.1 主要试剂
DMEM/F-12基础培养基(Hyclone,美国),胰蛋白酶(Gibico,美国),Ⅱ型胶原酶(Sigma,美国),过氧化氢(上海碧云天),TRIZOL及Prime-ScriptTMRT reagent Kit检测试剂(Takara,大连),293T细胞株(来自中国科学院细胞库),lip-2000转染试剂(Invitrogen,美国),Dual-Luciferase 报告基因检测系统试剂盒(promega,美国)。
1.2 人圆锥角膜成纤维细胞的提取及培养
实验所需的人圆锥角膜成纤维细胞(hKCFs)取自山西省眼科医院角膜术后废弃病理组织。机械剥离角膜上皮和内皮层,磷酸缓冲盐溶液反复清洗后,用质量浓度1 mg/mL Ⅱ型胶原酶的培养基消化,直至组织块完全消失,镜下可见单个细胞时终止消化。2 000 r/min离心5 min,弃上清,加入适量细胞培养基,吹匀后移入培养瓶中,37 ℃、体积分数5% CO2孵箱内培养。
1.3 过氧化氢处理
采用100 μmol/L过氧化氢处理细胞12 h,以未做任何处理的细胞作为对照。处理结束后,磷酸缓冲盐溶液清洗,用TRIZOL裂解细胞,用于RNA的提取。
1.4 IL-1β相关靶定miRNAs的预测
通过miRBase(http://www.mirbase.org/)和TargetScan(http://www.targetscan.org/)数据库预测IL-1β相关靶定的miRNAs.对所得出的候选基因进行综合分析,筛选出综合得分较高的靶基因进行进一步研究。
1.5 荧光实时定量PCR(qRT-PCR)检测炎性因子基因和MiRNAs表达
收集细胞裂解液,分别使用反转录试剂盒提取mRNA,用Mir-XTM miRNA First-Strand Synthesis Kit试剂盒提取MiRNA,并进行反转录获得cDNA.荧光实时定量PCR按照TB GreenTMPremic Ex TaqTMⅡ说明书操作,基因表达以GAPDH为内参基因,MiRNA表达分析以U6为内参基因,采用2-ΔΔCT法对基因表达进行相对定量分析。使用引物序列见表1.

表1 人目标基因引物序列Table 1 Human target gene primer sequence
1.6 荧光素酶报告基因检测
本实验使用的pmirGLO双荧光素酶报告质粒购于上海吉玛公司,用PCR扩增包含MiR-548d-3p结合位点的野生型(WT)和含突变位点的IL-1β(MUT)片段,然后分别连接到pmirGLO载体,将pmirGLO-IL-1β WT或pmirGLO-IL-1β MUT与MiR-548d-3p及相应对照转染到293T细胞中。48 h后弃上清,细胞用磷酸缓冲盐溶液清洗后加入PLB裂解液裂解细胞,收样,所得细胞用于双荧光素酶系统检测。使用Dual-Luciferase 报告基因检测系统试剂盒检测萤荧光素酶活性,萤火虫荧光素酶活性值(LUC)与海肾荧光素酶活性值(RLUC)的比值为相对荧光素酶活性。
1.7 MiR-548d-3p mimics及inhibitor的转染
将MiR-548d-3p mimics(模拟物)、inhibitor(抑制剂)和NC(阴性对照)miRNA以20 μmol/L浓度通过lip-2000分别转染到hKCFs中。在37 ℃、体积分数5% CO2条件下培养6~8 h后,用含抗生素的完全培养液继续培养48 h后收样。
1.8 数据统计分析
实验结果以均值±标准差表示,采用SPSS 20.0统计分析软件中的单因素方差分析法对数据进行统计学处理,P<0.05认为差异具有统计学意义。
2 结果
2.1 IL-1β相关靶定MiRNAs的筛选
通过miRBase和TargetScan数据库筛选出了8种与IL-1β有靶定关系的MiRNAs,即miR-21-5p,miR-24-3p,miR-26b-3p,miR-27b-5p,miR-181d-5p,miR-383-3p,MiR-548d-3p,miR-4700-3p,靶定位点如表2所示。

表2 IL-1β 3′UTR与相关MiRNAs靶定位点Table 2 Predicted MiRNAs binding sites in 3′UTR of IL-1β
2.2 过氧化氢刺激下调hKCFs中MiR-548d-3p和miR-4700-3p表达
100 μmol/L过氧化氢处理hKCFs 12 h,采用实时荧光定量PCR检测氧化应激对细胞中miRNAs基因表达的影响(图1).与对照组比较,过氧化氢刺激下hKCFs中miR-21-5p和miR-181a-5p的表达无显著变化(P>0.05);miR-27b-5p的表达显著增加,为对照组的2.14倍(P<0.05);miR-24-3p、miR-26b-3p、miR-383、MiR-548d-3p和miR-4700-3p的表达下降,分别减少8%、32%、33%、40%、74%(P<0.05).其中MiR-548d-3p和miR-4700-3p表达与IL-1β呈负相关且下降最为显著。
2.3 过氧化氢刺激下hKCFs中IL-1β、MiR-548d-3p和miR-4700-3p基因表达随时间的变化
如图2(a)所示,与0 h对照组相比,IL-1β的表达在过氧化氢刺激6 h、12 h和 24 h后均显著增加,分别为对照组的22倍、33倍和20倍(均P<0.05).图2(b)结果显示,与0 h对照组相比,MiR-548d-3p的表达在过氧化氢刺激6 h、12 h和24 h后均显著下降,分别减少了65%、92%和94%(均P<0.05).图2(c)结果显示,与0 h对照组相比,miR-4700-3p的表达只在过氧化氢刺激12 h和24 h后下降,分别减少了73%和61%(P<0.05),但下降幅度均低于MiR-548d-3p.结果显示在hKCFs中MiR-548d-3p与IL-1β负相关性更为明显。
2.4 MiR-548d-3p与IL-1β存在靶定关系
如图3所示,双荧光素酶报告基因实验结果显示,MiR-548d-3p结合IL-1β 3′UTR 转染后荧光素酶的活性下降了21%,表明MiR-548d-3p能够作用于IL-1β 3′UTR区域;而将IL-1β 3′UTR区域进行突变后,荧光素酶的活性较野生型增加15%(P<0.05),与对照组相比无统计学差异(P>0.05).说明此突变位点可能为两者结合的位点。因此,可以确定IL-1β是MiR-548d-3p的靶点,即 MiR-548d-3p参与了氧化应激条件下hKCFs中IL-1β基因表达的调控。

*表示与各自对照组比较P<0.05图1 过氧化氢对人圆锥角膜成纤维细胞中miRNAs基因表达的影响Fig.1 Gene expression of miRNAs in hKCFs exposed to H2O2

*表示分别与0 h对照组比较P<0.05图2 过氧化氢刺激下人圆锥角膜成纤维细胞IL-1β(a),MiR-548d-3p(b)和miR-4700-3p(c)基因表达随时间的变化Fig.2 Gene expression of L-1β (a), MiR-548d-3p (b) and miR-4700-3p (c) with time in hKCFs exposed to H2O2

*表示与mimics NC比较P<0.05;#表示与IL-1β MUT mimics比较P<0.05图3 双荧光素酶报告基因表明MiR-548d-3p与IL-1β存在靶定关系Fig.3 Luciferase reporter assays showed that IL-1β is an authentic target ofMiR-548d-3p
2.5 MiR-548d-3p通过靶向IL-1β参与了过氧化氢刺激下MMP-1、MMP-3及CollagenI α2基因的表达调控
100 μmol/L过氧化氢处理细胞 12 h后,将MiR-548d-3p转染到细胞中,48 h后收样。QRT-PCR结果显示,与各自mimics NC相比,对照组和过氧化氢组中MiR-548d-3p基因表达均显著上升,分别为各自mimics NC的6 510倍和83 453倍(均P<0.05);与各自inhibitor NC相比,对照组和过氧化氢组中MiR-548d-3p基因表达均显著下降,分别减少了85%和19%(均P<0.05),如图4(a)-(b)所示。
转染后IL-1β基因表达结果如图4(c)-(d)所示。与对照组中mimics NC相比,过氧化氢组中IL-1β基因表达显著上升,增加了23%(P<0.05);与各自 mimics NC相比,对照组和过氧化氢组中IL-1β基因表达均显著下降,分别减少了8%和59%(均P<0.05).与对照组中inhibitor NC相比,过氧化氢组中IL-1β基因表达显著下降,减少了17%(P<0.05);与各自inhibitor NC相比,对照组和过氧化氢组中IL-1β基因表达均显著上升,分别增加了15%和36%(均P<0.05).MiR-548d-3p调控了IL-1β的表达。
图4(e)-(g)显示,MMP-1,MMP-3的表达随MiR-548d-3p表达的升高而降低,CollagenI-α2的表达随MiR-548d-3p表达的升高而升高。对照组和过氧化氢组中MMP-1基因表达均显著下降,与mimics NC相比分别减少了20%和42%(均P<0.05);对照组和过氧化氢组中MMP-3基因表达均显著下降,与mimics NC相比分别减少了11%和58%(均P<0.05).随MiR-548d-3p表达升高,对照组和过氧化氢组中CollagenI-α2基因表达均显著增加,分别增加了16%和33%(均P<0.05).
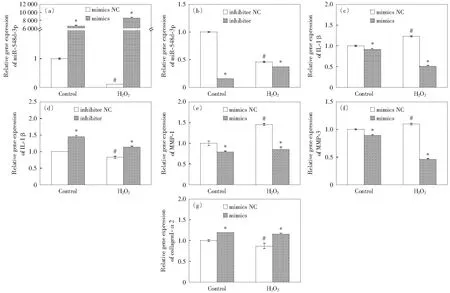
NC为negative control;图(a)-(d)中,*表示与各自mimics NC或 inhibitor NC比较P<0.05,#表示与对照组mimics NC或inhibitor NC比较P<0.05;图(e)-(g)中,*表示与各自mimics NC比较P<0.05,#表示与对照组mimics NC比较P<0.05图4 过氧化氢刺激下MiR-548d-3p mimics和inhibitor对人圆锥角膜成纤维细胞MiR-548d-3p, IL-1β, MMP-1, MMP-3, Collagen I-α2基因表达的影响Fig.4 Effects of MiR-548d-3p mimics and inhibitor on the gene expression of MiR-548d-3p, IL-1β, MMP-1, MMP-3, and Collagen I-α2
3 讨论
作为一种在临床中较为常见的致盲性疾病,圆锥角膜严重影响了患者的正常生活。目前圆锥角膜的发病机制尚不清楚,越来越多的研究表明,圆锥角膜不单纯是遗传性疾病,紫外线照射、慢性机械性损伤引起的氧化应激等环境因素也在圆锥角膜的发病中发挥着重要作用[2]。
有数据显示在衰老的人角膜成纤维细胞中IL-1β的表达和分泌水平明显高于正常人角膜成纤维细胞;而对比正常人角膜和圆锥角膜患者的原代角膜基质细胞的基因表达后,同样发现IL-1β在圆锥角膜中的表达明显升高。作为重要的炎症调控因子,IL-1β的异常表达是多种角膜疾病的诱因[21-22]。IL-1β参与角膜损伤后的炎症反应和伤口愈合,研究发现IL-1β能够抑制角膜上皮干细胞的增殖和干性并促进其分化[23];过表达IL-1β还诱导了角膜上皮干细胞和内皮细胞的衰老和凋亡[24]。本课题组的前期研究发现氧化应激对hKCFs中炎性因子及基质重塑相关基因表达影响显著,其中IL-1β上调幅度最大,提示IL-1β可能参与圆锥角膜疾病的发生、发展[25]。
RNA测序和多重质谱分析显示,圆锥角膜中胶原合成和成熟途径以及分解代谢途径发生变化,与正常角膜相比,圆锥角膜中Ⅰ型和Ⅲ型胶原蛋白显著减少[26-27]。Ⅰ型胶原是构成角膜基质的主要组分,在抵抗角膜变形中发挥重要作用。MMPs是一组降解胶原的酶类,在组织重塑和损伤修复中起重要作用,其表达增加可引起角膜基质降解,与圆锥角膜的发生密切相关[28]。氧化应激可通过上调多种MMPs的表达,参与皮肤损伤与动脉粥样硬化等过程,前期研究发现氧化应激可显著上调圆锥角膜成纤维细胞中MMP-1/-3的表达[29]。在前交叉韧带成纤维细胞中,IL-1β的存在能促进MMP-1/-2/-3的表达[30]。本研究发现,hKCFs中IL-1β的表达MMP-1和-3趋势一致,提示IL-1β促进了圆锥角膜MMP-1和-3的表达。
有研究发现,miRNAs在细胞生长、增殖、分化和凋亡等几乎所有重要的生物学过程中都起着至关重要的作用,至少有30种miRNAs在角膜、晶状体、视网膜等眼部组织中特异性表达,并与眼部疾病密切相关[31]。本研究发现,在过氧化氢刺激下,hKCFs中miR-24-3p,miR-26b-3p,miR-27b-5p,miR-383,MiR-548d-3p,miR-4700-3p等的基因表达存在差异,这些miRNAs可能与圆锥角膜发病有关。其中,MiR-548d-3p的表达在过氧化氢刺激6 h、12 h和24 h后均显著下降,miR-548是一个超灵长类特异性miRNA基因家族,广泛分布于几乎所有的人类染色体上,尤其是6、8和X染色体。有研究表明造血干细胞中miR-548的过表达会抑制IL-1、IL-6和IL-8的释放[32]。本文验证了MiR-548d-3p与IL-1β之间存在靶定关系。在氧化应激条件下,MiR-548d-3p模拟物可显著下调hKCFs中IL-1β、MMP-1和MMP-3表达,上调CollagenI-α2表达。提示MiR-548d-3p在圆锥角膜的氧化应激损伤介导的炎症反应中发挥了重要作用。
综上所述,本研究表明MiR-548d-3p可能通过靶定IL-1β进而调节氧化应激条件下hKCFs中MMP-1、MMP-3和CollagenI-α2的表达。提示当圆锥角膜处于氧化应激状态时,可考虑针对关键的miRNA进行抗炎治疗,降低角膜组织降解的风险,减缓或组织圆锥角膜扩张的进程。
