LiBH4基复合体系储氢材料性能研究
2021-07-20李芸
李芸

摘 要:氢能的开发和应用是解决能源危机和环境污染等问题的积极探索。宇宙中含量最丰富的元素是氢(H),氢也是公认的清洁能源。配位氢化物硼氢化锂(LiBH4)的理论储氢量很高(质量分数为18.5%),但其吸放氢条件苛刻,不利于实际应用。人们可以将两种及以上的材料组合,形成复合体系,研究表明,复合改性法能够调整LiBH4的吸放氢热力学和动力学性能。因此,本文对LiBH4基复合体系储氢材料性能的研究现状进行了梳理。
关键词:储氢材料;LiBH4;复合体系;储氢性能
中图分类号:TB34文献标识码:A文章编号:1003-5168(2021)04-0131-04
Abstract: The development and application of hydrogen energy is an active exploration to solve the problems of energy crisis and environmental pollution. The most abundant element in the universe is hydrogen (H), which is also recognized as a clean energy source. The theoretical hydrogen storage capacity of the coordination hydride lithium borohydride (LiBH4) is very high (18.5wt%), but its hydrogen absorption and desorption conditions are harsh, which is not conducive to practical applications. People can combine two or more materials to form a composite system, studies have shown that the composite modification method can adjust the thermodynamic and kinetic properties of LiBH4 for hydrogen absorption and desorption. Therefore, this paper summarized the current research status of hydrogen storage materials in LiBH4-based composite systems.
Keywords: hydrogen storage materials;LiBH4;composite system;hydrogen storage performance
傳统的化石能源是不可再生能源。随着科技进步与社会发展,人类对资源的需求量越来越大,人们一直在寻找高效、清洁、丰富、经济和可再生的新能源载体。20世纪60年代,氢能的开发获得广泛关注。氢能是世界公认的清洁能源,能量密度高,1 g氢与氧气反应,可释放1.4×105 J热量,其释放热量是燃烧1 g汽油的3倍。标准状态(10 MPa,0 ℃条件)下,氢的密度为0.089 9 g/m3,比重最轻。氢不但自身无毒、无害,而且燃烧产物只有水。20世纪末,以氢作为燃料的新能源汽车逐渐兴起。从“十二五”规划开始,我国将新能源汽车作为战略性新兴产业,并在2016年指明了氢能产业相关基础设施的发展建设规划方向,在《能源技术革命创新行动计划》中将“氢能与燃料电池技术创新”列为能源技术革命重点创新行动之一[1]。2020年10月,党的十九届五中全会讨论并通过“十四五”规划建议,其中有11处提到能源一词,建议大力推动新能源产业发展,优化能源配置,提高能源存储能力,推广绿色低碳技术[2]。
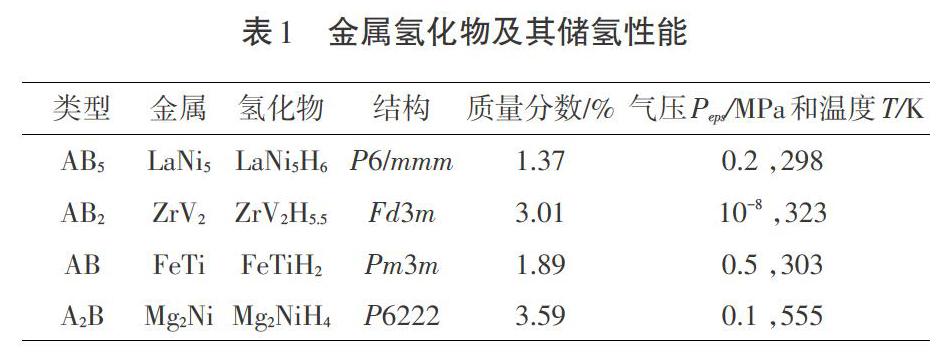
储氢材料是以物理吸附或化学结合的方式将氢以分子或原子态存储在材料中,通过控制环境变量释放或吸收氢气,达到氢能应用的目的。物理储氢材料不仅包括以活性炭、碳纳米管等为代表的碳基储氢材料,还包括沸石、金属有机框架(MOFs)等。这些材料一般具有大的比表面积或高空隙率,能够对氢气进行表面吸附。因为这类材料对氢的吸附作用力为范德华力,作用力较弱,因此氢气的释放条件比较温和。其储氢量与材料结构紧密相关,一般随着材料的表面积或空隙率增加而增多,但总体储氢量较少,质量分数一般保持在1%~6%。化学储氢材料有储氢合金、配位氢化物等。其中,储氢合金中研究较多的ABx型(x=0.5、1、2、5等)金属氢化物能够在室温下快速吸放氢,但其储氢质量分数普遍不超过3%(见表1)[3],其在车载应用中不占优势。
1 硼氢化锂(LiBH4)储氢性能
配位氢化物普遍拥有较高的含氢量,尤其以理论储氢质量分数为18.5%的LiBH4为代表。Zuttel等人[4]首次通过试验验证发现LiBH4具有作为储氢材料的潜质。它的质量储氢密度为18.5%,高于所有储氢合金和一般配位氢化物,因此其成为众多学者的研究重点[5-6]。LiBH4热力学稳定,生成焓为75 kJ/mol H2[7],其约在400 ℃附近放氢,到600 ℃以后,共放出质量分数约9%的氢气,生成产物有LiH和B[4]。
从已有研究来看,纯LiBH4吸、放氢温度较高,放氢速度缓慢,可逆性较差,难以满足工业生产中的应用要求。所以,LiBH4的改性研究非常关键,其中构建复合材料是一种有效的改性方法。复合改性法制备的复合材料能够兼具各组分材料的特点,发挥组分材料的优点,克服单一材料的缺陷。两种或两种以上的储氢材料组合在一起,形成二元或多元复合体系,可以降低体系的吸放氢温度,改变反应途径,影响加氢和脱氢产物的稳定性,而配位氢化物之间形成复合体系同样适用这一原理。
2 二元复合体系
2.1 LiBH4-LiNH2复合体系
Nakamori等人[8]将1 mol LiBH4与2 mol LiNH2混合,升温后生成Li3BN2并释放出质量分数约9.5%的氢气,其基本接近理论值,而且放氢温度降低了150 ℃,反应焓变降低了23 kJ/mol。同时,试验证实,上述反应中会有中间相Li4(NH2)3BH4生成[9],在260 ℃时会放出质量分数为11%的氢气,反应焓只有10 kJ/mol H2,但Li4(NH2)3BH4是不可逆的。Pinkerton等人[10]按照1∶2的摩尔比混合LiBH4和LiNH2,使用球磨复合法制备出由4种元素组成的复合体系储氢材科,在升温放氢试验中,加热至350 ℃,可放出质量分数为10%的氢气。但是,分解产物在8 MPa氢气下加热尚未形成稳定的氢化产物,即使添加催化剂,如五氧化二钒、二氧化钛、三氯化钛或MgH2,在高温(>673 K)和高压(>7 MPa)下也很难实现可逆吸放氢[11]。
2.2 LiBH4-MgH2复合体系
LiBH4-MgH2复合体系通过协同作用,改善LiBH4放氢动力学性能,而储氢容量不会大量衰减。这一复合体系起源于LiBH4/Mg[12],将镁当作催化剂,在温度为250 ℃时,LiBH4/Mg(质量比1∶4)混合60 min,可以吸收质量分数为6.7%的氢气,放氢温度降低到350 ℃左右。Pinkerton等人[13]制备了LiBH4-MgH2复合体系,LiBH4和MgH2的混合物比纯LiBH4分解温度降低,同时反应速度加快,400 ℃左右可逆吸/放氢质量分数最高为10%。若在系统中添加质量分数为3%的TiCl3进行混合球磨,制备出的多相复合体系储氢材料的吸放氢反应焓值明显降低,说明TiCl3起到了很好的催化作用。多篇文献报道进一步证实LiBH4与MgH2结合时发生脱氢反应,该系统反应放出氢气同时会生成LiH和MgB2[14],不仅降低总体反应温度,而且保持了高的储氢容量[15]。这一体体系的储氢性能测试结果证实该反应大约有质量分数为10.5%氢可逆析出,反应方程式如下:
LiBH4-MgH2这类储氢系统是活性氢化复合物(RHC)反应氢化体系的一个典型代表。更加深入的动力学研究发现,该反应有两个脱氢步骤。反应第一步是MgH2放氢析出镁。经过一段孕育期,LiBH4分解生成LiH和MgB2,同时释放出大量氢[16],该体系形成的二硼化镁是实现反应可逆的关键,但在试验中所观察到的反应动力学变化是缓慢的。虽然已有研究可以通过过渡金属添加剂改善这种动力学过程[16],但是效果不是很明显。Shim等人[17]系统地研究了放氢背压对LiBH4通过化学反应形成氢硼化物复合体系的影响。Nakagawa等人[18]研究LiBH4-MgH2在450 ℃温度下施加放氢背压和惰性气体时MgB2的形成情况,确定只有在氢气背压下才会形成MgB2,而MgB2的形成被认为是可逆反应的标志,成为其分解逆反应重新形成LiBH4的关键,背压低于0.3 MPa,加热时LiBH4和MgH2分解产物几乎没有MgB2,但背压升高到5 MPa后,产物趋于生成MgB2,这需要更长的反应时间,影响反应速度。纳米化后,LiBH4-MgH2体系在265 ℃下的可逆吸放氢的质量分数约为5.75%。固态脱氢的反应速度由LiH和MgB2形核和长大的速率决定,而两种反应物的界面区域对形核和长大起到关键影响[19]。将掺杂质量分数为5%~15%的多壁碳纳米管和二氧化钛(MWCNTs-TiO2)添加到LiBH4-MgH2体系中,使起始放氢从25 ℃开始,放氢量达到68 g H2/L,脱氢动力学能量也获得提高,是未掺杂体系的两倍[20]。
2.3 LiBH4-MAlH4(M=Li,Na)复合体系
Al添加剂可以用于降低LiBH4吸氢和脱氢的反应焓。但是,因为铝的氧化物覆盖层的限制,添加剂的作用往往受到抑制。因此,人们可将其他金属配位氢化物(如LiAlH4)引入并将其作为Al源,催化LiBH4的分解。混合LiBH4-LiAlH4粉掺杂过渡金属卤化物显著提高了脱氢反应动力学性能[21]。Shi等人对掺杂三氯化钛的LiBH4-NaAlH4系统的放氢行为进行了系统的对比研究[22],将LiBH4与NaAlH4之间的摩尔比分别设定为1∶1,2∶3和1∶3,分别研究非化学计量对体系储氢性能的影响。掺杂钛的LiBH4-NaAlH4系统中,球磨生成的LiAlH4在常温下释放氢气,形成Li3AlH6。温度高于100 ℃时,Li3AlH6就可以释放剩余的氢[22]。对于LiBH4-NaAlH4复合体系,RavnsbAk等人[23]制备了不同摩尔比的复合材料,以同步辐射XRD手段探讨放氢过程产物并分析放氢机理,研究系统中的可逆项。
3 三元复合体系
影响配位氢化物动力学的一个关键步骤是新相的形成和生长。这一过程涉及新相原子富集和结构重组。从这个意义上讲,液体反应体系和原位产物形核可能极大地提高氢气的反应动力学性能。液相反应的优势非常明显,液相的存在可以打破固体结构中键的束缚,溶质原子可以实现较快转移,形核均匀性提高。LiBH4-MgH2复合体系需要在一定背压下才能生成可逆相MgB2,反应动力学变化缓慢,而Al则可作为催化剂促進LiBH4在低温下分解。Chen等人[24]通过机械球磨将LiBH4-MgH2-Al制成复合材料并对其储氢性能进行研究,400 ℃和0.4 MPa条件下,相比LiBH4-MgH2体系,该体系在放氢时无孕育期,放氢动力学性能显著提高,但放氢总质量分数仅为6.5%,温度升至450 ℃时,其可以完全放氢。
4 结论
配位金属氢化物具有高质量储氢密度和高体积储氢密度,并且可以通过掺杂催化剂、纳米化或者形成复合材料等方法,改善放氢热力学和动力学,使得硼基配位氢化物具有成为移动车载能源载体的可能性。目前面临的主要挑战是如何合理调配氢化物热力学性能,提高储氢体系可逆容量,这既是实现储氢利用的关键,也是目前和今后研究的重点。人们要努力降低反应物的活化能,研究更有利的脱氢反应,加速氢气放出。硼基配位氢化物储氢材料是目前找到的比较理想的储氢载体。这类材料的理论储氢容量都很高,完全满足实际应用要求,但距离实际应用还存在一定距离。这类高容量储氢材料存在的关键问题至今还是限制其应用的瓶颈。温和条件下高容量可逆储氢材料的开发是目前氢能源动力载体的一项关键技术。研究发现,催化剂仍然是改善材料吸放氢热力学和动力学的关键,因此经济、高效的催化剂仍然是储氢材料走向实际应用的制约因素。在多相构成的体系中,利用第二相改变吸放氢反应的路径,形成协同作用,也是提高储氢容量和储氢性能的路径之一。硼氢化物储氢材料仍将是今后研究的重点,人们还需要继续在复合体系、离子取代和第二相掺杂改性方面深入探索,以改善硼基配位氢化物的储氢性能。无论是基础理论研究还是应用研究,都要兼顾储氢密度与储氢材料的物化性能,寻找二者合适的结合点,使得硼基储氢材料的应用取得突破。今后的研究工作仍然会侧重于两个方面:一是继续探索新型的高容量储氢材料;二是对现有储氢材料进行改性赋能研究。
參考文献:
[1]中国标准化研究院,全国氢能标准化技术委员会.中国氢能产业基础设施发展蓝皮书[M].北京:中国标准出版社,2016:35-63.
[2]新华社.中共中央关于制定国民经济和社会发展第十四个五年规划和二〇三五年远景目标的建议[EB/OL].(2020-11-03)[2020-12-20].http://www.gov.cn/zhengce/2020-11/03/content_5556991.htm.
[3]SCHLAPBACH L,ZUTTEL A.Hydrogen-storage materials for mobile applications[J].Nature,2001(414):353-358.
[4]ZUTTEL A,WENGER P,RENTSCH S,et al.LiBH4 a new hydrogen storage material[J].Journal of Power Sources,2003(118):1-7.
[5]DING Z,LU Y,LI L,et al.High reversible capacity hydrogen storage through Nano-LiBH4[J].Energy Storage Materials,2020(20):24-35.
[6]ZANG L,SUN W Y,LIU S,et al.Enhanced Hydrogen Storage Properties and Reversibility of LiBH4 Confined in Two-Dimensional Ti3C2[J].ACS Applied Materials & Interfaces,2018(10):19598-19604.
[7]MIWA K,OHBA N,TOWATA S I,et al.First-principles study on lithium borohydride LiBH4[J].Physical Review B,2004(69):245120.
[8]NAKAMORI Y,NINOMIYA A,KITAHARA G,et al.Dehydriding reactions of mixed complex hydrides[J].Journal of Power Sources,2006(155):447-455.
[9]CHATER P A,DAVID W I F,ANDERSON P A.Synthesis and structure of the new complex hydride Li2BH4NH2[J].Chem Commun,2007(45):4770-4772.
[10]PINKERTON F E,MEISNER G P,MEYER M S,et al.Hydrogen desorption exceeding ten weight percent from the new quaternary hydride Li3BN2H8[J].The Journal of Physical Chemistry B,2005(1):6-8.
[11]AU M,JURGENSEN A,ZEIGLER K.Modified lithium borohydrides for reversible hydrogen storage[J].The Journal of Physical Chemistry B,2006(51):26482-26487.
[12]MAO J F,WU Z,CHEN T J,et al.Improved hydrogen storage of LiBH4 catalyzed magnesium[J].The Journal of Physical Chemistry C,2007(33):12495-12498.
[13]PINKERTON F E,MEYER M S,MEISNER G P,et al.Phase boundaries and reversibility of LiBH4/MgH2 hydrogen storage material[J].The Journal of Physical Chemistry C,2007(35):12881-12885.
[14]SHAW L L,WAN X,HU J Z,et al.Solid-State Hydriding Mechanism in the LiBH4+MgH2 System[J].Journal of Physical Chemistry C,2015(17):8089-8098.
[15]ICHIKAWA T,FUJII H,ISOBE S,et al.Rechargeable hydrogen storage in nanostructured mixtures of hydrogenated carbon and lithium hydride[J].Applied Physics Letters,2005(86):241914.
[16]SENBERG U B,DOPPIU S,MOSEGAARD L,et al.Hydrogen sorption properties of MgH2-LiBH4 composites[J].Acta Materialia,2007(11):3951-3958.
[17]SHIM J H,LIM J H,RATHER S,et al.Effect of Hydrogen Back Pressure on Dehydrogenation Behavior of LiBH4-Based Reactive Hydride Composites[J].The Journal of Physical Chemistry Letters,2009(1):59-63.
[18]NAKAGAWA T,ICHIKAWA T,HANADA N,et al.Thermal analysis on the Li-Mg-B-H systems[J].Journal of Alloys and Compounds,2007(446):306-309.
[19]DING Z,WU P K,SHAW L,et al.Solid-State hydrogen desorption of 2MgH2 + LiBH4 nano-mixture:A Kinetics mechanism study[J].Journal of Alloys and Compounds,2019(806):350-360.
[20]PLERDSANOY P,CHANTHEE S,Utke R,et al.Compaction of LiBH4-MgH2 doped with MWCNTs-TiO2 for reversible hydrogen storage[J].International Journal of Hydrogen Energy,2016(42):978-986.
[21]MAO J F,GUO Z P,LIU H K,et al.ChemInform Abstract:Reversible Hydrogen Storage in Titanium-Catalyzed LiAlH4-LiBH4 System[Z].2010.
[22]SHI Q,YU X,FEIDENHANS L R,et al.Destabilized LiBH4-NaAlH4 Mixtures Doped with Titanium Based Catalysts[J].The Journal of Physical Chemistry C,2008(46):18244-18248.
[23]RAVNSAB?K D B,JENSEN T R.Tuning hydrogen storage properties and reactivity:Investigation of the LiBH4-NaAlH4 system[J].Journal of Physics and Chemistry of Solids,2010(71):1144-1149.
[24]CHEN C J,CHEN M,XIAO X Z,et al.Superior Reversible Hydrogen Storage Properties and Mechanism of LiBH4-MgH2-Al Doped with NbF5 Additive[J].Journal of Physical Chemistry C,2018(46):7613-7620.
[25]程昶鈞.4LiBH4-MgH2-Al储氢体系的催化及纳米化改性研究[D].杭州:浙江大学,2019:16-18.
