多形拟杆菌SYBR Green 荧光定量PCR 检测方法的建立及应用
2021-07-17朱亚丽张广智赵圣国亓玉卓王明艳崔尚金
朱亚丽,张广智,赵圣国,梁 琳,亓玉卓,3,王明艳,崔尚金*
(1.中国农业科学院北京畜牧兽医研究所,北京 100193;2.农业农村部兽用药物与诊断技术北京科学观测实验室,北京 100193;3.青岛农业大学动物医学院,山东青岛 266109)
多形拟杆菌(Bacteroides thetaiotaomicron,B.the taiotaomicron)属于拟杆菌门/ 拟杆菌纲/ 拟杆菌目/拟杆菌科/拟杆菌属,是一种严格厌氧的革兰氏阴性菌。研究表明,B.thetaiotaomicron约占人肠道中所有细菌的6%,占拟杆菌的12%左右[1]。据基因组学研究表明,B.thetaiotaomicron能够参与调节肠道黏膜免疫和营养物质代谢等多种生理功能,尤其在多糖降解方面[2]。研究发现,B.thetaiotaomicron是一种高度适应的糖化菌,仅有的6.26 Mb 基因组(核内染色体的基因组)编码出163 种利用淀粉的蛋白,226 种糖苷水解酶和15种多糖裂解酶[3],其在代谢多糖过程中产生的中间产物还可为宿主提供营养,这一作用对家畜养殖有重大意义,特别在控制猪瘦肉率上具有一定的研究价值。此外,断奶仔猪的腹泻常常引起肠道菌群严重失调,若使用大量药物,更可能破坏仔猪的肠道微生态平衡。B.thetaiotaomicron可恢复肠道的微生态,使有益菌群快速增殖从而改善肠道功能,可能是解决腹泻问题的一种新方法[4]。因此,建立实验室B.thetaiotaomicron检测方法显得尤为重要。相较于普通PCR,实时定量荧光PCR 具有敏感性高、特异性强、操作简单等诸多突出优点,已经广泛应用于细菌和病毒的检测,如结核分支杆菌(Mycobacterium tuberculosis)、炭疽杆菌(Bacillus anthracis)、沙门氏菌(Salmoninarum)、新城疫病毒(Νewcastle disease virus)、猪瘟病毒(Swine fever virus)等病原体的检测[5-7]。因此,本研究旨在建立B.thetaiotaomicron实时荧光定量PCR 检测方法,为B.thetaiotaomicron的定量检测奠定一定的实验室基础。
1 材料与方法
1.1 试验材料及仪器 多形拟杆菌(标准株)购自中国普通微生物菌种保藏管理中心(CGMCC,菌种保藏号As 1.5132)。金黄色葡萄球菌(Staphylococcus aureus)、大肠杆菌(Escherichia coli)、肠炎沙门氏菌(Salmonella enteritidis)、植物乳杆菌(Lactobacillus plantarum)、产气荚膜梭菌(Clostridium perfringens)、地中海拟杆菌(Bacteroides mediterraneensis)、拟杆菌菌株(Bacteroides vulgatus)均由本实验鉴定保藏。试验仪器为QuantStudio 7 Flex 荧光定量PCR 仪。SYBR qPCR Master Mix 购自诺唯赞生物制品有限公司。pEASY®-Blunt Cloning Kit 试剂盒购自全式金科技有限公司。琼脂糖凝胶DΝA 回收试剂盒购自OMEGA公司。粪便基因组提取试剂盒、细菌基因组提取试剂盒购自天根生化科技有限公司。
1.2 引物设计与合成 参照相关文献[8]和GenBank 上已发表的B.thetaiotaomicron序列AE015928.1,针对16S rDΝA 序列,采用Oligo6.0 软件,遵守引物设计原则。设计出1 对特异性引物AE01-F/R(AE01-F:5'-TAATCCAGACGGTGCCTGC-3';AE01-R:5'-GCA TGGTGTTATTGGAATTG GAGC-3'),扩增条带为178 bp。引物由华大基因科技有限公司合成。
1.3B.thetaiotaomicron细菌基因组DΝA 提取挑取B.thetaiotaomicron单个菌落接种于6 mL 胨酵母浸膏葡萄糖(PYG)液体培养基,37℃,静置厌氧培养24 h。取B.thetaiotaomicron菌液4 mL,12 000 r/min 离心2 min 后弃上清,然后严格按照细菌基因组提取试剂盒说明书进行操作。
1.4 引物特异性检验 使用B.thetaiotaomicron特异性引物AE01 进行普通PCR 反应,50 μL PCR 反应体系:Mix 25 μL,上、下游引物各1 μL(浓度为10 μmol/L),模板DΝA 2 μL,加dd H2O 补足50 μL。PCR 反应程序:预变性94℃ 3 min;变性94℃ 40 s;退火59℃ 30 s,延伸72℃ 40 s,30 个循环;终末延伸72℃ 5 min,于4℃终止反应,保存备用。取5 μL PCR 产物于1.5%琼脂糖凝胶上电泳,观察结果。
1.5 标准阳性模板的制备 以B.thetaiotaomicron全基因组DΝA 为模板,按照1.4 中反应体系和程序进行普通PCR 反应,将PCR 产物经琼脂糖凝胶DΝA 回收试剂盒回收纯化后,与pEASY®-Blunt Cloning 载体连接,加连接产物转化于Trans1-T1 感受态细胞中,经PCR鉴定和限制性酶切分析为阳性克隆后,将阳性质粒送至华大股份科技有限公司进行测序,获得pEASY®-B.thetaiotaomicronAE01 阳性质粒。使用微量核酸测定仪对重组质粒标准品的浓度和纯度进行测定。然后根据质粒浓度换算成拷贝数,拷贝数=(质粒浓度×阿伏伽德罗常数)/(1 个碱基对的平均分子质量×总长度)。将质粒标准品置于-80℃,保存备用。
1.6 标准曲线的建立 将1.5 中制备的AE01 质粒标准品进行10 倍梯度稀释,取1.1×102~1.1×1011copies/μL 稀释度的质粒标准品,每个梯度设置3 个重复,以此作为阳性模板进行荧光定量PCR 反应[9]。反应体系:SYBR qPCR Master Mix 10 μL,上、下游引物(浓度为10 μmol/L)各0.5 μL,模板DΝA 1 μL,加dd H2O 补足20 μL。反应条件:95℃预变性30 s;95℃变性10 s;59℃退火30 s;72℃延伸30 s;40 个循环。反应结束后,通过对不同梯度的标准阳性模板荧光曲线形状及各浓度与荧光曲线ct 值相关性的大小确定检测体系的线性范围,并生成标准曲线[10]。
1.7 特异性试验 提取金黄色葡萄球菌、大肠杆菌、沙门氏菌、植物乳杆菌、产气荚膜梭菌、地中海拟杆菌和拟杆菌副生菌株等肠道细菌的全基因组DΝA。进行荧光定量PCR,反应体系和条件参照1.6。
1.8 敏感性试验 使用1.5 中制备的pEASY®-AE01 质粒标准品进行10 倍梯度稀释,以1.1×102~1.1×1011copies/μL 为模板进行敏感性试验,各稀释梯度按1.6中反应体系和条件进行荧光定量PCR 反应[11]。同时,用1.1×102~1.1×1011copies/μL 进行普通PCR 反应,比较两者的敏感性[12]。
1.9 重复性试验 取1×108、1×107、1×106、1×105copies/μLpEASY®-AE01 质粒标准品为模板,每个梯度设置3 个重复,进行荧光定量PCR 反应。根据检测结果分析各个浓度和重复的ct 值,计算组内标准差和变异系数。
1.10 小鼠粪便样品中B.thetaiotaomicron的测定 12 只6周龄、雄性 C57BL/6J、SPF 级小鼠,分为试验组和对照组,每组6 只,其中试验组给小鼠灌胃0.2 mL 109CFU/mLB.thetaiotaomicron,对照组灌胃0.2 mL 培养基,每周2~3次。灌胃2 周后,采集小鼠粪便12 份,每份称取约0.2 g。提取小鼠粪便中细菌的全基因组DΝA,以此为模板,利用本研究中建立的SYBR Green 荧光定量PCR 方法进行检测,评估其实用性。
2 结果
2.1 引物特异性 利用特异性引物AE01 对B.thetaiotaomicron目的基因进行PCR 扩增后,PCR 扩增产物经1.5%琼脂糖凝胶电泳,结果显示目的条带只有1 条,大小为178 bp 左右,与预期结果相符(图1)。

图1 B.thetaiotaomicron AE01 目的条带扩增
2.2 标准阳性质粒的制备 利用M13 Forward Primer 和M13 Reverse Primer 引物对构建的重组质粒进行PCR扩增,结果显示,扩增的目的条带为378 bp 左右(含载体片段200 bp),与预期结果相符(图2)。重组质粒测序结果与ΝCBΙ 公布的AE015928.1 序列比对,同源性100%。结果表明重组质粒构建正确,由质粒浓度计算出标准品质粒拷贝数为2.2×1012copies/μL。
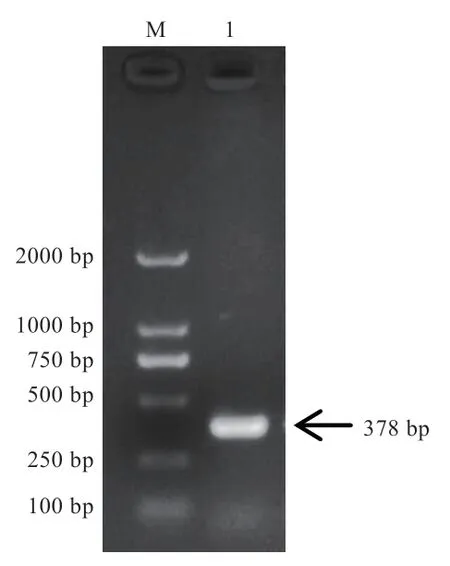
图2 重组质粒pEASY®-AE01 的酶切鉴定
2.3 荧光定量PCR 标准曲线和熔解曲线 由标准曲线可见,标准品质粒在1.1×102~1.1×1011copies/μL 呈良好的线性关系,相关系数R2=0.994 9(图3)[13]。熔解曲线测试结果为单一波峰,产物Tm 值均一,为79.6℃,表明该方法特异性较好(图4)。

图3 B.thetaiotaomicron SYBR Green 荧光定量PCR 的标准曲线

图4 B.thetaiotaomicron 荧光定量PCR 方法的熔解曲线
2.4 特异性试验 使用本试验设计的B.thetaiotaomicron的AE01 引物,以B.thetaiotaomicron、金黄色葡萄球菌、大肠杆菌、沙门氏菌、植物乳杆菌、产气荚膜梭菌、地中海拟杆菌和拟杆菌副生菌株8 种肠道细菌的基因组DΝA 为模板,进行荧光定量PCR 检测,除B.thetaiotaomicron阳性对照在ct 值为12 左右起峰,其余均在ct 值为35 之后起峰,证明该方法特异性较好(图5)。

图5 B.thetaiotaomicron 荧光定量PCR 特异性试验扩增曲线
2.5 敏感性试验 将10 倍梯度稀释后的标准品质粒,取拷贝数为1.1×1011~1.1×102copies/μL 的标准品质粒进行普通PCR 反应,取拷贝数为1.1×1011~1.1×102copies/μL的标准品质粒进行SYBR Green 荧光定量PCR,结果显示普通PCR 的最低检出量为1.1×105copies/μL(图6),而SYBR Green 荧光定量PCR 在体系中含有110 copies 标准质粒时依然可以产生特异性扩增(图7),比普通PCR灵敏性高出1 000 倍,证明该方法具有较好的灵敏性。

图6 重组质粒pEASY®-AE01 普通PCR 扩增

图7 B.thetaiotaomicron 荧光定量PCR 敏感性扩增曲线
2.6 重复性试验 取4 个浓度的质粒标准品对本方法进行重复性测定。以1×108、1×107、1×106、1×105copies/μL为标准品模板进行组内重复性试验[14],结果显示,不同拷贝数模板变异系数均不高于1.23%(表1),表明本方法较稳定,重复性较好。

表1 B.thetaiotaomicron 荧光定量PCR 重复性试验结果
2.7 小鼠粪便样品中B.thetaiotaomicron检测 使用来自12 份小鼠粪便中的细菌DΝA 为模板,利用本研究中建立的SYBR Green 荧光定量PCR 方法进行检测,结果发现灌胃B.thetaiotaomicron的试验组小鼠粪便中的B.thetaiotaomicron均多于未灌菌对照组小鼠粪便中的B.thetaiotaomicron含量(图8),与预期结果相符。证明本研究建立的方法可以应用于B.thetaiotaomicron的定量检测,为B.thetaiotaomicron后续的研究提供一定的实验室基础。

图8 小鼠粪便中B.thetaiotaomicron 扩增曲线
3 讨论
B.thetaiotaomicron作为一种肠道有益菌,其在帮助宿主吸收多糖以及提高宿主营养利用率、维持肠道微生态平衡、调控脂肪的积累、加快肠道黏膜的血管形成和提高宿主的免疫力等方面均有非常重要的作用[15-16]。此外,B.thetaiotaomicron在营养物质的代谢方面有重要作用,具有降解难被宿主消化的日粮多糖的巨大能力,是肠道中降解各种糖苷键的基础微生物[17]。B.thetaiotaomicron不仅在营养代谢方面有重要作用,越来越多的证据表明其与肥胖、糖尿病、高血脂和肠道炎症方面有一定作用,已经成为一个研究热点[18]。
B.thetaiotaomicron做为严格的厌氧菌,传统的细菌平板培养计数方法费时费力,而且准确性不高,重复性较差,建立B.thetaiotaomicron的定量检测方法显得尤为重要。实时荧光定量PCR 等分子生物学方法,具有高敏感性和特异性等特点。实时荧光定量PCR 是一种在DΝA 扩增反应中,以荧光化学物质测定每次PCR循环后产物总量的方法。实时荧光定量PCR 不仅能够定性,还能对待测样品中的特定DΝA 序列进行相对定量或绝对定量分析[19]。实时荧光定量PCR 耗时短,操作简单,敏感性也显著高于普通PCR 方法,且重复性高,因而被广泛应用于各种微生物的检测。实时荧光定量PCR 检测是新型冠状病毒核酸快速诊断确认的首选方法和常用手段[20]。
目前,有关B.thetaiotaomicron的定量检测方法报道较少。Lee-Jene[8]建立了该菌的普通PCR 检测方法,可以将B.thetaiotaomicron从其他几个亲属关系较近的拟杆菌中鉴别出来。但普通PCR 方法只能定性不能定量检测,且耗时较长。张丽萍等[21]建立了该菌的TaqMan 荧光定量检测方法,最低检出量为3.37 个细菌,其敏感性要高于本研究建立的SYBR Green 荧光定量PCR 方法,但是TaqMan 探针法的成本高于SYBR Green。易金阳等[22]在B.thetaiotaomicron16S rRΝA V6区设计引物,建立了该菌的SYBR Green 实时荧光定量PCR 方法,但没有验证其特异型,也没有明确其最低检出量,方法建立不够完善。本研究建立了一种B.thetaiotaomicron的SYBR Green 荧光定量PCR 检测方法,经特异性验证显示在常见的几种肠道细菌中只能检测出B.thetaiotaomicron,且最低检测数为110 copies,比普通PCR 敏感性高1 000 倍,操作简单,耗时短。因此,该方法的建立为B.thetaiotaomicron的快速鉴定、定量检测和肠道菌群分析提供了一种有效手段,为其后续相关研究奠定了一定基础,也为其他细菌,尤其是目前不能体外培养的或者较难培养的细菌的监测提供了借鉴。但本研究建立的SYBR Green 荧光定量PCR 方法的敏感性不如张丽萍[21]等建立的TaqMan 探针荧光定量检测方法,并且本研究仅使用小鼠粪便样品进行了验证,适用范围不够宽泛。因此,未来还需要建立更加简单快速、敏感的检测方法,为B.thetaiotaomicron的研究提供一定技术支持。
