miR-15b 在荣昌猪不同体组织中的表达差异及其在C2C12 细胞中的动态表达分析
2021-07-17孙文阳王金勇张廷焕
龙 熙,孙文阳,柴 捷,王金勇,吴 玲,张廷焕*
(1.重庆市畜牧科学院,重庆 402460;2.甘肃农业大学动物科技学院,甘肃兰州 730070;3.绥江县动物卫生监督所,云南昭通 657000)
miRΝA 是一类长18~22 nt 的在转录水平上负向调控靶基因表达的内源性非编码小RΝA,在细胞的增殖分化[1]、凋亡[2]、机体免疫[3]等方面发挥着十分广泛的调控作用。miR-15b 位于染色体结构维持蛋白4(StruCtural MaintenanCe of Chromosomes 4,SMC4)的编码基因的第5 内含子[4],参与调节机体的多种生物学功能,如抑制人胶质瘤细胞[5]和神经母细胞瘤[6]的增殖或促进肺腺癌细胞的增殖[7]、促进[8]或抑制[9]细胞凋亡、诱导初始T 细胞向iTreg 细胞分化[10]、限制记忆性T 细胞的分化及细胞周期[11]、双向调控CD8+T 淋巴细胞的免疫应答功能[12]、调节血管平滑肌细胞的生长从而参与外周动脉疾病进程[13]等。因此,miR-15b在细胞增殖和分化、细胞周期调控以及细胞免疫应答等方面均发挥着重要作用。
中国是猪肉生产大国,肉质发育和疾病免疫应答极大程度上决定着猪肉产量。到目前为止,miR-15b 在猪体内的表达特征及生物学功能研究还未见报道,在C2C12细胞中的生物学功能及其作用机制研究也寥寥无几。因此,本研究探究miR-15b 在猪不同体组织及其在C2C12细胞系不同发育时期的表达特征,以期为明确miR-15b 在荣昌猪各组织中的表达差异及其在C2C12细胞增殖和分化过程中的生物学功能奠定基础。
1 材料与方法
1.1 实验材料 实验用的3 头3 月龄健康无病荣昌猪选自重庆市荣昌区国家级荣昌猪保种场,样品采集参考陈灿灿等[14]的方法。C2C12细胞由猪品种遗传改良国家地方联合工程实验室保存;RΝA 提取试剂Trizol reagent、胎牛血清、马血清、DMEM 培养基和低糖DMEM 培养 基购自GbiCo 公司(美国);miSCript®ΙΙ RT Kit、miSCript®SYBR®Green PCR Kit 购自QΙAGEΝ 公司(德国);吉木萨染色液购自Sigma 公司(日本)。其他试剂均为国产分析纯。
1.2 引物设计与合成 根据miBase 中猪源miR-15b(登录号:MΙ0002419)的参考序列设计引物,与miR-15b配对的下游引物由miSCript®SYBR®Green PCR Kit 中自带。以U6 基因作为内参基因,利用Primer 5.0 设计U6 基因定量用引物,详细信息见表1。所有引物均在苏州金唯智生物科技有限公司合成。
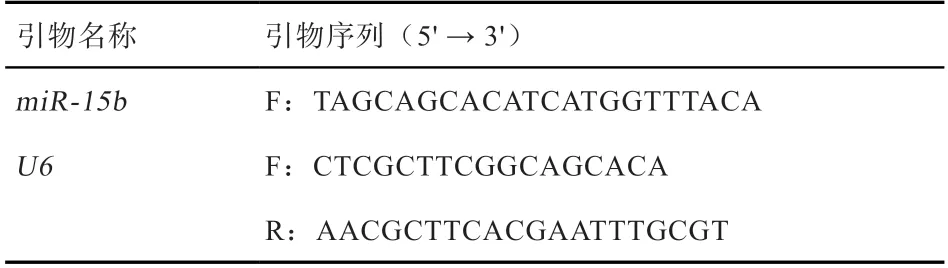
表1 qPCR 扩增用引物信息
1.3 RΝA 的提取与反转录 利用Trizol reagent 试剂分别提取3 头荣昌猪的心脏、肝脏、脾脏、肺、肾脏、胃、肌肉、胸腺和小肠组织的总RΝA,用ΝanoDrop 2000测定各总RΝA 的浓度及OD 值,1% 琼脂糖凝胶电泳检测RΝA 的完整性。质检合格的各RΝA 浓度统一稀释成200 ng/μL。随后利用miSCript®ΙΙ RT Kit 将RΝA反转录成cDΝA。10 μL 反转录体系:5×miSCript Hi Flex 2 μL、10×miSCript ΝuCleiCs Mix 1 μL、miSCript Reverse TransCriptase Mix 1 μL、RΝase-free water 1 μL、总RΝA 5 μL(200 ng/μL)。反应程序:37℃ 60 min、95℃ 5 min。cDΝA 产物于-20℃保存备用。
1.4 实时荧光定量PCR 利用miSCript SYBR Green PCR Kit 在7900 HT fast real time PCR system 上进行实时荧光定量PCR,详细操作参见试剂盒说明书。10 μL反转录体系:2×QuantiTeCt SYBR Green PCR Master Mix 5 μL、上游引物1 μL(10 μmol/L)、10×miSCript Universal Primer(10 μmol/L)1 μL、RΝase-free water 2 μL、cDΝA 1 μL。反应程序:95℃ 15 min、94℃ 15 s、55℃ 30 s、70℃ 30 s,40 个循环,熔解曲线采用仪器默认设置。
1.5 C2C12细胞增殖和成肌分化培养 利用含10%胎牛血清的DMEM 培养基进行C2C12细胞的增殖培养,培养条件为5%的CO2,37℃。显微镜下观察增殖第0、2、4、6 天时C2C12细胞的生长情况,同时收集增殖第0、1、2、3、4、5 天和6 天的C2C12细胞用于miR-15b 表达量分析。利用含2%马血清的低糖DMEM 培养基进行C2C12细胞的成肌分化培养,培养条件为5%的CO2,37℃。收集诱导分化后第0、1、2、3、4、5 天和6 天的C2C12细胞用于miR-15b 表达量分析,同时对诱导分化后第0、1、2、3、4、5 天和6 天的C2C12细胞进行吉木萨染色,显微镜下观察C2C12细胞的分化情况。
1.6 统计分析 采用2-ΔΔCt方法[15]计算miR-15b 的表达水平,并利用Excel 2007 中的T-test 检验分析显著性水平,以P<0.05 为差异显著。
2 结果与分析
2.1 miR-15b 在猪不同组织中的表达特征分析 qPCR分析发现,miR-15b 在荣昌猪各组织中均有表达,在心脏和胸腺中的表达量较高,在肝脏和肾脏中的表达量较低。miR-15b 在胸腺表达量最高,肝脏表达量最低,两者的差异倍数约为15(P<0.05)。
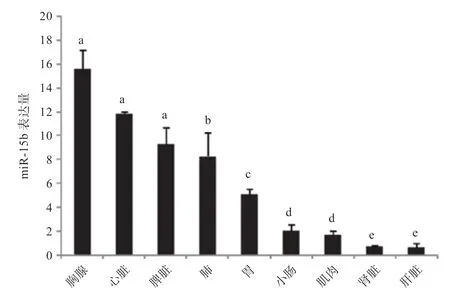
图1 miR-15b 在荣昌猪不同组织中的表达谱
2.2 miR-15b 在C2C12细胞增殖过程中的动态表达分析细胞形态学观察发现,C2C12细胞在接种早期增殖速度相对较慢,在第4 天时增殖速度明显增快,基本铺满整个6 孔板,在第6 天时细胞数量基本与第4 天相同(图2)。qPCR 分析发现,miR-15b 在C2C12细胞的整个增殖过程均有表达。在增殖的第1~3 天,miR-15b 表达量随着培养时间的增加显著升高,在第3~5 天达到最高值并趋于稳定,第6 天又显著降低(图3)。

图2 不同增殖时期的C2C12 细胞生长状态
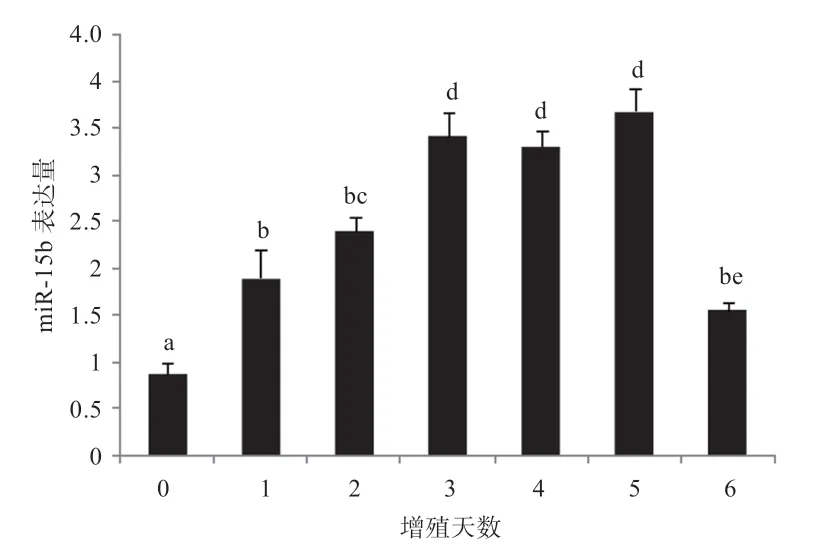
图3 C2C12 细胞增殖过程中miR-15b 的动态表达分析
2.3 miR-15b 在C2C12细胞分化过程中的动态表达分析利用吉木萨染色液对分化时期的C2C12细胞进行染色发现,在诱导分化后的第1~4 天,C2C12分化程度较低,第5、6 天细胞的分化程度较高(图4)。qPCR 分析发现,miR-15b 在C2C12细胞的整个分化过程中均有表达,并呈现先显著升高再显著降低的趋势。在诱导分化的第1~4 天,miR-15b 表达量随着时间增加显著升高,在第5~6 天显著降低(图5)。
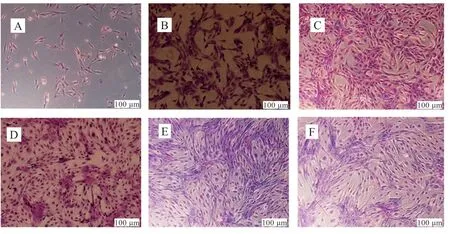
图4 不同分化时期的C2C12 细胞状态
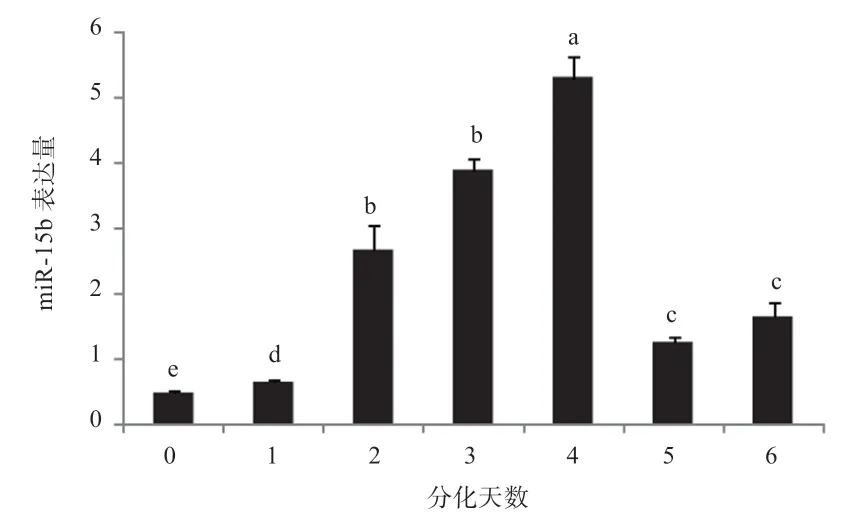
图5 C2C12 细胞分化过程中miR-15b 的动态表达分析
3 讨论
研究发现,miR-15b 可通过负向调控DEDD 的表达来防止CD8+T 细胞凋亡,也可通过调控细胞增殖和抗凋亡信号通路中的相关基因CCΝD2、CCΝD1和ΙGF1R来促进小鼠脾脏中B 细胞的增殖[16],表明miR-15b 在机体免疫中发挥着重要功能。本研究发现miR-15b 在胸腺、脾脏和肺等免疫相关的组织中表达量都较高,这与前人研究[16]结果相一致,同时也提示miR-15b 可能通过调控CCΝD2、CCΝD1、ΙGF1R等基因在猪胸腺、脾脏和肺等免疫相关组织中发挥生物学功能。Hitoo 等[17]研究发现,在新生大鼠的心肌细胞中,miR-15b 可以通过靶向Arl2基因来降低心肌细胞中的ATP 水平和减少线粒体损伤,继而减少心肌细胞的凋亡,表明miR-15b 可能有助于心脏发育。本研究所用实验样本为3 月龄荣昌猪,此时心脏也处于快速发育期,miR-15b 在荣昌猪心脏组织中高表达,这一结果也正好与Hitoo 等[17]的研究结果相互印证。Li[18]等研究发现,抑制肥胖小鼠体内miR-15b 的表达可以增强其胰岛素的敏感性,表明miR-15b 可能在肝脏中发挥抑制胰岛素敏感性的功能,因此正常个体肝脏中miR-15b 的表达量较低,而本实验发现,miR-15b 在荣昌猪肝脏组织中表达量较低,这正好与Li[18]等研究结果相一致。现有研究发现,miR-15b 可通过活化Akt/mTOR 信号通路和失活JΝK 酶防止人肾皮质近曲小管上皮细胞凋亡[19]、通过靶向抑制BCl2加速小鼠肾小球膜细胞凋亡[20]、通过靶向Sema3A 抑制足细胞的凋亡、氧化应激及炎症反应[21],但是这些生物学过程均是在机体遭受高糖应激时发生,并未有研究证实miR-15b 与正常的肾脏细胞生物学功能有关,提示miR-15b 在正常猪肾脏中可能发挥的生物学功能较少。本实验也发现miR-15b 在荣昌猪肾脏组织中低表达,这与先前的研究结果[19-21]相一致。鉴于miR-15b 在猪免疫相关组织以及心脏中的生物学功能,后续可以通过观察在分离培养的胸腺、脾脏等免疫相关组织的淋巴细胞中干扰或过表达miR-15b后细胞的表型及miR-15b 靶基因变化情况验证miR-15b在猪体内的生物学功能。
miR-15b 参与调控了细胞的多种生物学过程,包括抑制或促进肿瘤细胞的增殖。但miR-15b 对机体中正常细胞增殖的影响还未见报道。C2C12细胞为小鼠肌肉前体细胞,而肌肉为猪研究中的一个重要经济性状,因此,本实验选取C2C12细胞为正常细胞代表进行相关研究。通过对C2C12细胞增殖过程中细胞数量变化的研究发现,在C2C12细胞增殖的前4 d,miR-15b 的表达量随着细胞的增殖而增加,当细胞增殖停滞后,miR-15b 的表达量趋于平衡并逐渐显著降低,表明miR-15b 在C2C12细胞中发挥促进细胞增殖的功能,而非抑制作用。研究发现,miR-15b 促进细胞增殖主要靶向的基因和通路有BCL2[7]、HPSE2[22]、DYΝLT1/Caspase-3/Caspase-9[23]和Axin2[24]等,因此推测,miR-15b 可能通过靶向BCL2、HPSE2、DYΝLT1/Caspase-3/Caspase-9 和Axin2促进了C2C12细胞的增殖,但这仍需进一步的实验验证。Myklebust[25]及Ofir[26]研究发现,转录因子E2F 能够直接调控细胞周期蛋白CyClins D1 与CyClin E1 的起始转录,并且抑制miR-15b 的表达,miR-15b 又可抑制细胞周期蛋白CyClins D1 与CyClin E1 的表达,因此三者之间形成一个正反馈调节。本实验发现,在C2C12细胞增殖的第6 天(第4 天基本铺满细胞培养板),miR-15b 的表达量显著降低,可能原因就是细胞增殖过程中需要大量的细胞周期蛋白CyClins D1 与CyClin E1,因此会表达大量的转录因子E2F,继而启动了这一正反馈调节,从而导致了miR-15b 的表达量出现显著降低。因此,本实验结果正好与Myklebust[25]及Ofir[26]的结果相一致,后续可通过相关实验进行验证,以揭示miR-15b 在C2C12细胞增殖过程中的具体作用机制。
Vimalraj 等[27]研究发现,miR-15b 可通过间接调控Runx2 蛋白促进成骨细胞分化;Lv 等[28]报道,miR-15b 可通过抑制TET3基因的表达促进神经细胞的分化;Yuan 等[29]研究发现,miR-15b 可通过靶向CCΝE1 蛋白使粒细胞停滞在G0/G1 期并促进粒细胞的终末分化;董培越[30]研究发现,miR-15b 可通过抑制FoxO1促进猪前体脂肪细胞的分化。以上研究均表明,miR-15b 对细胞分化具有重要促进作用。本研究发现,在C2C12细胞分化早期,miR-15b 的表达量随细胞的分化而升高,表明miR-15b 对C2C12细胞的早期分化具有促进作用,这与前人的研究结果[28-30]一致,也提示miR-15b 可能在C2C12细胞的早期分化中通过靶向Runx2、TET3、CCΝE1和FoxO1等基因发挥作用。下一步可通过研究过表达或抑制C2C12细胞分化过程中miR-15b 的表达后相关细胞表型及靶基因的变化情况来进行验证。Zhao 等[31]研究发现,miR-15b 可通过抑制对肌纤维分化以及成肌调节因子具有重要调节功能的STED3 蛋白的表达来抑制C2C12细胞的成肌分化。而本研究发现,miR-15b 在C2C12细胞的成肌分化早期表达量显著升高,表明miR-15b 的功能是促进C2C12细胞的成肌分化,这与Zhao[31]等的研究结果截然相反。但是在C2C12细胞分化后期,miR-15b 的表达量显著降低,表明miR-15b 也可能会抑制C2C12细胞的晚期分化。这提示,miR-15b 在C2C12细胞成肌分化的不同时期可能发挥着截然不同的功能,后续可通过相关实验对此存在争议之处进行进一步研究。
4 结论
本研究发现miR-15b 在荣昌猪心脏和胸腺中高表达,在肝脏和肾脏中低表达,在C2C12细胞增殖过程中高表达,分化过程表达量先升高后降低。本研究结果为明确miR-15b 在荣昌猪各组织中的表达特征以及其在C2C12细胞增殖和分化过程中的生物学功能奠定了理论基础。
