TRPA1 抑制剂的高通量筛选及新型骨架的发现
2021-07-16丁强
丁强
(上海璃道医药科技有限公司,上海 201114)
TRPA1 是瞬时受体电位通道超家族中的一员[1],作为一种非选择性阳离子通道,可通透Na+,K+和Ca2+等[2]。TRPA1 主要分布在背根神经、三叉神经等初级感觉神经元上,且在肽能和非肽能神经元均有表达[3]。从分布的人体系统来看,TRPA1 高表达在外周感觉神经系统、呼吸系统、胃肠系统和泌尿系统[4],当这些器官组织出现功能异常时,TRPA1 通道的表达和功能通常也同步发生异常。TRPA1 可感受多种不同类型的刺激,如低温、内/外源性化合物和机械性刺激等[5,6],并参与机体的炎症和免疫反应[7]。基因学证据表明TRPA1 发生基因突变可导致人类疼痛[8],且药理学实验也证明TRPA1 通道的抑制剂可在多种不同的疼痛模型上有效镇痛[9,10]。此外,TRPA1 激活还可导致呼吸系统障碍[11],如咳嗽、哮喘和慢性阻塞性肺病[12,13]。
TRPA1 作为确定的镇痛和镇咳新靶点,近年来国际上各大制药公司都在围绕TRPA1 通道进行创新药物研发和布局,但尚无小分子被批准上市[14]。黄嘌呤衍生物HC030031 是TRPA1 的经典抑制剂,在小鼠模型中通过静脉注射可以缓解缓激肽引起的触觉异常痛敏,口服可减轻异硫氰酸烯丙酯(AITC)诱导的疼痛,在炎症模型中表现出抗炎活性[15];雾化吸入可以减轻豚鼠模型中丙烯醛或者肉桂醛引起的咳嗽,同样对哮喘模型也有效[16]。GRC-17536 是格伦马克推进到临床2 期的TRPA1 抑制剂,适应症为糖尿病性周围神经痛和呼吸系统疾病[17]。该分子已经在捷克、德国和英国等国家完成概念性验证实验,效果显著,且无明显副作用,目前还在积极推动中。除此之外,礼来、罗氏、雅培、安进、诺华和阿斯利康等均布局了TRPA1 抑制剂的专利[18]。面对这一国际研发新趋势,国内尚缺乏靶向TRPA1 通道的药物研发管线,显著落后于国际研发进度。
本研究利用自动化高通量筛选系统和手动膜片钳检测技术,靶向TRPA1 通道,对自建的已上市药物样品库进行抑制活性筛选,发现多种不同特性的三环类分子具有明显的TRPA1 抑制活性,且结构呈现一定的规律性。在已报道的TRPA1 抑制剂中,还没有三环类骨架,本研究将为TRPA1 抑制剂的药物研发提供新的骨架结构。
1 材料与方法
1.1 试剂
AITC 购自Sigma;HC030031 由Biobond 制药公司合成;酮替芬和苯噻啶苹果酸酯购自九鼎化学;米安色林和米氮平购自毕得医药;奥氮平购自安耐吉化学。
细胞培养用的DMEM培养基、灭瘟素、潮霉素B、1%青霉素- 链霉素溶液和胎牛血清购自Invitrogen;0.25%胰酶溶液购自Life technologies;强力霉素购自Sigma。
1.2 仪器设备
细胞培养箱和超净台购自Thermo fisher;超低温冰箱购自浙江和利制冷设备有限公司;精密电子天平和pH 测量仪购自Sartorius;IonWorks Barracuda 高通量筛选系统购自美国Molecular Devices;Axon700B 手动膜片钳系统购自美国AXON;电极拉制仪购自美国Sutter;快速程控压力给药系统购自法国Bio-Logic。
1.3 方法
1.3.1 构建稳转细胞株
将小鼠源TRPA1(mTRPA1)通道的cDNA 全长亚克隆到pcDNATM5/FRT/TO 质粒中,整合后的质粒克隆到Flp-InTM-293宿主细胞,使用灭瘟素和潮霉素B 进行压力筛选,得到稳定表达mTRPA1 通道基因的稳转细胞系。
1.3.2 细胞培养
mTRPA1 稳转细胞培养基含有90% DMEM+10%胎牛血清+1%青霉素- 链霉素+15μg/mL 灭瘟素+200μg/mL 潮霉素B。细胞置于培养瓶中,放入37℃、5% CO2的无菌培养箱,待细胞密度达到80%左右进行传代或铺板。需要检测时,稳转细胞经强力霉素诱导过表达mTRPA1 通道。
1.3.3 手动全细胞膜片钳检测
电流记录采用Axon700B 膜片钳放大器,信号采集使用pClamp10 软件,采样频率10 kHz,滤波2 kHz,电极电阻2~4 MΩ。细胞钳制在0 mV,电压刺激命令是一个-100 mV 到+100 mV 的斜坡电压,时程300 ms,每2 s 给予一个电压刺激。化合物是由快速程控压力给药系统给予细胞。外液(mM):140 NaCl, 5 KCl, 1 MgCl2, 10 HEPES, 0.5 EGTA, 10 Glucose (pH 7.4);内液(mM):140 CsCl, 10 HEPES, 5 EGTA, 0.1 CaCl2, 1 MgCl2(pH 7.2)。
1.3.4 IonWorks Barracuda(IWB)高通量筛选
刺激电压和内外液成分与手动膜片钳检测相同,但内液中加入0.1 mg/mL 膜穿孔试剂两性霉素B。在PPC384 孔板中加入细胞外液,PPC 板下加入细胞内液,进行封接测试,最后将细胞内液换成含两性霉素B 的细胞内液,使封接的细胞穿孔后形成全细胞记录模式。数据记录和电流幅度测量导出由IWB 软件完成(version 2.5.3,Molecular Devices Corporation,Union City,CA)。封接阻抗低于20 MΩ 的孔将不纳入数据统计。原始电流数据由软件进行漏减矫正,mTRPA1 电流幅度在+100 mV 时测得。
2 结果
2.1 mTRPA1 稳转细胞株的构建和活性验证
mTRPA1 的cDNA 经标准操作流程整合到宿主细胞Flp-InTM-293 的染色体后,经过15 μg/mL 灭瘟素和400 μg/mL 潮霉素B 的压力筛选,得到mTRPA1 基因稳定传代的细胞株。为了确认稳转细胞株能否表达有活性的mTRPA1 通道,我们使用1 μg/mL 强力霉素诱导,并应用手动膜片钳进行验证(图1)。AITC 和HC030031(HC)分别是TRPA1 通道的经典激动剂和抑制剂。检测结果显示,AITC 可诱导出明显的通道电流,且电流呈现典型的TRPA1 通道特点,即外向整流、可被HC030031抑制和反转电位0 mV。

图1 手动膜片钳验证mTRPA1 稳转细胞株的活性
2.2 已上市药物样品库的构建及TRPA1 抑制剂的高通量筛选
目前,有许多靶向TRPA1 通道的药物研发,但尚无小分子被批准上市。我们建立了大样本量的已上市药物样品库,化合物总数超过2000 个,含有多种不同类型的化学结构,其适应症包括胃肠道疾病、老年痴呆、疼痛、尿失禁、抑郁、镇咳、降血压、抗组胺、抗过敏、抗精神病和催吐等。我们采用IWB 高通量筛选平台,结合mTRPA1 稳转细胞株,对已上市药物样品库的mTRPA1 抑制活性进行全面评价。此平台是基于电流检测,因此相关评价更直观和精确,检测结果如图2 所示,多种化合物均呈现mTRPA1 抑制活性。
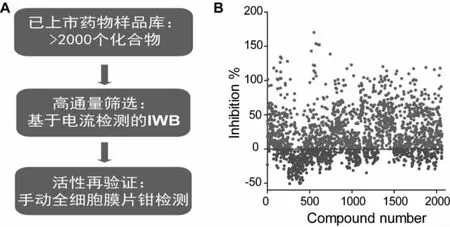
图2 TRPA1 抑制剂的筛选流程和高通量筛选汇总
2.3 具有mTRPA1 抑制活性的三环类骨架分子
对IWB 高通量筛选得到的具有mTRPA1 抑制活性的化合物进行结构分析,我们发现在已上市药物样品库中,多个三环类分子具有明显的mTRPA1 抑制活性,且结构呈现出一定的规律性,其化学结构和抑制IC50(μM)如图3 所示。根据临床应用,这些三环类分子分别具有抗抑郁、抗精神病和抗组胺等特性。

图3 具有mTRPA1 抑制活性的三环类分子结构
2.4 确证若干三环类分子的mTRPA1 抑制活性
在IWB 高通量筛选中,米安色林、米氮平、奥氮平、乙酰哌普嗪、酮替芬和苯噻啶苹果酸酯的抑制活性较强。我们采用手动膜片钳进一步确认这些三环类分子的活性,并检测其剂量效应。如图4 所示,上述三环类分子在手动膜片钳系统中的抑制IC50与高通量筛选结果基本一致,进一步确认了这些三环类分子的mTRPA1 抑制活性,且验证了IWB 高通量筛选系统的精确性。

图4 手动膜片钳验证若干三环类分子的TRPA1 抑制活性
3 讨论
TRPA1 作为一种可通透Na+,K+和Ca2+的非选择性阳离子通道,近年来在药物研发领域受到越来越多的关注,尤其是疼痛。TRPA1 通道是最具潜力的新型镇痛靶点,主要有以下特点:(1)安全性高:TRPA1 通道主要分布于外周,在中枢神经系统和心脏中的表达丰度很低[4],极大降低了其中枢和心脏副作用的风险,与其它靶点相比显示出极大优越性,且针对外周靶点开发镇痛药物是当前镇痛药物研发的重要趋势。而且,TRPA1 是人TRPA 亚家族中的唯一成员,减少了通道特异性的风险。(2)TRPA1 通道与人疼痛关系明确:TRPA1 是明确的人疼痛感受器,其基因突变可导致人类疼痛,具有明确的基因学证据支持TRPA1 通道,符合药物靶点的主流理论。(3)已有TRPA1 抑制剂镇痛效应优异:目前已有数个小分子化合物进入了临床I 期和II 期研究,主要用于治疗糖尿病性神经痛和急性疼痛,如GRC-17536 和CB-625,且GRC-17536 的镇痛效应已经经过概念性验证。此外,许多临床前动物药效实验也证明,TRPA1 抑制剂对多种伤害性疼痛、内脏痛、神经痛和纤维肌痛均有较好的镇痛活性,表明TRPA1 靶点存在广谱的镇痛效应。同时,TRPA1的功能改变还可导致呼吸系统和胃肠道系统的异常,因此,TRPA1 靶点的适应症具有广阔的开发前景。
国内由于缺乏高通量筛选平台和新型骨架结构,对TRPA1通道靶点的布局与国外相比严重滞后。本研究通过构建mTRPA1 稳转细胞株和超过2000 个化合物的已上市药物样品库,利用基于电流检测的IWB 高通量筛选系统和手动膜片钳,发现了众多具有TRPA1 抑制活性的化合物。通过结构分析,我们发现一系列具有三环类骨架的分子均具有明显的TRPA1 抑制活性,且结构呈现一定的规律性。三环类分子是临床上的一类重要药物,具有抗抑郁、抗组胺、抗精神疾病或抗过敏等活性。有趣的是,临床上很多三环类分子还可用于镇痛,如抗抑郁药阿米替林可用于纤维肌痛综合征和糖尿病性周围神经痛的治疗,但其确切机制通常并不清晰。本研究可能为临床上多种三环类分子拓展镇痛适应症提供理论基础。
三环类骨架作为TRPA1 通道的抑制剂尚未被报道,通过系统的构效关系优化,可能找到抑制活性更强且具有全新结构类型的TRPA1 抑制剂,并针对TRPA1 的相关适应症进行生物活性验证,从而找到合适的候选化合物。本研究的发现将为国内靶向TRPA1 通道进行新药研发提供新型骨架分子做出有益探索。
