鹿角杯形珊瑚溶菌酶PdLYZ重组蛋白的表达及其体外抑菌活性特征
2021-07-16倪兴振邢皓程王佑笑杨倩曦闫智聪赵建民
唐 佳,倪兴振,邢皓程,王佑笑,杨倩曦,闫智聪,周 智,赵建民
(1. 中国科学院 烟台海岸带研究所,山东 烟台 264003; 2. 中国科学院大学,北京 100049;3. 海南大学 海洋学院,海口 570228; 4. 海南华侨中学,海口 570226)
珊瑚礁生态系统是重要的海洋生态系统之一,栖息着全球多达四分之一的海洋生物,被誉为“海洋中的热带雨林”,为人类提供了食物、生态和社会经济文化等服务[1-2]。造礁石珊瑚是珊瑚礁生态系统的支柱生物,其通过与虫黄藻和细菌等微生物共生来适应强光照寡营养的礁区环境,因此维持健康的微生物群落结构对造礁石珊瑚的健康尤为重要。当前全球气候变暖导致的海水升温迫使造礁石珊瑚外排共生虫黄藻,珊瑚因营养短缺而免疫力下降,机会致病菌[例如:溶珊瑚弧菌(Vibrio coralliilyticus)]的致病力相对显著提升,造成了某些珊瑚疾病的爆发率显著升高[3]。因此,亟需开展造礁石珊瑚免疫防御机制的相关研究,尤其是高温对珊瑚免疫的影响。造礁石珊瑚与其他无脊椎动物一样,依靠固有免疫应答来识别和清除入侵的病原菌等微生物[4]。此外,珊瑚还能通过固有免疫应答控制共附生菌群中病原菌的数量和比例,进而降低病原菌的潜在威胁[5]。珊瑚的凋亡、自噬、抗菌肽、氧化还原系统、酚氧化酶系统和补体系统等均参与了致病微生物的控制和清除[6-7]。抗菌肽是生物中普遍存在的一类阳离子活性多肽,是机体非特异性免疫的关键因子之一,目前已从多种无脊椎动物中分离出具有活性的抗菌肽[8]。近年来,分子生 物学和基因组学的迅猛发展促进了免疫相关基因的挖掘,更好地推动珊瑚固有免疫应答和共附生菌群调控的深入研究。溶菌酶属于抗菌肽家族,是生物体内一种具有杀菌作用的重要抗菌蛋白,其通过催化水解细胞壁中N-乙酰氨基葡萄糖和N-乙酰胞壁酸之间形成的β-1,4糖苷键而破坏细菌的细胞壁[9-12]。目前,已有许多研究聚焦于无脊椎动物的溶菌酶,但对造礁石珊瑚,甚至刺胞动物中溶菌酶的了解还不清楚,仅有类溶菌酶活性的相关报道,且缺乏确切的分子证据[13-14]。例如,有研究表明受黄带病影响的珊瑚(Orbicella faveolata)中具有较高的类溶菌酶活性[15];海扇可能通过增加类溶菌酶和壳多糖酶活性抵抗微生物入侵[16];华丽黄海葵(Anthopleura elegantissima)和等指海葵(Actinia equina)的粘液均具有类溶菌酶活性[17-18]。鹿角杯形珊瑚(Pocillopora damicornis)隶属动物界(Animalia)、刺胞动物门(Cnidaria)、珊瑚纲(Anthozoa)、石珊瑚目(Scleractinia)、杯形珊瑚科(Pocilloporidae)、杯形珊瑚属(Pocillopora),广泛分布于太平洋和印度洋的热带和亚热带浅海海域。鹿角杯形珊瑚已作为模式生物用于探究造礁石珊瑚对病原菌,以及病原菌和高温交互作用的响应研究中。例如,BEN-HAIM等[19]分离出一种温度依赖型的溶珊瑚弧菌,该病原菌在水温超过26 ℃时,可在2周内迅速破坏鹿角杯形珊瑚的组织[19]。笔者克隆了鹿角杯形珊瑚的溶菌酶基因PdLYZ,随后体外诱导表达并纯化PdLYZ重组蛋白,同时测定PdLYZ重组蛋白对大肠杆菌(Escherichia coli),变异链球菌(Streptococcus mutans)和溶珊瑚弧菌(V. coralliilyticus)的抑菌活性,还探究了PdLYZ重组蛋白在高温条件下对病原菌溶珊瑚弧菌抑制活力的变化,从而揭示溶菌酶在珊瑚免疫应答中扮演的重要作用。
1 材料与方法
1.1 实验生物鹿角杯形珊瑚采自文昌市铜鼓岭岸礁,采后置于盛有500 L天然海水的玻璃缸中暂养1个月。暂养条件:温度26 ℃,盐度35,光照∶黑暗时间为12 h∶12 h。受试菌株:大肠杆菌(E. coli,A TCC 25922)、变异链球菌(S. mutans,ATCC 700610)和溶珊瑚弧菌(V. coralliilyticus,SCSIO 43001)。
1.2 实验试剂DNA提取试剂Trizol购自美国invitrogen公司;逆转录试剂盒M-MLV Reverse Transcriptase Kit购自普洛麦格(北京)生物技术有限公司;PCR试剂、PCR克隆试剂盒(PMD19-T Vector Cloning Kit和MiniBEST Agarose Gel DNA Extraction Kit)购自宝生物工程(大连)有限公司;Trans5α感受态细胞、Trans BL21(DE3)pLysS化学感受态细胞和连接转化试剂盒(pEASY-E1 Expression Kit)购自全式金生物技术有限公司;镍琼脂糖凝胶FF购自北京韦氏博慧色谱科技有限公司;其他试剂购自生工生物工 程(上海)股份有限公司或北京索莱宝科技有限公司。
1.3 鹿角杯形珊瑚总RNA提取和cDNA合成将珊瑚小枝置于液氮中充分研磨后加入1 mL Trizol,收集研磨液,将研磨液在5 000 g 4 ℃下离心5 min后去除珊瑚的碳酸钙骨骼,然后参考STEFANIK等[20]报道的方法提取鹿角杯形珊瑚的总RNA。利用M-MLV Reverse Transcriptase Kit将RNA反转获得cDNA第 一链,将获得的cDNA稀释100倍后用于PdLYZ基因的克隆。
1.4 PdLYZ基因的克隆和序列分析基于本实验室已测序和组装的鹿角杯形珊瑚转录组文库,采用局部序列排比检索基本工具(basic local alignment search tool,BLAST)检索到1条与其他已鉴定的溶菌酶基因同源的转录本,且该转录本的序列含有1个完整的开放阅读框。为了扩增PdLYZ基因开放阅读框的序列,利用引物设计软件(Primer premier 5.0)设计2条特异性引物PdLYZ_F(5′-AAATGTGACCCAAAACC ATCGA -3′)和PdLYZ_R(5′-AATCAGCATCCAGCTTTAATGATT-3′)进行PCR扩增。PCR反应总体系为50 μL。扩增条件:94 ℃ 5 min,35个循环(94 ℃ 30 s、55 ℃ 30 s、72 ℃ 1 min),72 ℃ 10 min。扩增产物4 ℃保存。扩增产物经1%琼脂糖凝胶电泳检测后用MiniBEST Agarose Gel DNA Extraction Kit进行纯化,然后将该片段连接到PMD19-T载体中并转化至Trans5α感受态细胞。挑选PCR鉴定为阳性的单克隆菌落进行测序以验证序列。
使用BLAST工具在NCBI数据库(http://www.ncbi.nlm.gov/blast)中检索PdLYZ的同源基因和蛋白。利用ExPASy数据库(https://web.expasy.org/compute_pi/)计算PdLYZ蛋白的理论等电点和相对分子量,采用SignalP 4.1数据库(http://www.cbs.dtu.dk/services/SignalP/)和NCBI数据库的保守结构域数据库(https://www.ncbi.nlm.nih.gov/cdd/)分别预测PdLYZ蛋白的信号肽和结构域。PdLYZ蛋白和其他生物溶菌酶的多序列比对通过ClustalX软件完成,然后通过多序列对比显示工具(http://www.bio-soft.net/sms/index.html)进行可视化展示。PdLYZ蛋白和其他溶菌酶的进化分析利用MEGA-X软件中的邻接法( neighbor-joining,NJ)完成,节点上的数字表示1 000次复制的自展值,用于检验进化树分支的可信度。
1.5 PdLYZ重组蛋白的表达、纯化和复性以pMD19-T-PdLYZ质粒作为模板,并使用特异性引物PdLYZ_F和PdLYZ_R扩增编码PdLYZ成熟肽的序列,将扩增的PdLYZ成熟肽插入pEASY-E1表达载体中,然后将构建好的重组质粒pEASY-E1-PdLYZ转化至Trans BL21(DE3)pLysS化学感受态细胞中。挑选阳性单克隆菌落接种到200 mL含氨苄青霉素(100 g·L-1)的卢里亚-贝尔塔尼培养基(LB培养基)培养至OD600约0.6,并添加异丙基硫代-β-D-半乳糖苷(isopropylthio-β-D-galactoside,IPTG)(终浓度1 mmol L-1)诱导PdLYZ重组蛋白表达。离心、收集菌细胞进行超声破碎(工作5 s,间隙20 s,功率200 W),破碎至菌液澄清后,12 000 r·min-14 ℃下离心30 min,收集上清液用于蛋白纯化。
采用镍琼脂糖凝胶FF对带有His标签的PdLYZ重组蛋白进行纯化,将纯化后的PdLYZ蛋白装入透析袋中,在4 ℃条件下依次用含有8、6、4、2、1、0 mol· L-1的尿素透析液(50 mmol· L-1Tris,50 mmol· L-1NaCl,1 mmol· L-1EDTA-2Na,1 mmol ·L-1还原型谷胱甘肽,2 mmol· L-1氧化型谷胱甘肽,133 mmol· L-1甘氨酸)中进行复性。通过SDS聚丙烯酰胺凝胶电泳(SDS polyacrylamide gel electrophoresis,SDSPAGE)检验PdLYZ重组蛋白的表达,纯化和复性结果。最后,参考BCA快速蛋白定量试剂盒说明书测定 PdLYZ重组蛋白的浓度。
1.6 PdLYZ重组蛋白对大肠杆菌和变异链球菌抑菌活性的测定PdLYZ重组蛋白对大肠杆菌和变异链球菌抑菌活性的测定参考ZHOU Z等[21]的方法并稍有修改。将供试菌(大肠杆菌和变异链球菌)在37 ℃200 r·min-1下培养至对数生长期,再将对数生长期的供试菌菌液在10 000 g 4 ℃下离心15 min收集细胞,将收集的细胞用PBS缓冲液洗2次后重悬至菌浓度为104cfu ·mL-1,取50 μL菌液,加入250 μL PdLYZ重组蛋白,混匀后37 ℃孵育0.5 h,采用等浓度的牛血清蛋白(BSA蛋白)作为对照。然后取20 μL混合液加入200 μL培养基(大肠杆菌:LB培养基;变异链球菌:脑心浸出液肉汤(BHI)培养基),37 ℃ 200 r·min-1培 养,每隔1 h在600 nm处测定吸光度的变化。
1.7 PdLYZ重组蛋白在不同温度下对溶珊瑚弧菌抑制活性的测定溶珊瑚弧菌26 ℃ 200 r·min-1培养至对数生长期,按照1.6部分的方法获取PdLYZ重组蛋白和溶珊瑚弧菌共孵育的菌液,然后取20 μL混合液加入200 μL 2216E液体培养基,分别于26 ℃和37 ℃下200 r·min-1培养,每隔1 h在600 nm处测 定吸光度的变化。
2 结果与分析
2.1 PdLYZ基因的分子特征PdLYZ的开放阅读框长648 bp,编码215个氨基酸。利用SignalP 4.1数据库预测PdLYZ推导蛋白的N末端有23个氨基酸残基组成的信号肽。NCBI-CDD保守结构分析结果表明,PdLYZ蛋白含有1个类溶菌酶超家族结构域(Ile31-Gly214)。ExPASy数据库分析结果揭示PdLYZ成熟肽的分子量标准和理论等电点分别为22.05 kDa和8.84。
多序列比对的结果显示,PdLYZ与萼柱珊瑚(Stylophora pistillata)中的溶菌酶(XP_022779194.1)有41.47%的相似性;与指状鹿角珊瑚(Acropora digitifera)中的溶菌酶(XP_015770608.1)有43.33%的相似性;与海绵Amphimedon queenslandica的溶菌酶(XP_011407575.1)具有30.65%相似性。上述4种生物溶 菌酶序列的多重比较共揭示5个保守的半胱氨酸(Cys26,Cys41,Cys116,Cys197,Cys204)(图1)。

图1 PdLYZ序列与其他生物溶菌酶序列比对结果Fig. 1 Multiple alignment of PdLYZ amino acid sequence with that of other animals in GenBank.Sp:柱状珊瑚Stylophora pistillata ; Ad:鹿角珊瑚Acropora digitifera; Pd:杯形珊瑚Pocillopora damicornis; Aq:海绵Amphimedon queenslandica。*代表保守的半胱氨酸。The asterisk below indicates conserved cysteine residues.
2.2 PdLYZ蛋白的进化分析基于PdLYZ蛋白的氨基酸序列采用Blastp检索NCBI中的Genbank数据库中的同源蛋白,发现PdLYZ蛋白与其他无脊椎动物的溶菌酶相似性为30.65%~44.78%;与细菌和藻类的溶菌酶相似性为25.54%~49.15%。其中与细菌Gammaproteobacteria bacterium(RKZ98632.1)的溶
菌酶相似性最高,达49.15%。利用MEGA-X软件的NJ方法构建了系统进化树(图2)。在进化树中,PdLYZ首先和珊瑚、海绵的溶菌酶聚成一支,而细菌、藻和贝类的溶菌酶则聚成另一个独立的分 支。
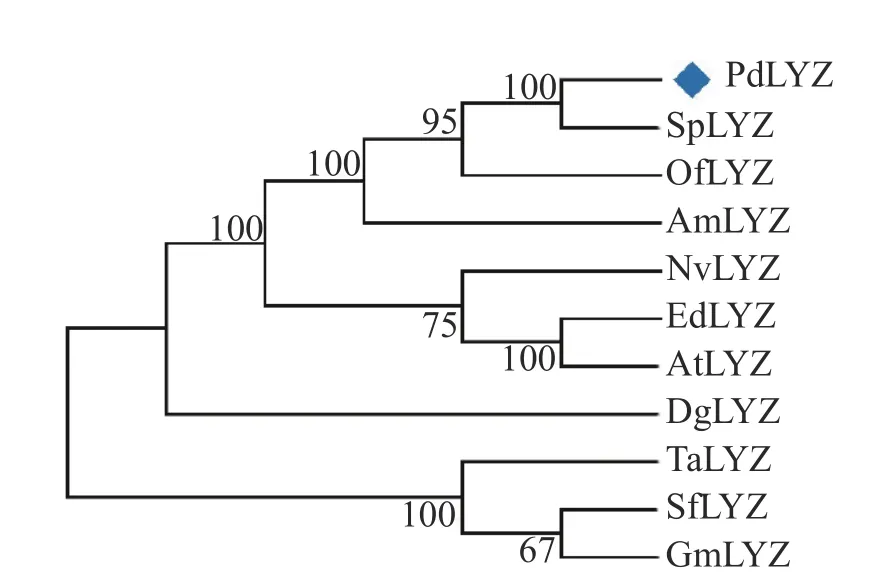
图2 不同生物溶菌酶的系统进化树Fig. 2 Phylogenetic tree of lysozymes from different organismsSp:柱状珊瑚Stylophora pistillata; Of:星珊瑚Orbicella faveolate; Am:鹿 角 珊 瑚Acropora millepora; Nv:海葵Nematostella vectensis; Ed:海葵Exaiptasia diaphana; At:海葵Actinia tenebrosa; Dg:软珊瑚 Dendronephthya gigantea;Ta:锦蟾Thalassophryne amazonica; Sf:硬骨舌鱼Scler opages formosus; Gm:鳕鱼Gadus morhua.
2.3 PdLYZ重组蛋白的表达与纯化为了进一步揭示PdLYZ在鹿角杯形珊瑚中的生物学功能,利用IPTG诱导已转化重组质粒pEASY-E1-PdLYZ的E.coliBL21(DE3)感受态细胞表达PdLYZ重组蛋白。采用镍柱纯化体外表达的PdLYZ重组蛋白,SDS-PAGE分析结果表明,PdLYZ分子量为22.05 kDa(图3),与ExPASy数据库预测的蛋白相对分子量一致。测定纯化透析后的PdLYZ重组蛋白 浓度为0.1 g·L-1。
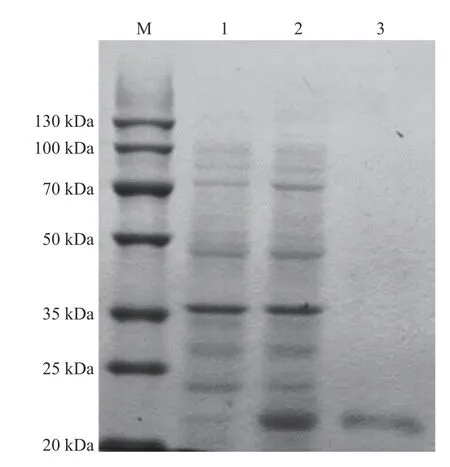
图3 PdLYZ重组蛋白的表达与纯化M:蛋白marker;1:未诱导组蛋白的表达;2:诱导组蛋白的表达;3:镍柱纯化后的PdLYZ蛋白。Fig. 3 SDS-PAGE analysis of recombinant PdLYZ protein.Lane M: protein molecular weight marker. Lane 1: protein expression of control group, not induced; Lane 2: protein expression of induced group; Lane 3: PdLYZ protein purified by Ni2+ chelating Sepharose colum.
2.4 PdLYZ重组蛋白对大肠杆菌和变异链球菌的抑制活性 在37 ℃下,PdLYZ重组蛋白能抑制大肠杆菌(革兰氏阴性菌)和变异链球菌(革兰氏阳性菌)的生长。PdLYZ重组蛋白在3、4 h能显著抑制大肠杆菌的生长,抑制率分别为49.48%和22.46%(图4)。PdLYZ重组蛋白在3、4 h能显著抑制变异链球菌的生长,抑制率分别为53.64%和26.45%(图5)。

图4 PdLYZ重组蛋白对大肠杆菌的抑菌活性,rLYZ:PdLYZ重组蛋白;BSA:牛血清蛋白(CK)。数据以平均值±标准差表示(n=3),*代表显著性差异(P<0.05)。Fig. 4 Inhibitory activity of recombinant PdLYZ protein against Escherichia coli.rLYZ: recombinant PdLYZ protein; BSA:bovine serum albumin (CK). Values are presented as the mean ± SD (n=3), and* represents significant difference (P < 0.05).

图5 PdLYZ重组蛋白对变异链球菌的抑菌活性,rLYZ:PdLYZ重组蛋白;BSA:牛血清蛋白(CK)。数据以平均值±标准差表示(n=3),*代表显著性差异(P<0.05)。Fig. 5 Inhibitory activity of recombinant PdLYZ protein against Streptococcus mutansi.rLYZ: recombinant PdLYZ protein; BSA: bovine serum albumin (CK). Values are presented as the mean ± SD (n=3), and* represents significant difference (P<0.05).
2.5 不同温度下PdLYZ重组蛋白对溶珊瑚弧菌的抑制活性在26 ℃和32 ℃下测定了PdLYZ重组蛋白对溶珊瑚弧菌生长的抑制活性。PdLYZ重组蛋白在2种温度下均能显著抑制溶珊瑚弧菌生长。26 ℃时PdLYZ重组蛋白在7 h对溶珊瑚弧菌生长的抑制率高达70.50%(P<0.05),32 ℃时PdLYZ重组蛋白在 6 h对溶珊瑚弧菌生长的抑制率达47.93%(图6)。
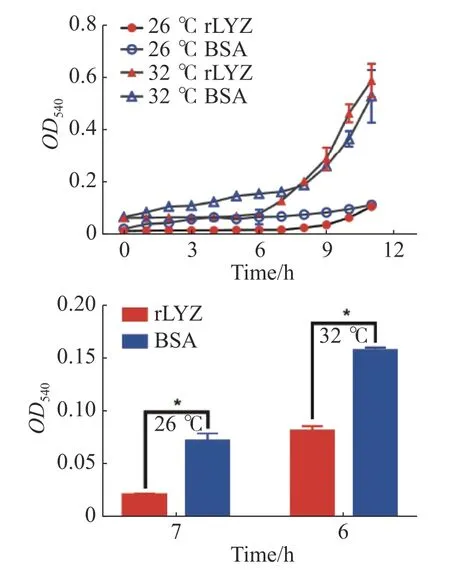
图6 在26 ℃和32 ℃下,PdLYZ重组蛋白对溶珊瑚弧菌的抑菌活性rLYZ:PdLYZ重组蛋白;BSA:牛血清蛋白(CK)。数据以平均值±标准差表示(n=3),*代表显著性差异(P<0.05)。Fig. 6 Inhibitory activity of recombinant PdLYZ protein against Vibrio coralliilyticus at 26 ℃ and 32 ℃.rLYZ: recombinant PdLYZ protein; BSA:bovine serum albumin (CK). Values are presented as the mean ± SD (n=3),and * represents significant difference (P<0.05).
3 讨 论
病原菌导致的珊瑚疾病对珊瑚礁生态系统造成的影响不容小觑,尤其是在全球气候不断变暖的背景下。溶菌酶是广泛存在于各种生物的一类抗菌分子,在无脊椎动物固有免疫应答中发挥着重要作用。本实验探究了鹿角杯形珊瑚溶菌酶的分子特征及其生物学功能,揭示了溶菌酶可能参与珊瑚免疫应答。鹿角杯形珊瑚溶菌酶PdLYZ基因的cDNA开放阅读框长648 bp,编码215个氨基酸,其序列与其他生物的溶菌酶相似性为25.54%~49.15%。鹿角杯形珊瑚溶菌酶PdLYZ推导蛋白的N末端有1条由23个氨基酸残基组成的信号肽,表明PdLYZ蛋白分泌到细胞外行使功能。此外,鹿角杯形珊瑚溶菌酶PdLYZ含有1个类溶菌酶超家族的结构域,该结构域对于溶菌酶的抑菌功能可能至关重要。MEGA软件构建鹿角杯形珊瑚溶菌酶PdLYZ和其他生物溶菌酶的系统进化树的分析结果表明,鹿角杯形珊瑚溶菌酶PdLYZ和珊瑚、海绵的溶菌酶聚成1支,而细菌、藻和贝类的溶菌酶则聚成另外1个独立的分支;系统进化树的分析结果表明,鹿角杯形珊瑚溶菌酶PdLYZ是溶菌酶在鹿角杯形珊瑚中的同源酶,而且它可能拥有与其他动物中的同源酶相似的生物学活性。
造礁石珊瑚健康菌群的维持与珊瑚礁生态系统的健康密切相关。为探究溶菌酶在珊瑚免疫应答中的可能作用,本研究测定了鹿角杯形珊瑚溶菌酶PdLYZ重组蛋白对革兰氏阳性菌变异链球菌、革兰氏阴性菌大肠杆菌和病原菌溶珊瑚弧菌的抑制活性。结果表明,鹿角杯形珊瑚溶菌酶PdLYZ重组蛋白对变异链球菌和大肠杆菌的生长均有显著的抑制作用。PdLYZ重组蛋白可能通过破坏变异链球菌的细胞壁结构,即催化水解细胞壁中N-乙酰氨基葡萄糖和N-乙酰胞壁酸之间形成的β-1,4糖苷键[22],来抑制变异链球菌的生长。对于大肠杆菌和溶珊瑚弧菌而言,PdLYZ重组蛋白可能通过与脂多糖(LPS)的结合活性发挥抑菌作用[23]。相似的报道已证明海参、蟹、虾和贝等无脊椎动物中的溶菌酶也对革兰氏阳性菌和阴性菌均具有抑制作用[9,24-26]。海洋无脊椎动物的溶菌酶可能比陆地无脊椎动物的活性范围更广,便于应对复杂海洋环境中多样性更高的病原菌[27]。PdLYZ重组蛋白广泛的抑菌活性表明溶菌酶可能参与珊瑚机体的防御免疫。
溶珊瑚弧菌是一种广为报道的珊瑚病原菌,海水升温会加剧溶珊瑚弧菌对珊瑚的致病力[28]。为探究溶菌酶在珊瑚应对未来全球气候变暖中的可能作用,本研究测定了与PdLYZ重组蛋白(实验组)或BSA蛋白(对照组)共孵育后,溶珊瑚弧菌在26 ℃和32 ℃下的生长曲线。结果表明,高温会加速溶珊瑚弧菌的生长,病原菌的快速生长可能触发珊瑚固有免疫应答,溶菌酶作为固有免疫的关键组成部分,通常被认为是抵抗病原菌感染的第一道防线。本研究结果表明,PdLYZ重组蛋白在常温及高温条件下能显著抑制溶珊瑚弧菌的生长,且其抑菌能力在高温条件下更强。这与在其他生物中的研究一致,STABILI[17]研究结果表明,海葵A. equina粘液中类溶菌酶的抑菌活性在高温条件下较强,黄金凤等[29]研究结果表明,松浦镜鲤幼鱼溶菌酶活性随温度升高而显著增加。此外,PdLYZ重组蛋白在高温条件下会在前期显著抑制病原菌生长。这些结果表明,PdLYZ蛋白对于鹿角杯形珊瑚在未来气候变暖中可能会降低病原菌的数量和比例,对抑制珊瑚疾病的爆发具有重要意义。综上所述,本研究克隆得到一个鹿角杯形珊瑚的溶菌酶基因,其蛋白含有类溶菌酶超家族结构域,其重组蛋白对于大肠杆菌、变异链球菌和溶珊瑚弧菌均具有抑制作用,且在高温条件下会在前期显著抑制溶珊瑚弧菌的生长。由此笔者推测溶菌酶在珊瑚免疫应答中可能扮演着重要作用。
