浒苔低聚糖的制备及抗氧化活性研究
2021-07-15胡馨月张维赵行李若敏周振胡圣男盘赛昆
胡馨月,张维,赵行,李若敏,周振,胡圣男,盘赛昆,2,3,4*
(1.江苏海洋大学食品科学与工程学院,江苏 连云港 222005;2.江苏海洋大学江苏省海洋生物技术重点建设实验室,江苏 连云港 222005;3.江苏海洋大学江苏省海洋生物资源与环境重点实验室,江苏 连云港 222005;4.江苏海洋大学江苏省海洋资源开发研究院,江苏 连云港 222005)
浒苔(Enteromorpha spp.),俗称苔条,属于绿藻门、绿藻纲、石莼目、石莼科浒苔属藻类植物,主要成分是多糖类和粗纤维,营养价值丰富,具有独特的风味,深受消费者的喜爱[1-2],目前已广泛应用于食品、农业、医药等行业[3-4]。多糖(polysaccharides)是由单糖通过糖苷键以线性或分支的方式连接而成,是构成生命活动的重要大分子化合物[5],具有多种生理活性[6],如抗肿瘤、抗病毒、抗氧化和增强免疫力等[7-8]。
低聚糖(oligosaccharides)是由少数分子的单糖(2个~10 个)缩合而形成的,又称寡糖[9],具有降血糖、调节肠道菌群、增强免疫力、抗氧化等生物活性。 其结构简单、分子量较小,具有低热量、稳定性好、无毒等良好的特性,在对人体的免疫性及预防疾病等方面发挥重要作用[10]。 低聚糖还具有很好的抗氧化性[11],在保护水果风味、色泽及维生素方面十分有利。 低聚糖普遍存在于自然界,主要来源于植物,通常以天然植物多糖进行降解得到。 低聚糖制备方法有酶解、酸解、物理降解、酶缩合等[12-14]。 酸解法是最简单有效的一种降解方法,糖苷键容易在酸性条件下断裂,从而将多糖大分子裂解为不同聚合度的分子片段。 控制酸的浓度、反应时间和温度,可调整多糖降解的程度,从而得到目标分子量的寡糖混合物[15]。
目前,国内外对浒苔低聚糖的研究较少,本文研究一种适合浒苔多糖水解成具有抗氧化性的低聚糖的制备工艺,以羟自由基清除率为指标,通过单因素试验确定多糖酸水解适宜条件,采用响应面试验优化水解工艺,为浒苔低聚糖的开发和利用提供理论基础。
1 材料与方法
1.1 材料与试剂
浒苔(Enteromorpha prolifera):市售。
纤维素酶(8×104U/g):张家港金源生物化工有限公司;酒石酸钾钠、苯酚、3,5 二硝基水杨酸、正丁醇、铁氰化钾:分析纯,南京化学试剂有限公司。
1.2 仪器与设备
AF-O6A 新型密封式粉碎机: 奥力中药机械有限公司;ZNC-701 超微粉碎机: 北京兴时利和发展有限公司;752N 紫外可见分光光度计: 上海奥普勒仪器有限公司;SevenEasy pH 计: 梅特勒-托利多仪器有限公司;ENCL-G-3 恒温磁力搅拌器:上海易研实验设备有限公司。
1.3 试验方法
1.3.1 原材料处理
浒苔→自来水洗净→电热鼓风干燥箱烘干4 h→密封式粉碎机粉碎→过80 目筛→超微粉碎机粉碎→浒苔粉
1.3.2 纤维素酶辅助提取多糖
浒苔粉→加水[料液比1∶15(g/mL)]→调pH 值至4.5→加入纤维素酶搅匀→45 ℃保温6 h→加水调pH值至9→80 ℃保温5 h→离心(4 000 r/min,15 min)→取上清液→Sevag 法脱蛋白[16]→离心→取上清液→浓缩→加无水乙醇→冷藏过夜→离心取沉淀→真空干燥→浒苔多糖聚糖水解液
1.3.3 单因素试验
参考文献[17],以葡萄糖当量(dextrose equivalent,DE)值和羟自由基清除率为指标,考察料液比、温度、时间、盐酸浓度对浒苔多糖酸水解的影响。 试验设计为:料液比1∶20、1∶30、1∶40、1∶50、1∶60(g/mL),温度60、65、70、75、80 ℃,时间1、2、3、4、5 h,盐酸浓度0、0.5、1、1.5、2 mol/L,每组重复3 次。
1.3.4 响应面试验设计
根据单因素试验结果,采用Design-Expert8.0.6 软件系统的Box-Behnken 中心试验组合设计模块,以料液比、温度、盐酸浓度3 个因素为自变量,羟自由基清除率为因变量,采用三因素三水平优化浒苔抗氧化的条件,因素与水平设计见表1。

表1 响应面试验因素与水平Table 1 Factors and levels of response surface experiment
1.3.5 指标测定
1.3.5.1 多糖含量的测定
采用蒽酮-硫酸法[18]测定多糖含量,吸取1 mL浒苔上清液于50 mL 容量瓶稀释,吸取稀释液2 mL,测定吸光度,根据样品溶液的吸光度查标准曲线,测得含糖量,按式(1)计算。

式中:c 为从标准曲线上查得的糖浓度,mg/mL;V样液总为上清液总体积,mL;V1为测定时取用体积,mL;m 为样品质量,mg。
1.3.5.2 蛋白质含量的测定
采用Bradford 法[16]测定多糖粗提液中蛋白质,取3支10 mL 具塞试管,各吸取浒苔上清液0.1 mL 和蒸馏水0.9 mL,加入5 mL 考马斯亮蓝G-250 蛋白试剂,充分混匀, 放置2 min 后用1 cm 比色皿在595 nm 下比色,记录吸光值A595nm,以蒸馏水试管作空白,通过标准曲线查得待测样品上清液中蛋白质含量(μg)。
1.3.5.3 还原糖含量的测定
还原糖(以葡萄糖计)测定:参考文献[19]的3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)法进行。DE值[20]:又叫葡萄糖当量值,是还原糖(以葡萄糖计)占溶液中干物质的百分比。 绘制标准曲线,并计算样品中还原糖含量,按式(2)计算。

式中:c 为查标准曲线得到水解液中还原糖浓度,mg/mL;d 为稀释倍数;m 为样品质量,mg;v 为溶解样品的蒸馏水体积,mL。
1.3.5.4 抗氧化活性检测
采用水杨酸法,参照文献[21]的方法,测定羟自由基的清除能力(scavenging activity,SA),用%表示,按式(3)计算。

式中:A0为空白对照液的吸光值;Am为加入多糖后的吸光值;An为不加H2O2时多糖的吸光值。
1.4 数据分析
采用Origin 2018 软件作图;响应曲面分析结果用Design-Expert 8.0 软件进行优化及分析;采用SPSS 软件进行统计分析。
2 结果与分析
2.1 葡萄糖标准曲线
以葡萄糖为标准品,蒽酮-硫酸法测得的标准曲线如图1,回归方程为:y=10.321x+0.007 9,R2=0.999 2。

图1 葡萄糖标准曲线Fig.1 Standard curve of glucose
2.2 蛋白质标准曲线
以牛血清蛋白(bovine albumin,BSA)为标准,所得蛋白质标准曲线如图2, 回归方程为y=0.008 2x+0.015 4,R2=0.998 9。
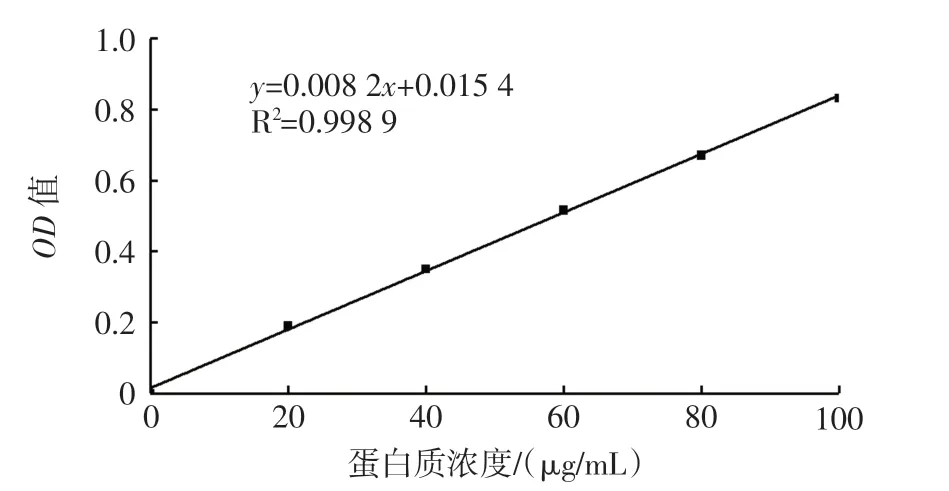
图2 蛋白质标准曲线Fig.2 Protein standard curve
2.3 还原糖标准曲线
采用DNS 法测定还原糖量,所得还原糖标准曲线如图3,回归方程为y=0.582 7x-0.014 7,R2=0.999 1。 根据标准曲线得出样品还原糖浓度,根据公式计算DE 值。

图3 还原糖标准曲线Fig.3 Sugar standard curve
2.4 酸水解单因素试验
2.4.1 料液比对多糖酸水解的影响
料液比对多糖酸水解的影响见图4。
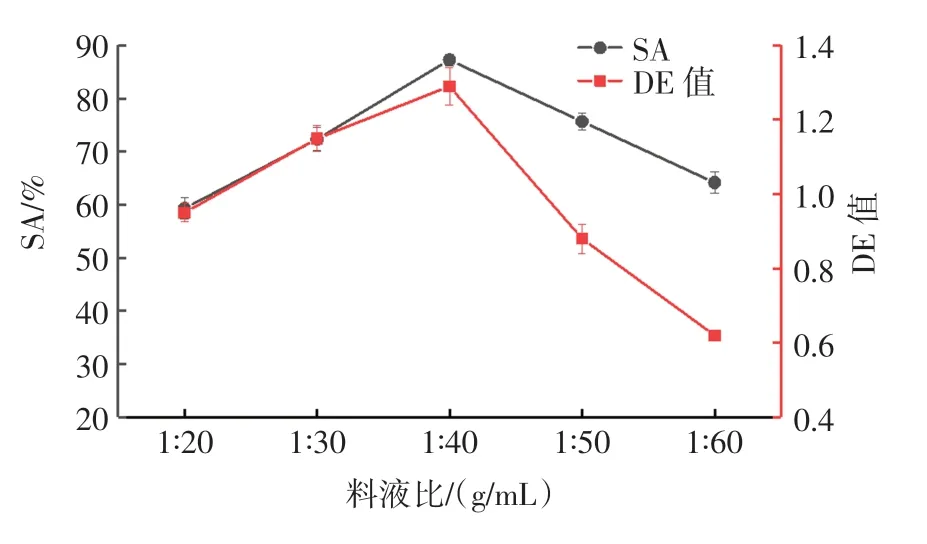
图4 料液比对多糖酸水解的影响Fig.4 Effect of solid-liquid ratio of acid hydrolysis of polysaccharides
如图4 所示, 随着溶剂体积的增加,DE 值和SA值呈现上升的趋势;料液比为1∶40(g/mL)时,DE 值和SA 值达到最大,之后呈下降趋势[10]。 故选择料液比为1∶40(g/mL)进行下一步的响应面试验。
2.4.2 温度对多糖酸水解的影响
温度对多糖酸水解的影响见图5。

图5 温度对多糖酸水解的影响Fig.5 Effect of temperature on acid hydrolysis of polysaccharides
如图5 所示, 随着水解温度的升高,DE 值和SA值呈现上升的趋势, 在水解温度为70 ℃时,DE 值和SA 值达到最高; 随着水解温度不断升高,DE 值和SA值呈现下降的趋势。 这是由于温度过高引起多糖的降解,温度是反应的重要参数,较高的反应温度利于反应的进行, 但是生成低聚糖是多糖水解的中间阶段,水解反应的最终结果是生成单糖。 制备低聚糖一般需要降低温度,使水解反应温和进行,尽量减少单糖的产生[9]。 故选择水解温度为70 ℃进行下一步的响应面试验。
2.4.3 时间对多糖酸水解的影响
时间对多糖酸水解的影响见图6。

图6 时间对多糖酸水解的影响Fig.6 Effect of the extract time on the acid hydrolysis of polysaccharides
如图6 所示,随着水解时间的延长,DE 值和SA 值呈现上升的趋势;在水解时间为2 h 时,达到最高。 时间少于2 h 时,反应不充分,DE 值和SA 值较低;但随着水解时间不断增加, 低聚糖在酸催化下继续酸解为单糖,导致DE 值呈现下降的趋势[5,10]。 方差分析表明,时间的变化对SA 值无显著性影响。
2.4.4 盐酸浓度对多糖酸水解的影响
盐酸浓度对多糖酸水解的影响见图7。
盐酸常用于酸解制备低聚糖,易去除、易挥发、价格低廉[22]。如图7 所示,随着盐酸浓度的升高,DE 值和SA 值呈现上升的趋势; 在盐酸浓度为1 mol/L 时,DE值和SA 值达到最高。 随着盐酸浓度不断升高,DE 值呈现平缓的趋势。 考虑到成本和环境污染的问题,故选择盐酸浓度为1 mol/L 进行响应面试验。

图7 盐酸浓度对多糖酸水解的影响Fig.7 Effect of concentration of hydrochloric acid to acid hydrolysis of polysaccharides
2.5 响应面试验设计
2.5.1 模型方程建立与分析
通过对单因素试验结果的方差分析,筛选出对指标有显著影响的因素, 并确定其条件范围。 运用Design-Expert8.0.6 软件系统的Box-Behnken 模块进行中心试验组合设计,试验方案设计及结果见表2。

表2 响应面优化试验设计与结果Table 2 Response surface and results
将表2 中浒苔羟自由基清除率对自变量料液比、温度、盐酸浓度进行回归拟合后,得到的回归方程:羟自由基清除率(SA)/%=78.45-1.61A-0.59B+9.29C-28.45A2-8.54B2-11.25C2+2.54AB+1.70AC+3.46BC。 对模型进行方差分析,如表3 所示。

表3 模型回归系数显著性检验结果和方差结果分析Table 3 Regression coefficient significance test results and the results of analysis of variance
模型P<0.01,具有极显著性,失拟项P=0.61,大于0.05,失拟项不显著,表明未知因素对响应值的影响较小,R2=0.897,表明该模型具有良好的拟合度。 对回归模型进行分析,在该模型下自变量C 对羟自由基清除率影响显著。 从F 值可以得出:C>A>B,即盐酸浓度>料液比>温度。
2.5.2 响应面分析
根据响应面选择的回归模型绘制响应面图,见图8。
如图8 所示, 等高线的形状表示两因素之间的影响强弱,椭圆表示两因素交互作用较强,圆则代表较弱[22]。 综合看出,随着溶剂量的增多,多糖酸水解后的羟自由基清除率不断升高,但是羟自由基清除率达到最大后继续增加溶剂的量, 羟自由基清除率会下降;随着温度的升高,多糖酸水解后的羟自由基清除率不断升高,但是随着浓度的不断升高,羟自由基清除率会下降;随着盐酸浓度的不断升高,多糖酸水解后的羟自由基清除率不断升高, 但是随着盐酸浓度的不断升高,羟自由基清除率会下降。 对回归模型进行数学分析,得到多糖酸水解最佳条件为料液比1∶39.7(g/mL)、温度为69.7 ℃、盐酸浓度为1.41 mol/L,在此条件下羟自由基清除率为80.40%。

图8 各因素交互作用的响应面图Fig.8 Response surface diagram of interaction of various factors
2.5.3 工艺验证
结合实际生产需要, 将工艺调整为料液比1∶40(g/mL)、温度70 ℃、盐酸浓度1.4 mol/L、时间2 h,在此条件下测出羟自由基清除率分别为78.81%、80.22%、80.27%,平均值为(79.76±0.82)%,与预测值相差很小。
3 结论
本文以浒苔为研究对象,采取纤维素酶辅助提取浒苔粗多糖,通过酸水解提取低聚糖,结果表明浒苔低聚糖具有良好的抗氧化能力。 通过回归模型的分析,以羟自由基清除率为评价指标,经优化工艺为料液比1∶40(g/mL)、温度为70 ℃、盐酸浓度为1.4 mol/L,羟自由基清除率模型预测为80.4%,实测值为(79.76±0.82)%,说明响应面优化所得到的工艺可靠,具有实用价值,为浒苔资源的综合利用提供参考。
