经颅直流电刺激对脑卒中后中枢性疼痛患者的镇痛效果研究
2021-07-13谭娟李晓敏苟晨杜颖王晓明
谭娟,李晓敏,苟晨,杜颖,王晓明
(1.川北医学院附属医院·川北医学院神经疾病研究所;2.川北医学院,四川 南充 637000)
脑卒中后中枢性疼痛(central post-stroke pain,CPSP)是由大脑损伤引起的一种中枢性神经疼痛障碍,发病率10%~35%[1-2],患者表现为患侧持续或间歇性灼痛、针刺痛、割伤痛、撕裂痛,由此导致的活动功能限制,严重影响患者的生活质量[3-4]。药物治疗可改善患者疼痛症状,但不能作用于受损神经,且可能还会引起嗜睡和头晕等副作用[5],而脑刺激可直接作用于患者受损大脑区域。经颅直流电刺激(transcranial direct current stimulation,tDCS)通过向头皮释放微弱电流,选择性地改变局部脑区神经元活性,被认为是一种有效、安全、无创的脑刺激方法[6],但目前将tDCS用于CPSP患者镇痛治疗的研究较少。本研究旨在探讨tDCS对CPSP患者的镇痛效果,为临床治疗提供参考。
1 资料与方法
1.1 一般资料
选取2019年12月至2021年5月川北医学院附属医院收治的40例CPSP患者为研究对象,依据tDCS每次刺激时间不同分为试验组(n=19)和对照组(n=21)。本研究经院伦理委员会批准,患者知情同意,且两组患者一般资料比较,差异无统计学意义(P>0.05)。见表1。

表1 患者一般资料比较
纳入标准:(1)经颅脑CT或MRI确诊为脑卒中;(2)年龄18~85岁;(3)CPSP诊断符合最新的诊断定义[7],且视觉模拟评分量表(visual analogue scale,VAS)[8]评分≥3分。排除标准:(1)短暂性脑缺血发作;(2)其他疾病导致的中枢性疼痛,如反射性交感神经营养不良综合征、神经根性颈椎病、癌性疼痛等;(3)有精神疾病的患者,如抑郁症、精神分裂症;(4)有严重躯体疾病的患者,如癫痫、恶性肿瘤、脏器功能衰竭等;(5)体内植入金属异物患者,如心脏起搏器、血管支架等。
1.2 方法
采用四川省智能电子实业有限公司生产的IS300型tDCS仪,阳极电极片刺激患者初级运动皮层(M1区),体表投影为左右半球中央区,刺激区域以脑卒中损伤侧为主,如右侧脑卒中则刺激右半球中央区,左侧脑卒中则刺激左半球中央区;阴极电极片置于患者对侧眶上区;刺激电流2 mA;试验组和对照组每次刺激时间分别为20 min/次和30 s/次,5次/周,疗程2周。操作由一名经神经电生理培训合格后的神经内科医师完成。
1.3 观察指标
(1)自我疼痛感觉强度:采用视觉模拟评分量表(visual analogue scale,VAS)评分[9]评估;标尺长度10 cm,刻度0~10代表0~10分;0分表示无痛,10分表示难以忍受的疼痛。(2)皮肤温差:采用德国德图公司生产的905-T2表面温度计测量患者主诉疼痛区和对侧区域的温度,二者之差即为皮肤温差。(3)(δ+θ)/(α+β)值:采用美国Nicolet生产的NicoletOne Version 5.4视频定量脑电图(quantitative electroencephalogram,QEEG)采集监测系统记录患者左右半球额区(θ+δ)/(α+β)值。
1.4 统计学分析
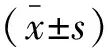
2 结果
2.1 两组患者自我疼痛感觉强度比较
干预前,两组患者VAS评分比较,差异无统计学意义(P>0.05);干预后及干预后4周,试验组患者VAS评分降低(P<0.05),且低于对照组(P<0.05);而对照组变化不明显(P>0.05)。见表2。

表2 两组患者自我疼痛感觉强度比较分)
2.2 两组患者皮肤温差比较
两组患者干预后及干预后4周皮肤温差与干预前比较,差异无统计学意义(P>0.05);干预后及干预后4周试验组皮肤温差低于对照组(P<0.05)。见表3。

表3 两组患者皮肤温差比较
2.3 两组患者(θ+δ)/(α+β)值比较
干预前、干预后及干预后4周,两组患者(θ+δ)/(α+β)值比较,差异无统计学意义(P>0.05)。干预后及干预后4周试验组(θ+δ)/(α+β)值低于干预前(P<0.05),且低于对照组(P<0.05);对照组干预后4周(θ+δ)/(α+β)值低于干预前(P<0.05)。见表4。
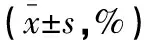
表4 两组患者(θ+δ)/(α+β)值比较
3 讨论
近年来,tDCS作为一种无创脑刺激技术快速发展,有望成为治疗CPSP的有效方法。tDCS阴极刺激初级运动感觉区和运动前区时可改善脑卒中患者手的运动功能,促进其运动记忆[10]。也有研究[9]表明,tDCS能改善患者疼痛感知和慢性疼痛综合征引起的疼痛相关症状。
CPSP的疼痛评估对评价疾病治疗效果十分重要,而疼痛是一种主观感觉,难以客观化,通常以VAS评分进行评估[11]。本研究结果发现,试验组在干预后及干预后4周VAS评分低于干预前(P<0.05),且低于对照组(P<0.05),与Morishita等[12-13]的研究结论一致,表明tDCS能有效缓解CPSP患者疼痛程度,且既有短期疗效(干预后),也具有长期疗效(干预后4周),可能是由于阳极tDCS能诱发大脑皮层局部兴奋性变化,进而导致丘脑核抑制上行性疼痛信号传递。同时,tDCS调节丘脑的异常活动进一步抑制了疼痛信号传递并增加了感觉阈值,从而达到镇痛效果[14]。
中枢性疼痛患者由于自主神经系统功能紊乱可能导致皮肤温度变化。因此,本研究通过测量患者疼痛区及对侧区皮肤温差来辅助评估CPSP患者疼痛生理变化[15],结果显示,两组患者皮肤温差随时间推移而下降,试验组在干预后、干预后4周皮肤温差低于对照组(P<0.05),表明tDCS刺激能降低患者疼痛区皮肤温度,可能与交感神经活动增加、血流量减少及交感神经纤维和疼痛传递神经纤维之间的连接通路传递速度减慢或中断有关[16-17];而皮肤温度降低,患者对疼痛的感受性也会随之降低,有助于镇痛。
QEEG(θ+δ)/(α+β)值能客观反映CPSP患者大脑皮质电活动的变化。本研究发现,试验组在干预后及干预后4周左右额区(θ+δ)/(α+β)值低于干预前(P<0.05),且低于对照组(P<0.05);对照组干预后4周低于干预前(P<0.05),但两组(θ+δ)/(α+β)值在各时间点上比较,差异无统计学意义(P>0.05),与Varoli等[18-19]的研究结果相似,表明大脑皮质电活动会随着神经元自发性恢复逐渐趋于正常化。tDCS能促进神经元突触重塑,且可持续数月,但患者在前6个月处于疾病的自发恢复期,此时tDCS和神经功能自发性恢复相互作用可共同减轻患者疼痛感[20]。此外,本研究还发现,每次刺激持续时间越长,对疼痛、皮肤温差及(θ+δ)/(α+β)值的影响越明显,表明tDCS的镇痛效果可能呈时间依赖性。
综上所述,tDCS能有效发挥对CPSP患者的镇痛作用,降低其患侧皮肤温度,增强患者大脑皮层电活动,且每次刺激持续时间越长效果越明显。
