外源性胆汁酸对畜禽抗热应激作用研究进展
2021-07-12吴维达曹爱智张宏福
尹 畅 吴维达 曹爱智 张宏福*
(1.中国农业科学院北京畜牧兽医研究所,动物营养学国家重点实验室,北京100193; 2.山东龙昌动物保健品有限公司,济南251100)
热应激严重影响畜牧业发展,给全球养殖业每年造成高达数十亿美元的损失[1]。我国大部分地区夏季高温时间较长,极易引发热应激,影响畜禽正常生长发育[2]。热应激对畜禽最直接的影响是降低其采食量,导致生长缓慢及机体免疫力降低,进而诱发葡萄糖和脂质代谢紊乱、肠道菌群失调以及传染性疾病等。如何缓解畜禽热应激一直是困扰养殖行业的一个难题,国内外诸多学者开展研究开发出抗热应激技术或产品,如提高饲粮能量水平以及应用电解质、矿物质、维生素及中草药制剂等添加剂[3-5]。而胆汁酸作为新型饲料添加剂,具有绿色、安全、高效、作用持续稳定等特点,近年来引起越来越多关注。胆汁酸在传统上作为乳化剂促进饲粮中脂肪利用率和脂溶性物质吸收,提高饲料效率,改善生产性能[6]。而一些亲水性胆汁酸,如胆酸(cholic acid,CA)、鹅脱氧胆酸(chenodeoxycholic acid,CDCA)、熊脱氧胆酸(ursodeoxycholic acid,UDCA)还具有调节糖代谢和脂代谢、保护肠道屏障和微生态平衡以及抗氧化损伤等作用,在一定程度上缓解热应激造成的负面影响[7-10]。本实验室前期研究发现,热应激抑制牛磺结合型胆汁酸(taurine-conjugated bile acid,TCBA)的合成、结合和摄取,影响肠肝循环,可能对生长猪的抗应激能力造成影响[11]。因此,饲粮中适当添加胆汁酸可能有利于维持畜禽代谢稳态,提高抗应激能力。本文系统地对胆汁酸代谢、胆汁酸对机体的调控机制以及添加外源胆汁酸对生长阶段热应激猪和肉鸡的重要意义进行阐述,以期为下一步研究提供理论依据。
1 胆汁酸代谢与肠肝循环
1.1 胆汁酸合成和分类
胆固醇是动物细胞膜的重要组成之一,也是合成胆汁酸的前体[12]。血液中胆固醇大部分来自肝脏的合成,小部分通过采食摄入。约2/5自身合成的胆固醇在肝脏实质细胞中通过经典途径和替代途径转化为初级胆汁酸。经典途径合成的胆汁酸约占82%,由胆固醇7α-羟化酶(CYP7A1)启动,而后通过甾醇12α-羟化酶(CYP8B1)生成CA。通过甾醇27α-羟化酶(CYP27A1)和氧固醇7α-羟化酶(CYP7B1)合成的CDCA约占18%。合成后胆汁酸被胆汁酸辅酶A合成酶(BACS)和氨基酸N-乙酰转移酶(BAT)激活并与牛磺酸(taurine)或甘氨酸(glycine)结合生成牛磺胆酸(taurocholic acid,TCA)或甘氨胆酸(glycocholic acid,GCA)并分泌到胆汁中,随胆汁流向胆道储存于胆囊。进食后由肠道分泌的胆囊收缩素(cholecystokinin,CCK)刺激胆囊收缩,使胆汁酸排入肠道。在回肠末端,约95%的胆汁酸通过钠依赖性胆汁盐转运蛋白被刷状缘膜重吸收,进入门脉循环被肝脏回收,此过程称为胆汁酸的肠肝循环。胆汁酸的肠肝循环在营养吸收、毒性物质代谢、维持机体胆汁酸代谢稳态中起重要作用,由肝脏和肠道中核受体调节的复杂膜转运系统调控。此外,除少量胆汁酸以类固醇的形式排出体外,还有一小部分胆汁酸被肠道微生物修饰后形成次级胆汁酸,随后在结肠中以被动运输的形式被吸收[13]。
胆汁酸种类较多,按照来源分类包括初级胆汁酸和次级胆汁酸。初级胆汁酸包括在肝脏中由胆固醇合成的CA、CDCA、UDCA以及它们与甘氨酸和牛磺酸结合的胆酸盐。初级胆汁酸分泌进入肠腔,经拟杆菌属(Bacteroides)、梭菌属(Clostridium)、真杆菌属(Eubacterium)、乳杆菌属(Lactobacillus)和埃希菌属(Escherichia)等菌表达的羟基类固醇脱氢酶(hydroxysteroid dehydrogenase,HSDH)将初级胆汁酸转化为次级胆汁酸,主要包括脱氧胆酸(deoxycholic acid,DCA)和石胆酸(lithocholic acid,LCA)。胆汁酸又可按照结构分为游离型和结合型,即胆汁酸分子是否与牛磺酸或甘氨酸结合,结合型胆汁酸更具亲水性以促进其分泌到胆汁中,且降低部分疏水性胆汁酸毒性。不同动物胆汁酸种类也有区别,在家禽中,胆汁酸主要包括CA、DCA、CDCA以及牛磺鹅脱氧胆酸(taurochenodeoxycholic acid,TCDCA);猪的胆汁酸主要包括猪脱氧胆酸(hyodeoxycholic acid,HDCA)、CDCA、猪胆酸(hyocholic acid,HCA)、TCA,其中HDCA约占40%,CDCA约占25%。
1.2 胆汁酸的主要代谢途径
胆汁酸的结构多样性是宿主和肠道菌群协同作用的结果,肠道微生物菌群通过修饰初级胆汁酸产生次级胆汁酸,从而充当“内分泌器官”。胆汁酸是肠-肝轴和微生物-宿主轴交互的信号分子,即机体可以通过肝脏将胆汁酸、免疫球蛋白A(IgA)以及多种抗菌分子排到肠道,从而保护肠道屏障和塑造肠道菌群,而肠道菌群通过次级胆汁酸、短链脂肪酸(short-chain fatty acids,SCFA)等代谢产物在肠-肝轴传递信号,影响宿主采食和能量代谢[14]。微生物代谢衍生的次级胆汁酸不仅影响肠道微生物群的组成和功能,还作为关键信号分子通过激活特异性受体和细胞信号通路调节宿主机体的某些生物效应。胆汁酸核法尼醇X受体(farnesoid X receptor,FXR)和胆汁酸G蛋白偶联受体5(G-protein-coupled bile acid receptor 5,TGR5)是参与缓解热应激主要的胆汁酸受体,通过胆汁酸的信号传导特性调节宿主多个代谢途径(图1)。
FXR在许多组织和器官中表达,在参与调节胆汁酸稳态的组织中表达量较高,如肠道、肝脏和肾脏[15-17];在胃、食道、胆管和胰腺上皮细胞中也有表达[18-22]。FXR可调节胆汁酸合成、胆汁的分泌、胆汁酸的重吸收,在胆汁酸的肠肝循环中起关键作用[23-24]。FXR还与糖代谢、脂代谢、免疫调节、肠道屏障完整性有关,在缓解热应激效应中发挥着重要作用[23,25]。胆汁酸作为配体在激活FXR中的结构活性关系,其效价等级为:CDCA>DCA>LCA>CA[26]。TGR5作为被胆汁酸激活的膜受体[27],与胆汁酸相互影响,参与控制能量、葡萄糖稳态、肠屏障完整性和免疫反应等[28],在胆囊、脾脏、肝脏[库普弗细胞(Kupffer cell)]、肠、肾脏、骨骼肌、胰腺、脂肪细胞和巨噬细胞中均有表达[29]。TGR5主要在肠神经元上调节肠运动[30],而在固有免疫细胞上似乎能有效抑制炎症反应[31-32]。此外,胆汁酸以TCA、LCA、DCA、CDCA、CA的活性顺序结合并活化TGR5[26]。总之,胆汁酸在塑造宿主先天免疫、缓解应激和调节代谢等方面起关键作用。目前,对于肠道微生物-胆汁酸-宿主轴的研究正在胃肠病学、内分泌学和传染病学等多个领域不断扩展。
2 胆汁酸在缓解畜禽热应激上的潜在作用
在热应激状态下,糖代谢、脂代谢、抗氧化系统和肠道健康均受到负面影响,进而导致畜禽情绪低落、食欲不振,机体免疫力也随之降低。采食量下降是热应激对畜禽最直观的影响,也是多数物种的适应性反应,以减少代谢产热,稳固产能和热量损失的平衡,从而导致生产性能大幅下降[33]。胆汁酸作为胆汁的重要组成成分,其独特之处在于可通过乳化脂质、影响细胞膜、变构调节和受体介导等途径发挥作用。但一些疏水性胆汁酸,如DCA和LCA在肝脏积聚反而会刺激肝细胞线粒体产生活性氧自由基(ROS)进而导致氧化应激,而肠道中大量疏水性胆汁酸积聚会损害断奶仔猪肠道屏障和上皮细胞增殖[34]。CDCA和UDCA是具有保护作用的亲水性胆汁酸,能针对毒性胆汁酸对机体起到保护作用,并刺激胆汁分泌,调节免疫以及对细胞凋亡的抑制。尽管CA、CDCA、UDCA等胆汁酸分子介导的信号调节通路涉及机体的糖代谢、脂代谢、肠道健康、抗氧化应激和免疫调节等多个有益方面已得到证实,但对于胆汁酸缓解畜禽热应激的应用研究较少。因此,合理利用胆汁酸对缓解畜禽热应激作用的研究对开发新型抗热应激添加剂有重要意义。
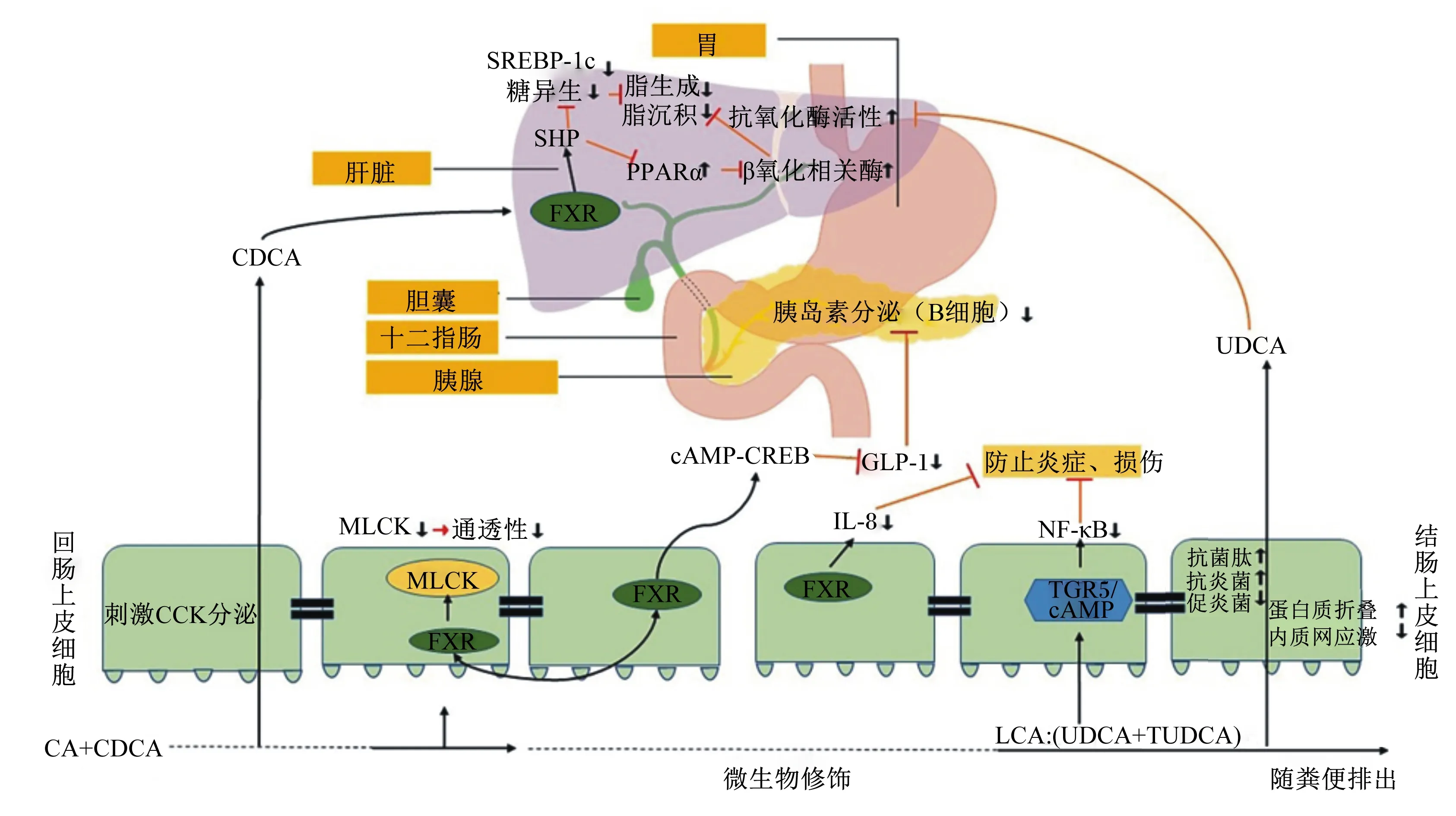
FXR:法尼醇受体 farnesoid X receptor;CCK:胆囊收缩素 cholecystokinin;MLCK:上皮肌球蛋白轻链激酶 myosin light chain kinase;SREBP-1c:胆固醇调节元件结合蛋白-1c sterol regulatory element binding protein-1c;PPARα:过氧化物酶体增殖剂激活受体α peroxisome proliferator activated receptor α;cAMP:环磷酸腺苷 cyclic adenosine monophosphate;CREB:环磷腺苷效应元件结合蛋白 cyclic adenosine monophosphate effector element binding protein;GLP-1:胰高血糖素样肽-1 glucagon like peptide-1;IL-8:白细胞介素-8 interleukin-8;TGR5:胆汁酸G蛋白偶联受体5 G-protein-coupled bile acid receptor 5;CA:胆酸 cholic acid;CDCA:鹅脱氧胆酸 chenodeoxycholic acid;SHP:小异源二聚体配体 small heterodimer partner;NF-κB:核因子-κB nuclear factor-κB;LCA:石胆酸 lithocholic acid;UDCA:熊脱氧胆酸 ursodeoxycholic acid;TUDCA:牛磺熊去氧胆酸 tauroursodeoxycholic acid。
2.1 胆汁酸改善热应激状态下畜禽生产性能的潜力
胆汁酸可通过非受体介导机制在肠腔中与极性磷脂分子结合,将膳食脂质掺入肠腔内的混合胶束溶液中,这种胶束化过程增加了腔内脂质的表面积,改善肠道脂肪酶的可及性和脂肪水解效率。Pearce等[35]研究表明,急性热应激影响家禽下丘脑和十二指肠中CCK的mRNA表达水平,不利于营养物质的吸收和刺激胰腺酶的分泌,进而影响其饲料转化率。且畜禽在幼龄阶段机体胆汁酸分泌不足,有限的内源乳化剂导致脂质消化和利用受到限制,饲粮中添加胆汁酸能提高消化能力、改善生长性能、减少腹泻和提高饲料转化率。有研究指出,在饲粮中添加外源乳化剂可提高断奶仔猪对于脂肪的消化吸收,从而促进仔猪生长发育[36]。同时,饲粮能量水平是影响饲料转化率、生长性能和胴体质量的关键因素,应激状态下可以通过添加油脂提高饲粮能量水平以满足畜禽能量需求[3]。据报道,肉鸡饲粮中添加0.5%的CA显著提高了饲料转化率,肉鸡对于油脂的表观吸收率由51%提升至84%,以促进其生长发育[37]。且饲粮中添加60~80 mg/kg复合胆汁酸能有效改善肉鸡生产性能,提升胸肌率[6,38]。这表明胆汁酸可促进肉鸡利用更多的能量用于生长,改善热应激引发的能量摄入不足。此外,CDCA通过诱导胰高血糖素样肽-2(glucagon like peptide-2,GLP-2)分泌可改善断奶前期仔猪的适应性,保护肠道完整性使其免受应激导致的腹泻,保障生长发育[39]。在采食调控方面,胆汁酸还可通过肠道基底外侧的TGR5刺激肠胃和胰腺分泌食欲和代谢调节激素[如胰高血糖素样肽-1(glucagon like peptide-1,GLP-1)、酪酪肽(peptide YY,PYY)等],但涉及的机制尚未全面了解[40]。因此,畜禽在热应激状态下,饲粮中添加胆汁酸可能在一定程度上改善生产性能、胴体质量和肉品质。
2.2 胆汁酸能够维持热应激状态下畜禽的糖和脂肪代谢稳态
热应激扰乱机体正常的糖和脂肪代谢,降低胰岛素敏感性,导致葡萄糖不合理利用、脂肪过度沉积等亟待解决的问题。研究发现,许多物种在慢性热应激状态下机体循环胰岛素水平升高,进而产生胰岛素抵抗,血清中基础游离脂肪酸含量趋于降低,脂肪组织中甘油生成和脂质储存量反而增加[33,41]。胆汁酸分子作为维持机体代谢稳态的参与者,其激活的受体FXR在脂肪过度沉积和胰岛素抵抗之间存在特定的分子联系。如CDCA和牛磺熊去氧胆酸(tauroursodeoxycholic acid,TUDCA)可通过激活FXR受体有效缓解高血脂小鼠肝脏甘油三酯(TG)积聚、极低密度脂蛋白(VLDL)分泌和血清TG含量升高,并改善热应激引起的胰岛素抵抗[42-44]。热应激状态下,胆汁酸通过激活FXR提高机体血糖和胰岛素耐受性,并诱导小异源二聚体配体(small heterodimer partner,SHP)抑制糖异生有关的磷酸烯酰丙酮酸激酶(PEPCK)、葡萄糖-6-磷酸酶(G-6-P)和果糖-1,6-二磷酸酶(FBP)基因表达以降低血糖,缓解胰岛素抵抗和葡萄糖利用率降低等负面影响[45]。而FXR-/-可导致肝X受体(liver X receptors,LXR)表达水平升高,并诱导脂肪生成靶基因[如硬脂酰辅酶A去饱和酶1(SCD1)和脂肪酸合成酶(FAS)]的表达,造成脂肪过度积累[46]。有研究指出,CA和CDCA可降低胆固醇调节元件结合蛋白(SREBPs)在小鼠肝脏中的表达[7]。饲粮中添加0.1%和0.5%的CDCA可明显抑制上述肝脂肪生成基因的表达,但过高剂量的CDCA有降低肉鸡采食量的可能性[47]。在肠道L细胞中,FXR通过与环磷酸腺苷(cAMP)-环磷腺苷效应元件结合蛋白(CREB)信号通路的关键转录调节因子CREB相互作用抑制了GLP-1的分泌,降低胰腺β细胞分泌胰岛素,缓解热应激导致的胰岛素抵抗,改善了糖代谢[48]。肝脏FXR也可诱导过氧化物酶体增殖物激活受体α(PPARα)的高表达,继而上调脂肪酸β氧化相关酶,如酰基辅酶A氧化酶1(ACOX1)、乙酰辅酶A合酶(ACS)、脂蛋白脂肪酶(LPL)和肉毒碱棕榈酰转移酶l(CPT1)等的表达,促进脂肪酸氧化,也能减少脂质沉积[49]。此外,UDCA是目前用于治疗多种肝胆疾病的“万能药”,可通过FXR依赖性肝脂质代谢保护骨骼肌免受脂毒性损伤,已被证明可以有效改善脂肪变性和炎症[50]。而在维持胆固醇代谢稳态方面,FXR经胆汁酸激活后,诱导产生的成纤维细胞生长因子15(FGF15)改变初级胆汁酸与次级胆汁酸的比例,增强胆汁的亲水性,进而通过ATP结合转运蛋白ATP结合盒(ATP binding cassette,ABC)G5/G8促进胆固醇排出肠腔,防止胆固醇淤积[51]。而TGR5在能量稳态中也起着重要作用,其通过对棕色脂肪组织能量的消耗和增强胰岛素敏感性以改善能量利用效率[52]。
2.3 胆汁酸在维持热应激状态下畜禽肠道健康的潜力
畜禽肠道健康在热应激期间承受大量内源性和外源性刺激,破坏畜禽的肠道功能,影响营养物质消化和吸收,甚至导致死亡[53]。热应激期间,血液从内脏器官到体表的分配量增加以尽可能的通过辐射散热,肠道充血减少导致肠道细胞缺氧、ATP耗竭、酸中毒和细胞功能障碍,从而导致肠道绒毛萎缩、肠上皮细胞凋亡[54]。此外,在脂多糖(lipopolysaccharide,LPS)刺激下,无论在体内试验还是在体外试验,均会导致循环胰岛素水平升高,影响肠道屏障功能[55-56]。Pearce等[57]和Fernandez等[4]研究发现,热应激导致生长猪的肠道通透性增加,血清LPS含量上升,进而造成肠道紧密连接蛋白受到破坏。热应激状态下,LPS刺激上皮肌球蛋白轻链激酶(myosin light chain kinase,MLCK)的高度表达,其表达和活性是诱导肠道紧密连接通透性增加的关键因素,而MLCK基因的信号转导级联是调节紧密连接的重要机制[8,58]。热应激引发的肠道细胞缺氧条件下,回肠黏膜缺氧诱导因子-1α(HIF-1α)的表达迅速升高,以供缺氧条件下细胞的存活[59]。有研究认为,HIF-1α也可能激活MLCK,导致肠道通透性升高[60]。CDCA可改善热应激状态下肠通透性增加、MLCK表达量升高以及紧密连接蛋白表达降低等负面影响,减轻LPS诱导的肠道屏障损伤[8]。有研究表明,CDCA参与降低断奶仔猪的肠道通透性,降低血清LPS含量[61],并刺激CCK的分泌[62]。在肝脏和肠道中,TGR5/cAMP信号通过抑制核因子-κB(NF-κB)介导的炎性细胞因子产生而具有抗炎功能,保护肠屏障完整性并预防结肠炎[63-64]。胆汁酸作为FXR的内源性配体,可以激活参与肠道保护因子的表达,抑制细菌过度生长,还能降低促炎性细胞因子白细胞介素-8(IL-8)、诱导型一氧化氮合酶(iNOS)和碳酸酐酶12(CAR12)等黏膜损伤有关基因的表达[9]。如UDCA可以作用于黏膜免疫细胞,能特异性抑制肿瘤坏死因子-α(TNF-α)诱导的促炎性细胞因子IL-8的释放[65]。
热应激会打破畜禽肠道菌群质和量的生态平衡,造成肠内微生态失衡,有益菌数量和代谢产物的减少对肠道黏膜免疫和全身细胞因子的分泌造成负面影响。如厚壁菌门(Firmicutes)和拟杆菌门(Bacteroidetes)是猪肠道中的优势菌群[66],而最近研究指出,热应激降低猪肠道中Bacteroidetes的相对丰度,增加变形菌门(Proteobacteria)、γ-变形菌纲(Gammaproteobacteria)、假单胞菌目(Pseudomonadales)、莫拉菌科(Moraxellaceae)和不动杆菌属(Acinetobacter)的相对丰度[67]。热应激期间畜禽采食量大幅下降是影响肠道菌群的主要因素之一,有研究认为采食量通常与Bacteroidetes相对丰度和SCFA含量呈正相关,而与Proteobacteria相对丰度呈负相关[68]。Bacteroidetes主要通过多糖的酵解并产生SCFA为宿主提供能量,且SCFA有利于维持肠道黏膜的低pH环境以抑制病原体的生长,缺乏SCFA会减弱其对肠黏膜屏障的保护作用,导致机体循环内毒素含量增加[69]。胆汁酸可以激活小肠中的固有免疫基因来直接或间接地调节肠道微生物组成,通过胆汁酸代谢促进相关细菌的生长和抑制其他胆汁敏感细菌的生长以塑造肠道微生物群落,保证肠道健康[70]。如TUDCA能促进菌群中有抗炎作用的粪肠球菌(Enterococcusfaecalis)和阿克曼氏菌(Akkermansia)的相对丰度大幅上升,降低促炎性的减少螺菌(Spirillumminus)和活泼瘤胃球菌(Ruminococcusgnavus)的相对丰度[71]。而肠道菌群在胆汁酸代谢中起着至关重要的作用,次级胆汁酸的化学组成受肠道微生物群落的调控,任何微生物菌群的干扰都有可能破坏胆汁酸的稳态并影响宿主的生理过程。如胆汁酸水解酶(bile salt hydrolase,BSH)属于微生物酶,BSH能够断开糖结合的胆汁酸和牛磺胆汁酸的氨基酸侧链,使之产生游离胆汁酸(CA和CDCA),后者在微生物的作用下还可进一步产生次级胆汁酸(DCA和LCA)。目前已经在一些细菌中发现BSH,主要是厌氧菌属,包括Bacteroides、Clostridium、Eubacterium、Lactobacillus以及Escherichia。研究表明,BSH有助于肠道微生物对胆汁的耐受性[72]。因此,BSH的活性在调节宿主体内的动态平衡中起着重要作用,并且该活性很可能在肠道屏障和免疫功能以及对宿主脂质和胆固醇代谢的调节中起关键作用[73]。未来还需要大量的工作来了解微生物产生的胆汁酸信号与宿主胆汁酸受体相互间微妙的作用,这些相互作用机制最终可能会成为驱动宿主健康或疾病的分子开关[74]。
2.4 胆汁酸在畜禽抗氧化应激中的作用
热应激状态下器官组织缺血会导致机体超氧化物歧化酶(SOD)和谷胱甘肽过氧化物酶(GSH-Px)活性下降,细胞清除自由基的能力下降,自由基不能及时清除或超过动物体内抗氧化系统的清除能力时就会造成氧化应激,进而导致脂质、肝脏和肌肉的氧化损伤。细胞在氧化应激情况下,线粒体产生大量的ROS[74]。同时,血浆中SOD和GSH-Px活性也会上调,产生更多的丙二醛(MDA)[75-76]。此外,作为细胞内的能量传感器,单磷酸腺苷激活的蛋白激酶(AMPK)被认为是维持细胞能量动态平衡的主要调节因子[77]。为满足细胞能量需求,AMPK被激活并促进骨骼肌中脂肪酸和葡萄糖的氧化[78]。Lu等[79]研究表明,处于热应激状态下7 d的肉鸡会导致AMPKα的磷酸化水平上升,AMPK被激活并增强了三羧酸循环和线粒体中脂肪酸的β-氧化,进而产生更多的能量。线粒体大量产生能量的同时不可避免地导致ROS水平升高,过量的ROS会破坏胞内脂质、蛋白质、核酸的结构,导致细胞功能障碍,最终造成机体代谢失常和免疫功能降低[80]。而一些胆汁酸在缓解氧化应激方面发挥着重要作用。Perez等[81]研究表明,UDCA通过提高肝脏内谷胱甘肽(GSH)水平增强机体的抗氧化损伤能力,促进肝细胞和胆管上皮细胞的免疫调节和胆汁分泌,也可能有助于此类亲水性胆汁酸保护细胞。TUDCA在机体中可以作为分子伴侣,以增强蛋白质折叠并保护肝细胞抵抗内质网应激[82]。TCDCA能通过提高机体各抗氧化酶活性及平衡各抗氧化酶在组织中的分布,增强机体抗氧化能力,抑制脂质过氧化,抵御氧自由基对动物组织造成的损害[83]。Liu等[10]通过分子建模研究,观察到胆汁酸主要以氢键和π-π堆积作用与Kelch样ECH关联蛋白1(Keap1)结合,上调核因子E2相关因子2(Nrf2)信号传导和影响下游蛋白质的表达,起到缓解氧化应激的作用。热应激条件下,肉鸡饲粮中添加200 mg/kg TUDCA能显著降低血清中MDA含量,提高肝脏的总抗氧化能力(T-AOC),降低氧化应激对鸡群产生的影响[84]。此外,UDCA和TUDCA能够在细胞和分子水平上起到直接的保护作用,包括稳固肝细胞膜、增强抗氧化应激能力以及抑制多种药物诱导的细胞凋亡[85],表明胆汁酸作为营养预防策略在缓解氧化应激和保护细胞等方面具有一定潜力。
3 小 结
近年来,许多研究评估了急性和长期热应激对畜禽生产造成的负面效应,以及寻求缓解热应激的有效策略。尽管早期研究均已经表明胆汁酸在维持动物的生理稳态方面至关重要,但还缺乏对热应激状态下胆汁酸代谢机制深入、系统的研究。畜禽既是重要的农业产品又是相关的生物医学模型,通过畜禽热应激模型对各类胆汁酸的功能和通路进行深度发掘,促进功能性胆汁酸的合理利用,有利于开发出缓解畜禽热应激和代替抗生素的新型绿色添加剂,其结果可能对人类健康和动物生产有重要影响。
