阻断肝脏Notch1/Jagged1通路对大鼠肝移植急性排斥反应的影响*
2021-07-12白赫,赖星,闫宇
白 赫,赖 星,闫 宇
(1.西安医学院附属第一医院普外科,西安 710000;2.重庆市潼南区人民医院肝胆甲状腺乳腺外科 402660;3.西安交通大学第一附属医院乳腺外科,西安 710061)
原位肝移植是治疗晚期肝病的有效方法,但免疫排斥是肝移植后的关键障碍[1-2]。尽管在肝移植患者中广泛应用免疫抑制剂能明显改善预后,但潜在的严重不良反应和急性排斥反应的发生仍然是肝移植患者生活质量低的主要因素[3]。
Notch通路在肝脏发挥免疫耐受功能中是必不可少的[3-5]。Notch在多种细胞类型的多个阶段中起着至关重要的作用,包括免疫细胞。哺乳动物家族中的Notch蛋白包括4种受体(Notch1~4)和一组包含Jagged(Jag1、2)、Delta样成员(DLL1、3和4)的配体[6-7]。Notch受体和配体是跨膜蛋白和细胞外结构域所需的细胞外结构域,这是紧密配体、受体相互作用的结果。这种细胞间相互作用导致受体的切割序列由蛋白酶介导,导致Notch细胞内结构域(NICD)释放到细胞核中[8-9]。
大量实验证明[7,10-11],阻断Notch1/Jagged1通路可以加强肝脏疾病的炎性反应。在Jagged1与Notch1受体结合后,带切口的NICD可以被释放并转移到细胞核中,并且可以诱导靶基因的激活,分裂Hairy和split-1的增强子(Hes1),进而调节下游炎性因子的表达。这些效应与Notch1/Jagged1通路效应一致[12]。本研究探讨阻断肝脏Notch1/Jagged1通路对大鼠肝移植急性排斥反应的影响。
1 材料与方法
1.1 动物及主要试剂
雄性Lewis大鼠60只,BN大鼠60只,5~6周龄,体重180~220 g,由重庆医科大学动物中心提供。
Jagged1、Notch1、P65、p-P65、GAPDH、白细胞介素(IL)-1、IL-6抗体均购自英国Abcam公司;PTEN、AKT、p-AKT、JNK、p-JNK、cleaved-caspase3抗体均购自美国CST公司;RNeasy 96试剂盒,PCR试剂盒购自德国DBI公司;逆转录试剂盒、SYBR Green PCR Master MIXPCR试剂盒购自宝生物工程(大连)有限公司;含有针对SHRNA-SHMT2的纯化滴度为1×1012PFU的慢病毒购自汉恒生物有限公司;TUNEL检测试剂盒购自罗氏公司。PCR基因引物序列由生工生物工程(上海)股份有限公司合成,见表1。
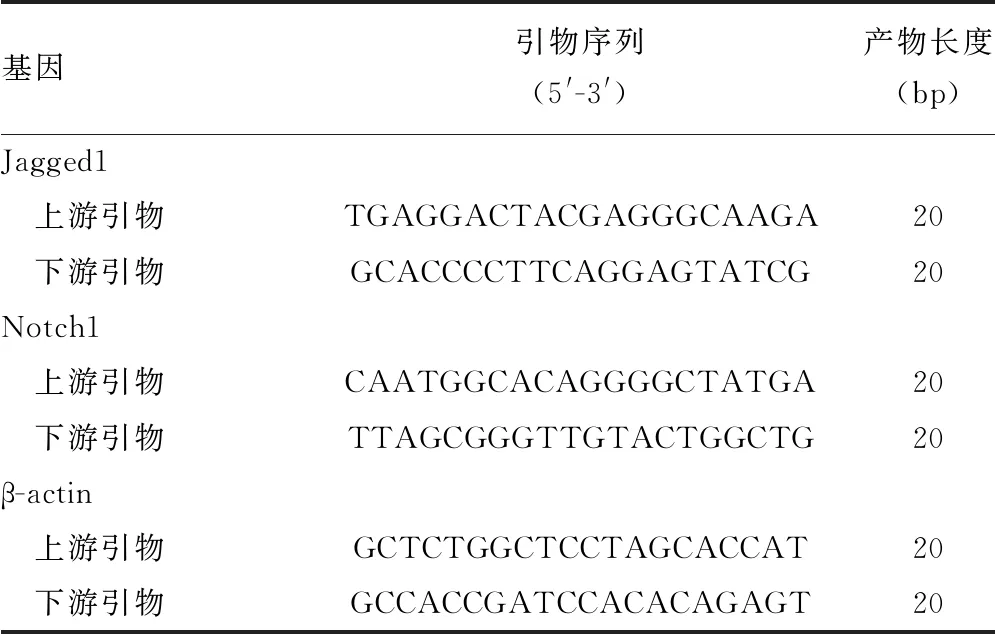
表1 PCR引物
1.2 方法
1.2.1动物模型的建立及分组
建立大鼠肝移植急性排斥反应模型。供体手术:将大鼠进行腹腔麻醉,麻醉后将大鼠固定在消毒后的手术台上,在手术区消毒处理。沿腹白线切开,术中避免肠管损伤。开腹后寻找剑突标志物并将其外翻,止血钳固定皮肤,以彻底暴露手术视野。无菌湿棉签将肠管轻刨至腹腔外。剥离胆总管,胆总管支架插入胆总管内,进一步固定。微量泵将4 °C乳酸林格氏液灌注至肝脏。灌注液从下腔静脉流出,待肝脏变为黄色,取下供肝。整修供肝后放入4 ℃冰箱保存备用。受体手术:乙醚吸入麻醉大鼠,将四肢固定于自制的手术台上,消毒处理。开腹后游离肝脏结扎门静脉,注入生理盐水,将肝脏里的血液推进全身以保证大鼠不休克,结扎下腔静脉,进入无肝期。沿肝脏上缘剪断肝上上腔静脉。剪断门静脉及肝下下腔静脉,受体取肝结束。移植供肝:11/0缝线缝合受体肝上下腔静脉。门静脉、肝上下腔静脉套管吻合结扎固定。结束无肝期,恢复灌注后变为鲜红色。仔细检查是否渗血,胆总管套管套入受体并结扎固定。温热生理盐水冲洗腹腔,帮助复温,关腹[13-14]。
将大鼠肝移植急性排斥模型分为4组,每组15对。SHAM组:不做任何处理建立肝缺血再灌注模型;NS组:肝缺血再灌注术前14 d尾静脉注射100 μL的生理盐水作为对照;shRNA-Jagged1组:肝缺血再灌注术前14 d尾静脉注射100 μL 1×1012PFU慢病毒;shRNA-GFP组:肝缺血再灌注术前14 d尾静脉注射100 μL 1×1012PFU空载慢病毒。
1.2.2肝功能检测
各组大鼠取血800 μL,1 200×g离心10 min,分离上层血清,检测丙氨酸氨基转移酶(alanine transaminase,ALT)、天门冬氨酸氨基转移酶(aspartate transaminase,AST)、总胆红素(total bilirubin,TBiL)水平。
1.2.3PCR检测肝组织Jagged1、Notch1 mRNA表达
采用RNeasy 96试剂盒分别提取各组肝组织的总RNA,反转录制备cDNA,按照说明书步骤操作。取样本cDNA,加入SYBR GreenⅠ进行定量PCR。反应条件:预变性95 ℃ 5 min;95 ℃ 30 s,60 ℃ 30 s循环40次。
1.2.4Western blot 检测Jagged1、Notch1、p-JNK、cleaved-caspase3等蛋白表达
将收集的各组大鼠肝组织剪碎,加入RIPA裂解液裂解组织,匀浆器研磨。按照碧云天蛋白质提取说明书提取总蛋白。将提取好的各组蛋白进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)2 h,转膜2 h,封闭1 h后加入一抗过夜,24 h后TBST洗涤3次,加入对应的二抗常温孵育1 h。TBST洗涤3次,加入显影液拍照。
1.2.5免疫荧光检测
取标本冰冻切片,PBS洗片5 min×3次。消除非特异性背景染色:滴加正常山羊血清封闭液(PBS稀释)室温封闭20 min后甩去液体,PBS洗片5 min×3次。滴加一抗于4 ℃条件下过夜,37 ℃复温30 min或37 ℃孵育1 h,PBS洗片5 min×3次。滴加荧光素标记的二抗37 ℃孵育60 min。PBS洗片5 min×3次。抗荧光淬灭剂封片,镜检。
1.2.6TUNEL法检测肝细胞凋亡水平
新制备的4%多聚甲醛溶液固定,室温30 min。细胞的通透:PBS洗片,与通透液在冰浴中孵育2 min。标记:PBS冲洗2次,滴加50 μL的TUNEL反应混合溶液,在湿盒中37 ℃孵育60 min。PBS冲洗3次。信号转化和分析:加入50 μL转化剂POD,在湿盒中37 ℃孵育30 min。PBS冲洗3次,加入50~100 μL DAB底物溶液,室温孵育10 min,PBS冲洗3次。封片,在荧光镜下分析结果。在显微镜下,观察各组细胞核染色的情况,以细胞核呈棕色为TUNEL阳性细胞,统计高倍镜下阳性细胞数,评估各组肝细胞凋亡水平。
1.2.7ELISA检测IL-1、IL-6、IL-10、转化生长因子(TGF)-β水平
根据试剂盒产品说明检测肝匀浆或上清液中炎症细胞因子的水平。0.05 mol/L pH 9的碳酸盐包被缓冲液将抗体稀释至蛋白质含量为1~10 μg/mL。在每个聚苯乙烯板的反应孔中加0.1 mL,4 ℃过夜。次日,弃去孔内溶液,PBS洗3 min×3次。加一定稀释的待检样品0.1 mL于上述已包被的反应孔中,37 ℃孵育1 h,洗涤。各反应孔中加入新鲜稀释的酶标抗体0.1 mL。37 ℃孵育0.5~1.0 h,洗涤。加入临时配制的TMB底物溶液0.1 mL,37 ℃孵育10~30 min。加入2 mol/L硫酸0.05 mL。于450 nm处以空白对照孔调零后检测各孔吸光度(A)值,若大于规定的阴性对照A值的2.1倍,即为阳性。
1.2.8肝组织病理检查
取移植肝组织放入10%中性甲醛中固定,常规脱水,二甲苯透明,石蜡包埋,3 μm厚切片,脱蜡、脱水,HE染色,100倍光学显微镜观察肝组织病变情况;根据Banff等制订的急性排斥反应标准进行病理分级。
1.3 统计学处理
2 结 果
2.1 大鼠肝移植后Notch1、Jagged1的表达变化
Western blot检测显示,在肝缺血再灌注后Notch1、Jagged1的蛋白表达明显升高,并在24 h达到最大值(P<0.05),见图1A~C。在同一时段采用PCR检测也发现Notch1、Jagged1 mRNA表达的升高趋势与Western blot检测结果一致,见图1D、E。由于在24 h时升高最明显,在后续实验中采用缺血再灌注24 h为实验时间点。

A~C:Western blot检测;D、E:PCR检测。
2.2 慢病毒沉默Jagged1后蛋白及mRNA表达变化
PCR、Western blot检测发现shRNA-Jagged1组Jagged1的表达明显降低(P<0.05),见图2A~C。免疫荧光检测发现,shRNA-Jagged1组Jagged1荧光表达明显降低,慢病毒沉默Jagged1成功,效果明显,见图2D。NS组及shRNA-GFP组比较差异无统计学意义(P>0.05)。
A~C:Western blot检测;D:免疫荧光检测(×100)。
2.3 各组大鼠肝移植后24 h肝功能水平变化
shRNA-Jagged1组AST、ALT、TBiL水平明显高于NS组和shRNA-GFP组(P<0.05),见图3。NS组及shRNA-GFP组比较差异无统计学意义(P>0.05)。

图3 各组大鼠肝移植后24 h肝功能水平变化
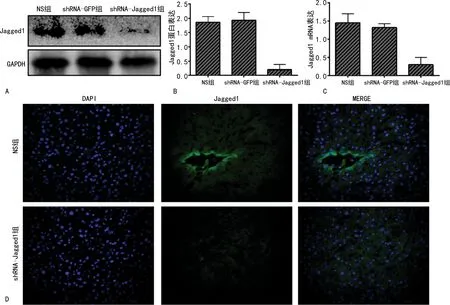
2.4 各组大鼠肝组织病理变化及排斥反应评分
光镜下观察到shRNA-Jagged1组出现大量肝细胞空泡样变,结构损伤,肝血窦堵塞等,较NS组的肝脏损伤更严重,见图4A。shRNA-Jagged1组的肝移植排斥反应评分明显高于NS组(P<0.05),见图4B。NS组及shRNA-GFP组比较差异无统计学意义(P>0.05)。
A:HE染色(×100);B:排斥反应评分。
2.5 各组大鼠凋亡细胞及p-JNK、cleaved-caspase3表达情况
shRNA-Jagged1组较NS组、shRNA-GFP组可见更多的棕黄色染色的凋亡细胞(P<0.05),见图5A、B。shRNA-Jagged1组p-JNK、cleaved-caspase3表达较NS组明显升高(P<0.05),见图5C、D。NS组及shRNA-GFP组比较差异无统计学意义(P>0.05)。

A、B:TUNEL法检测(×200);C、D:Western blot检测。
2.6 各组大鼠血清中炎性因子水平及肝脏调解炎症的通路
shRNA-Jagged1组IL-1、IL-6表达明显高于NS组,IL-10、TGF-β明显低于NS组,差异有统计学意义(P<0.05),见图6A~D。与NS组比较,shRNA-Jagged1组中PTEN、p-P65表达明显升高,p-AKT表达明显下降,IL-6、IL-1表达明显升高,差异有统计学意义(P<0.05),见图6E、F。NS组及shRNA-GFP组比较差异无统计学意义(P>0.05)。

A~D:炎性因子;E、F:肝脏调解炎症的通路。
3 讨 论
Notch通路在进化上是相对保守的,并且在组织的发育和更新期间调节许多细胞活性中起关键作用[15-16]。NICD通过CSL依赖性和独立通路调节其下游靶基因[17]。Notch1/Jagged1通路已被确认在干细胞中发挥重要作用。
肝移植排斥导致的炎症可归因于肝脏内各种细胞产生的先天免疫应答,本研究结果显示,肝移植排斥反应发生时Notch1、Jagged1的表达增加。有文献报道,Notch1/Jagged1通路的机制可能参与免疫通路的激活[18-19]。Notch1/Jagged1通路已被证明是控制免疫细胞发育和功能的重要调节因子[19]。PTEN负调节磷酸钙-3,4,5-三磷酸钙的细胞内水平,并通过负调节AKT/PKT通路激活肿瘤抑制因子[20]。在大鼠急性肝移植排斥期间,巨噬细胞介导的PTEN已被证明可调节急性炎性反应和内毒素致死率。在肝移植排斥反应发生后,shRNA-Jagged1组中抑制p-AKT活化的PTEN增加。PTEN还可以通过先天免疫细胞主动释放和促进KCs的先天免疫反应,提示其作为内源性风险信号或警报的作用可能涉及不同的受体,包括TLR2、TLR4和高级糖基化终产物,这触发了一系列炎性反应[21-22]。核因子(NF)-κB家族中的蛋白质充当转录因子并在炎症调节过程中起关键作用。通过p-AKT的减少,shRNA-Jagged1组中的TLR4明显活化。TLR通路通过髓样分化初级应答88-或含有toll-interleukin受体结构域的衔接子诱导IFN-β依赖性通路促进先天免疫应答的激活,这些通路有助于下游NF-κB活化和随后的炎性反应。本研究显示,阻断肝脏中Notch1/Jagged1通路增加了P65的磷酸化,这是NF-κB通路的关键蛋白[15,23]。同时阻断Notch1/Jagged1通路可激活NF-κB通路,加重肝移植急性排斥反应诱导的炎性反应,其具体表现为shRNA-Jagged1组中促炎因子IL-1、IL-6表达明显高于NS组。本研究还发现,肝移植急性排斥反应上调肝脏中Notch1、Jagged1表达,阻断Notch1/Jagged1通路通过PTEN/AKT/TLR4轴导致TLR4激活增强,直接引起肝脏内炎性因子的增加。HE染色和肝功能检测结果进一步证明Notch1/Jagged1通路的阻断或KCs的加重,破坏了肝脏结构组织和肝功能。提示阻断Notch1/Jagged1通路可能通过PTEN/AKT/TLR4对肝移植急性排斥反应发挥重要作用。
细胞凋亡已被证明在肝移植急性排斥反应的发病机制中起着重要作用[24-25]。JNK对于caspase3介导的细胞凋亡至关重要,有研究证实通过TLR4/JNK/NF-κB通路可以响应肝移植的急性排斥反应[26]。本研究发现,shRNA-Jagged1抑制Jagged1表达阻断Notch1/Jagged1通路,可以促进JNK信号激活,从而介导凋亡的产生。提示Notch1/Jagged1通路在其介导的免疫调节中控制JNK活化。同时shRNA-Jagged1对Notch1/Jagged1通路的阻断增加了JNK的磷酸化,并增加了肝移植急性排斥反应中裂解的caspase3。TUNEL实验为肝移植急性排斥反应中凋亡细胞的明显增加提供了进一步的证据。
本实验研究证明了Notch1/Jagged1通路可能通过PTEN/AKT/TLR4轴在肝移植急性排斥反应中发挥着重要作用。阻断Notch1/Jagged1通路增加了p-JNK和cleaved-caspase3表达,促进肝细胞凋亡,进一步加重了肝移植急性排斥反应。因此,调节Notch1/Jagged1通路的治疗可能是治疗急性排斥反应并改善接受肝同种异体移植物的大鼠存活率的有效策略。
