呼伦贝尔沙地樟子松人工林土壤细菌群落结构与功能预测
2021-07-12丁钰珮杜宇佳高广磊曹红雨朱宾宾杨思远张儆醒刘惠林
丁钰珮,杜宇佳,高广磊,3,*,张 英,曹红雨,朱宾宾,杨思远,张儆醒,邱 业,刘惠林
1 北京林业大学水土保持学院,水土保持国家林业和草原局重点实验室,北京 100083
2 北京师范大学地理科学学部,北京 100875
3 宁夏盐池毛乌素沙地生态系统国家定位观测研究站,盐池 751500
4 呼伦贝尔市林业科学研究所,呼伦贝尔 021000
土壤细菌参与凋落物分解和腐殖质形成等生态过程,联接着地上和地下生态系统,与植物和土壤联系密切,是陆地生态系统物质能量循环的重要环节,深刻地影响着陆地生态系统的稳定、调节和修复[1- 2]。一方面,植被可以通过凋落物和根系分泌物,改善土壤水分、养分和酸碱度条件,直接或间接地影响土壤细菌群落结构[3]。另一方面,土壤细菌能够通过代谢活动参与土壤生态过程,为植物提供所需的营养元素,促进植物的定植、生长、发育和演替[4-5]。此外,土壤细菌对环境变化还具有高度敏感性,其结构和功能变化能够有效指示土壤环境或植被的变化[6]。因此,土壤细菌是土壤微生物研究的重要和热点领域,得到了国内外学者的广泛关注[2]。
在研究早期,受制于相对落后的实验条件和研究方法,土壤细菌研究进展较为缓慢。近年来,受益于现代生物技术的飞速发展,国内外学者围绕土壤细菌开展了大量卓有成效的研究工作,在土壤细菌群落结构、多样性及其驱动因子等方面取得了丰硕的研究成果,极大地深化了我们对于土壤细菌的认知[4,7]。但是,由于土壤细菌丰富的物种、遗传和功能多样性及其与环境要素强烈的相互作用,复杂时空尺度条件和气候变化背景下土壤细菌群落结构依然是相关研究领域的重要内容。同时,土壤细菌功能也得到越来越多的关注,相关研究也逐渐转向土壤细菌功能预测与分析[8]。其中,土壤细菌功能与环境因子的互馈作用成为土壤细菌研究的重要方向[9- 10]。
PICRUSt(Phylogenetic Investigation of Communities by Reconstruction of Unobserved States)是一种基于系统发育与功能联系假设,判断和预测标记基因功能组成的微生物功能预测方法[11]。该方法采用16S rRNA测序基因与Greengenes数据库进行对比,依据基因相似性预测细菌代谢功能谱。与Tax4Fun和FAPROTAX等分析方法相比,PICRUSt数据库完善,方法便捷,功能先进,成本低廉,结果准确[12],已经成功应用于林地、草地、沙地等陆地生态系统土壤微生物功能分析,为深入理解土壤细菌功能提供了重要途径[12-13]。
沙地樟子松(Pinussylvestrisvar.mongolica)具有耐寒、耐旱、耐瘠薄等优良特性,是我国“三北”地区重要的生态环境建设树种[14]。呼伦贝尔沙地是我国四大沙地之一,既是沙地樟子松的原产地,也是沙地樟子松人工林的重要分布区,但营建沙地樟子松人工林对于土壤细菌群落结构和功能有何影响尚不明确。鉴于此,以呼伦贝尔沙地樟子松人工林为研究对象,采用16S rRNA高通量测序和PICRUSt功能预测相结合的研究方法,鉴定分析土壤细菌群落结构和功能特征,研究揭示土壤理化性质对于土壤细菌群落的影响,以期丰富完善土壤细菌群落结构、功能与环境因子互馈作用相关研究,并为沙地樟子松人工林的经营管理提供理论依据和科技支撑。
1 研究区概况
研究区位于内蒙古自治区呼伦贝尔市海拉尔国家森林公园(49°06′—49°28′ N,119°28′—120°34′ E),海拔约600—800 m,地处呼伦贝尔沙地,属于中温带半干旱大陆性草原气候。年均降水量约为346.5 mm,多集中于6—8月,年均气温-1.2℃,年均无霜期121 d,年均日照时数2701.5 h。境内河流主要有额尔古纳河、海拉尔河和辉河等,干支流总长约960 km。土壤类型为风沙土,土层较厚。研究区林下基本无灌木,多为草本植物,主要包括羊草(Leymuschinensis(Trin.) Tzvel.)、针茅(StipacapillataLinn.)、地榆(SanguisorbaofficinalisL.)、委陵菜(PotentillachinensisSer.)和狗尾草(Setariaviridis(L.) Beauv.)等。
2 材料与方法
2.1 土壤样品采集
2018年7月,在海拉尔国家森林公园用树木生长锥测量各林分树木年龄后,选取无经营管理措施、林下植被相似的25 a、34 a和43 a沙地樟子松人工林为实验组,并选取邻近地段沙质草地作为对照组(表1)。每个人工林样地内分别选取3株标准木,在树冠投影处采集土壤样品,草地则在样地内随机选取3个取样点采集土壤样品,样品采集深度为0—10和10—20 cm。在每个取样点的同一土层随机采集3个样品并充分混和为1个样品,4个样地共获得24份土壤样品。期间,为防止样品污染,采用75%酒精对取土钻和铁铲灭菌消毒,以保证土壤微生物样品采集在无菌条件下进行。同时,分别用环刀和铝盒采集土壤样品,用于测定土壤孔隙度和土壤含水量。所有土壤样品置于4℃便携式保温箱保存,运回实验室后转入-80℃冰箱中保存。

表1 样地基本概况
2.2 土壤理化性质分析
将各样地的新鲜土壤样品自然风干后过2 mm筛进行土壤理化性质的分析。采用烘干法测定土壤含水量(soil water content, SWC),环刀法测定土壤孔隙度(soil porosity, SP),重铬酸钾稀释热法测定土壤有机质(soil organic matter, SOM),靛酚蓝比色法测定全氮(total nitrogen, TN),钼锑抗比色法测定全磷(total phosphorus, TP),火焰分光光度法测定速效钾(available potassium, AK)[15]。
2.3 土壤细菌分离鉴定
使用PowerSoil DNA Isolation Kit试剂盒(MoBio Laboratories, Carlsbad, CA)提取土壤细菌样品DNA,完成抽提后,利用1%琼脂糖凝胶电泳检测抽提的基因组DNA。对16S rRNA基因的V3—V4区域进行PCR扩增,引物序列为338F(5′-CCTACGGGAGGCAGCAG-3′)、806R(5′-ATTACCGCGGCTGCTGG-3′)。扩增条件设置:95℃预变性5 min,95℃变性45 s,55℃退火50 s,72℃延伸45 s,28个循环。每个样品3次重复,将同一样品的DNA混合,作为每份土壤样品的总DNA。将 PCR产物混合后用2%琼脂糖凝胶电泳检测,使用AxyPrepDNA 凝胶回收试剂盒(AXYGEN 公司)切胶回收PCR产物,用Tris-HCl缓冲液洗脱后,使用2%琼脂糖凝胶电泳检测。
16S rRNA基因的PCR产物构建上机文库,使用Qubit进行检测定量,Nanodrop 粗检文库浓度,Agilent 2100 检测文库片段,qPCR 精确定量文库浓度。在Illumina Miseq平台对最后的文库进行上机测序。测序结果使用uclust、uparse、cdhit等方法对97%的相似水平下的OTU进行聚类统计分析,得到门、纲、目、科、属各水平群落的生物信息[16]。
2.4 数据处理与分析
采用SPSS 23.0计算平均值和标准差,进行单因素方差分析(One-way ANOVA),显著性水平0.05。采用Mothur软件计算Chao 1丰富度指数、Shannon多样性指数和Pielou均匀度指数。将由QIIME软件得到的biom文件上传到Galaxy网站进行PICRUSt功能基因预测分析,得到土壤细菌功能基因组成。选择土壤细菌相对丰度与土壤性质为数据矩阵,采用Canoco for Windows 4.5基于线性模型进行冗余分析(Redundancy Analysis, RDA),并进行蒙特卡洛检验(Monte-Carlo permutation test),检验重复数为499。
3 结果与分析
3.1 土壤细菌群落结构与多样性
呼伦贝尔沙地樟子松人工林和沙质草地土壤中共获得土壤细菌35门92纲109目210科267属,其中相对丰度≥1%土壤细菌门类均为12个(图1)。变形菌门(Proteobacteria)、放线菌门(Actinobacteria)和酸杆菌门(Acidobacteria)是研究区的主要土壤细菌优势门,平均相对丰度分别为24.29%±3.39%、23.72%±4.10%和23.40%±2.55%。随着林龄的增加,沙地樟子松人工林土壤优势细菌门相对丰度呈现波动变化趋势,25 a人工林0—10 cm层次变形菌门相对丰度显著高于43 a人工林(P<0.05);各林地间放线菌门和酸杆菌门相对丰度不存在显著差异(P>0.05)。沙质草地变形菌门和酸杆菌门相对丰度与人工林存在显著差异(P<0.05),变形菌门相对丰度比人工林低6.05%,酸杆菌门相对丰度比人工林高4.54%。各样地不同土层间土壤细菌组成较为相似,相对丰度无明显变化。

图1 呼伦贝尔沙地樟子松人工林土壤细菌相对丰度热图(门水平)
沙地樟子松人工林土壤细菌群落的Chao 1、Shannon和Pielou指数不存在显著差异(P>0.05)(表2)。沙地樟子松人工林土壤细菌群落的Chao 1和Shannon指数在43 a人工林中最高,在25 a人工林中最低;Pielou指数在各林地中基本一致,土壤细菌分布较为均匀。沙质草地土壤细菌群落的Chao 1和Shannon指数与人工林不存在显著差异(P>0.05),Pielou指数仅在0—10 cm土层与25 a和34 a人工林存在显著差异(P<0.05)。此外,研究区土壤细菌群落的Chao 1、Shannon和Pielou指数均随土层深度增加而降低,说明表层土壤细菌群落多样性水平相对较高,且分布更为均匀。
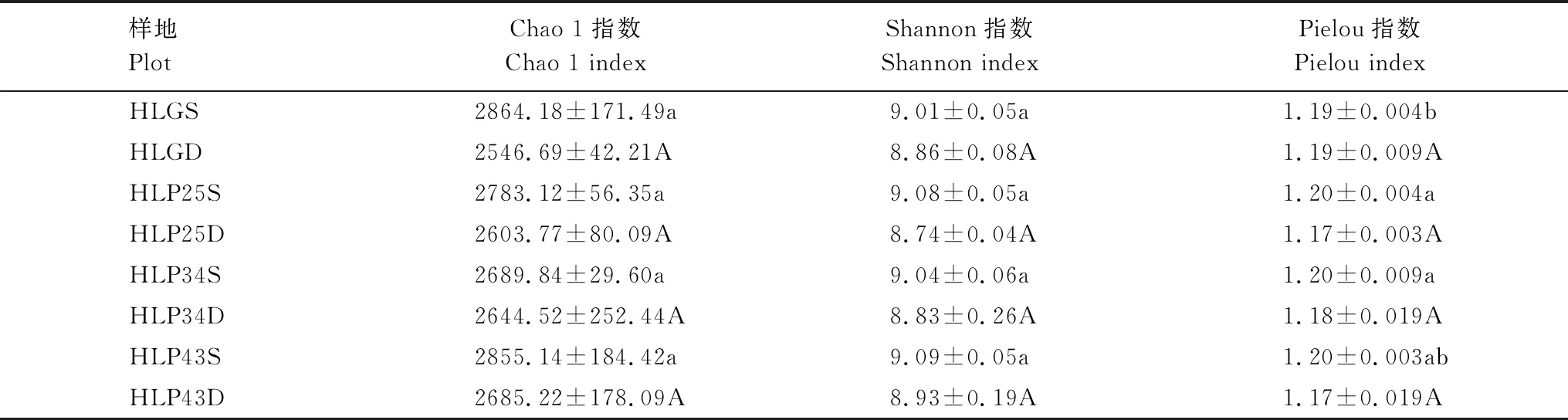
表2 呼伦贝尔沙地樟子松人工林细菌群落的Alpha多样性指数
3.2 土壤细菌群落结构与土壤理化因子的相关性
呼伦贝尔沙地樟子松人工林土壤理化性质波动性较强(表3)。随着林龄的增加,表层土壤含水量和有机质含量显著降低(P<0.05),土壤孔隙度先降低后升高,全氮、全磷和速效钾含量均表现为先增加再减少。沙质草地土壤的全氮和速效钾含量显著高于人工林(P<0.05),土壤孔隙度和全磷含量与人工林不存在显著差异(P>0.05)。
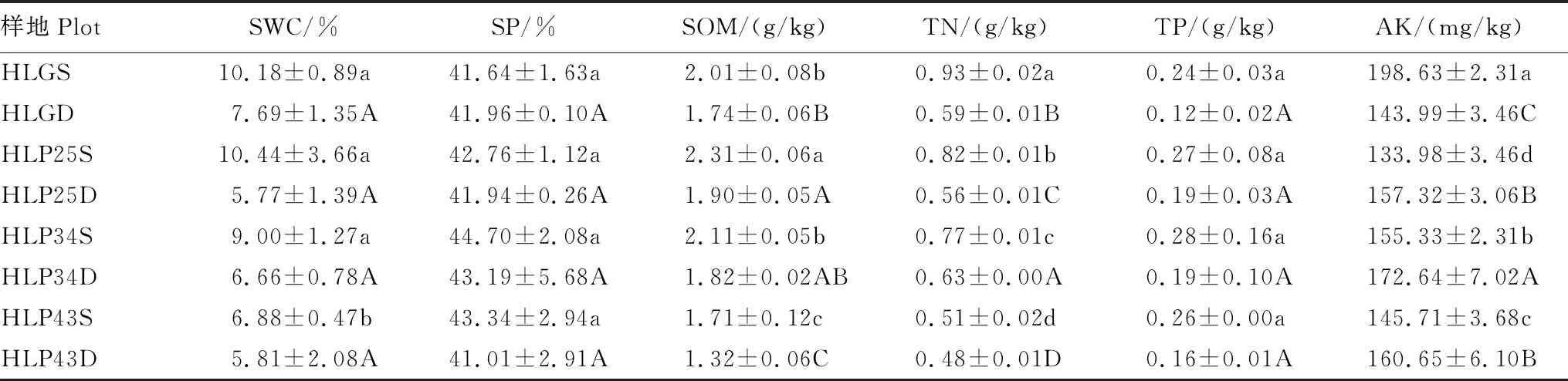
表3 呼伦贝尔沙地樟子松人工林土壤理化性质
冗余分析结果显示(图2),第一排序轴特征值为42.4%,第二排序轴特征值为10.8%,前两轴累积解释量占特征值的总和50%以上,RDA前两轴能很好地反映土壤细菌群落与土壤因子之间关系的大部分信息[17- 18]。样本点分布相对离散,说明不同样地土壤细菌群落结构存在差异且受土壤理化性质影响较大。经蒙特卡洛检验,速效钾、全磷和全氮是研究区土壤细菌群落的主要影响因子(P<0.05)。不同林龄沙地樟子松人工林土壤细菌群落结构与土壤理化因子的相关性有差异,25 a和34 a人工林土壤细菌的主要影响因子为全氮(P<0.05),43 a人工林土壤细菌的主要影响因子为土壤含水量(P<0.05)。沙质草地土壤细菌群落的主要影响因子为全磷(P<0.05)。此外,各样地0—10 cm土层细菌群落与土壤含水量呈正相关,10—20 cm土层情况相反。
3.3 土壤细菌功能预测
呼伦贝尔沙地樟子松人工林土壤细菌共得到5个生物代谢通路(图3)。其中,环境信息处理、代谢和遗传信息处理是人工林土壤细菌功能的重要组成,其相对丰度分别为32.62%±0.98%、26.43%±0.31%和8.13%±0.28%。沙质草地一级代谢功能种类与人工林相同。
沙地樟子松人工林中,43 a人工林0—10 cm土层环境信息处理功能基因相对丰度显著低于其他林地,代谢、遗传信息处理和有机系统功能基因相对丰度显著高于其他林地(P<0.05)。与沙质草地相比,25 a和34 a人工林0—10 cm土层环境信息处理和细胞过程功能基因相对丰度显著高于沙质草地,代谢、遗传信息处理和有机系统功能基因相对丰度显著低于沙质草地(P<0.05)。此外,研究区土壤细菌代谢、遗传信息处理、有机系统和细胞过程功能基因相对丰度均表现为0—10 cm>10—20 cm,沙质草地和43 a人工林土壤细菌环境信息处理功能基因相对丰度表现为0—10 cm<10—20 cm。

图2 呼伦贝尔沙地土壤细菌群落与环境因子的冗余分析

图3 呼伦贝尔沙地樟子松人工林土壤细菌功能预测(一级功能层)
沙地樟子松人工林和沙质草地土壤细菌功能基因的5个一级功能层共有31个子功能。其中,共有10个二级功能层相对丰度>1%(图4),且膜运输功能占主导地位,其相对丰度为32.60%±0.98%,其他功能相对丰度均低于10%。沙地樟子松人工林中,43 a人工林0—10 cm土壤细菌复制和修复、酶家族、核苷酸代谢、能量代谢和碳水化合物代谢的功能基因相对丰度显著高于其他林地,膜运输功能基因相对丰度显著低于其他林地(P<0.05)。25 a与34 a人工林所有二级功能相对丰度均不存在显著差异(P>0.05)。与沙质草地相比,25 a和34 a人工林0—10 cm土层膜运输功能基因相对丰度显著高于沙质草地,其他二级功能基因相对丰度均显著低于沙质草地(P<0.05)。此外,人工林和沙质草地各功能基因在不同土层深度相对丰度基本一致,无明显变化规律。

图4 呼伦贝尔沙地樟子松人工林土壤细菌功能预测热图(二级功能层)
4 讨论
4.1 呼伦贝尔沙地樟子松人工林土壤细菌群落结构特征
呼伦贝尔沙地樟子松人工林土壤细菌优势门为变形菌门、放线菌门和酸杆菌门,与此前学者在呼伦贝尔地区的研究结果一致[12]。酸杆菌属于典型的寡营养型细菌,而变形菌属于富营养型细菌,适生于养分含量高的土壤环境[19]。因此,变形菌门和酸杆菌门相对丰度可以用作土壤质量评价[20]。人工林变形菌门相对丰度显著高于沙质草地,酸杆菌门显著低于沙质草地,这是由于人工林和沙质草地的环境条件明显不同,人工林产生的大量枯落物以及根系分泌物能够提高土壤养分含量,导致土壤细菌生活的微生境及养分需求有差异,进而改变细菌类群比例[21]。但随林龄的增加,研究区沙地樟子松人工林中变形菌门相对丰度逐渐降低,这表明土壤养分状况下降,可能与植被根系生物量的衰退以及凋落物分解速度降低有关[22]。此外,研究区厚壁菌门(Firmicutes)相对丰度仅为1%左右,与陕北沙化地区和内蒙荒漠草原存在较大差异[23- 24],说明不同的植被能够通过凋落物输入及根系分泌物等差异改变土壤环境,进而影响土壤细菌群落组成。
土壤细菌多样性对提高土地生产力、增强胁迫环境下群落稳定性有着重要影响。研究区各林地土壤细菌群落多样性无显著差异,说明随着沙地樟子松人工林林龄的增加,土壤细菌群落结构较为稳定。同时,人工林土壤表层细菌多样性水平较高,这与其他学者的研究结果相似[25]。这是由于密集分布在土壤表层的樟子松根系及其分泌物能为细菌提供丰富的能源物质[26]。
4.2 呼伦贝尔沙地樟子松人工林土壤细菌群落的影响因素
土壤细菌群落结构与土壤理化性质紧密相关且相互影响。随着人工林林龄的增加,全磷含量先增加再降低,土壤有机质和全氮含量逐渐下降,且林地全氮含量低于沙质草地,这与前人研究存在差异[27]。呼伦贝尔沙地位于寒温带大陆性半干旱地区,冬季漫长,植物生长期短,林地土壤表面养分含量与凋落物分解速率紧密相关。当沙地樟子松为20—30龄时,樟子松生长旺盛,凋落物量增加,土壤养分积累量增加,土壤养分含量升高[28];而后,随着林木生长,樟子松生长变缓,植物凋落物和根系分泌物的养分归还量小于植物的养分吸收量,沙地樟子松人工林土壤养分库存在消耗的现象[22,29]。呼伦贝尔沙地樟子松人工林土壤细菌群落的主要影响因子为速效钾、全磷和全氮,与前人研究结果相似[30- 31],说明土壤细菌群落结构与氮、磷、钾等营养元素密切相关,土壤限制性资源对土壤细菌相对丰度有显著影响。25 a和34 a人工林土壤细菌的主要影响因子为全氮,可能是由于该地土壤氮资源与林地初级生产力紧密相关[32],两林地内全氮含量较高,充足的能源物质也有利于土壤细菌的存活和繁衍;43 a人工林土壤细菌的主要影响因子为土壤含水量,该林地的土壤含水量显著低于其他样地,较低的土壤水分含量会限制微生物的代谢功能以及呼吸底物的扩散,导致土壤呼吸作用减弱,并且水分胁迫还会通过改变根际环境来影响土壤细菌区系[33- 34]。此外,各林地0—10 cm土层细菌群落相对丰度与含水量呈正相关,10—20 cm土层中两者呈负相关。10—20 cm土层土壤含水量较低,仅为表层的0.55—0.74倍,进一步说明了当土壤中水分含量较低时,土壤含水量会成为限制土壤细菌群落分布的主要因素。
4.3 呼伦贝尔沙地樟子松土壤细菌功能特征
植被对土壤细菌群落结构的影响会进一步影响土壤细菌功能组成[35]。呼伦贝尔沙地樟子松人工林土壤细菌主要涉及5个一级功能层和31个二级功能层。其中,土壤细菌代谢功能活跃且极为重要,如碳水化合物代谢与固氮、溶磷等作用密切相关,有益于植物的氮、磷循环[36- 37];氨基酸代谢可以帮助细菌吸收氨基酸,有利于细菌的存活与繁衍[38],部分土壤细菌类群还可以通过代谢产生抗生素、抑菌蛋白及促生长激素等,抑制病原菌并促进植物生长[39]。43 a人工林代谢功能基因相对丰度显著高于其他林地,说明沙地樟子松人工林能够提高土壤细菌代谢活动,从而促进自身对养分的吸收和利用。同时,研究区土壤细菌活跃的膜运输功能有利于维持细菌各项生命活动,是土壤细菌正常发挥其功能的基础[40]。沙质草地的部分功能基因相对丰度显著高于25 a和34 a人工林,这些功能的活跃也许能使土壤细菌在较为严苛的环境中更好地吸收养分。此外,土壤细菌功能随不同样地的变化均表现在0—10 cm土层,说明土层深度对细菌功能基因组成的影响较大,表层土壤细菌功能对环境变化更为敏感。
5 结论
呼伦贝尔沙地樟子松人工林土壤细菌隶属35门92纲109目210科267属,主要优势门为变形菌门、放线菌门和酸杆菌门。人工林变形菌门相对丰度显著高于沙质草地,酸杆菌门相对丰度显著低于沙质草地。不同林龄人工林土壤细菌群落多样性无显著差异。研究区沙地樟子松人工林土壤细菌群落结构的主要影响因子为速效钾、全磷和全氮。沙地樟子松人工林土壤细菌群落主要涉及5个一级功能层和31个二级功能层,43 a人工林土壤细菌代谢功能活跃,有利于促进植物对养分的吸收和利用。沙地樟子松人工林的种植改善了土壤细菌群落结构,促进土壤细菌代谢功能。研究成果有助于深入理解沙地樟子松与土壤细菌的互馈关系,并可为沙地樟子松人工林可持续经营管理提供理论依据。
