亚热带水库浮游植物季节动态及其与环境因子的关系
2021-07-12王远飞周存通赵增辉林植华
王远飞,周存通,赵增辉,林植华,*
1 南京师范大学生命科学学院, 南京 210023
2 丽水学院生态学院, 丽水 323000
浮游植物群落是湖泊和水库的主要初级生产者,是水生食物链的基础[1]。因此,浮游植物对维持健康的水生生态系统至关重要,经常被用作水生生态系统健康和化学污染物胁迫效应的指标[2]。浮游植物种类组成、分布和主要色素叶绿素a(Chl-a)浓度的动态变化是水质和营养状况的生物指标。一般来说,浮游植物的种类组成和数量分布在理化参数的影响下呈现出广泛的时空变化[3]。这种变化通常被认为是由环境变量例如温度[4- 5],光照,营养盐[6- 7]的上行效应和浮游动物的下行效应控制[8]。这些因子发生变化,将在一定程度上影响浮游植物群落结构[9]。由于浮游植物对环境因素的敏感性,通常作为检测河流、湖泊等淡水水体水质局部变化的关键指标,为水污染和富营养化提供早期预警信号[10]。
水库是具有经济和生态重要性的人造水体,提供重要的淡水资源和生态服务,具有重要的社会和经济价值[11]。富营养化是湖泊和水库最严重的生态问题之一,导致水质退化和用水严重限制[12],由此造成的浮游植物大量繁殖引起的藻类水华已成为全球水质的重大威胁[13],已成为中国和许多其他国家最普遍的水质问题[14]。近年来,在中国沿海和湖泊等大型水生生态系统中已经开展了关于浮游植物及其控制因素的广泛研究[15- 17],对小型亚热带水库浮游植物群落与环境因子的关系也有少量相关的报道[18- 19]。
黄村水库流域位于浙江省西南部,属亚热带小型饮用水水库,近年来遭受污染并出现局部蓝藻水华。本研究对水库表层水中的浮游植物进行了鉴定和计数,记录相关的环境因子。研究了亚热带小型水库浮游植物丰度的动态变化及其演替模式;通过浮游植物群落组成与水生环境因子的冗余分析(RDA),分析了影响浮游植物动态变化的关键环境因子;为该流域生态变化、水质评价和污染控制提供基础数据和科学依据。
1 材料与方法
1.1 研究区域
黄村水库流域位于浙江省西南部,坐标东经118°41′—120°26′和北纬27°25′—28°57′之间。该水库正常蓄水位149.20m,流域面积184.3km2,水库总库容1876万m3,年供水总量为2920万t。黄村水库流域地处亚热带季风气候区,温暖湿润,降水丰沛。流域内无工业企业、养殖场,且流域内耕地为梯田和水平地并无顺坡耕作现象,因此流域内无工业污染源、养殖场污染及农业污染[20]。
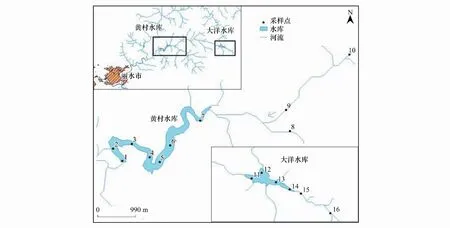
图1 黄村水库流域采样点设置
1.2 取样和分析
根据候平均气温四季划分方法,研究区域四季变化为春季3—5月、夏季6—9月、秋季10—11月和冬季12月—次年2月[21]。在2017年4月至2018年3月期间,从该流域16个取样点每月采集浮游植物和水样。浮游植物的分类分析,用浮游生物网(55μm网目)从表层水中提取定性浮游植物样品,并转移到100mL聚乙烯瓶中。对于浮游植物的定量分析,采集表层水样并转移到500mL聚乙烯瓶中。定性和定量浮游植物样品均在现场用鲁哥试剂保存(最终浓度为4%)[22]。使用×20,×40和×100物镜在光学显微镜(Olympus BX51)下测定浮游植物物种组成、生物量等信息。浮游植物鉴定依据中国淡水藻类和蓝藻分类的最新研究[2]。根据Utermöhl沉淀法用倒置显微镜(Olympus CKX- 41)分别用×20和×40物镜对藻类进行计数[23]。
在浮游植物采样的同时采集表层水样品,转移到2L聚乙烯瓶中,立即送往实验室进行水化学分析。使用YSI-多参数水质测量仪现场测量电导率(EC)、pH、溶解氧(DO)和水温(WT)。用萨氏盘测量水透明度(Turb)。
水样在取样当天进行过滤。对过滤后的水样进行硝酸盐氮(NO3-N)、铵态氮(NH4-N)、亚硝酸盐氮(NO2-N)分析,对未过滤的水样进行总氮(TN)、总磷(TP)、高锰酸盐指数(CODMn)分析。
用分光光度法对NO3-N(2,6-二甲基苯酚法)、NH4-N(苯酸盐法)、NO2-N(重氮化法)、TN(过硫酸盐消解后2,6-二甲基苯酚法)和TP(过硫酸盐消解后抗坏血酸法)进行分析,通过重铬酸盐回流法测定CODMn[24]。
1.3 数据分析
根据每个物种的优势度确定浮游植物的优势种,如下式所示。
Y=(ni/N)×fi
式中,N为样品所有物种的总丰度,ni为样品中第i个物种的总丰度,fi为该物种在所有样品中出现的频率。如果物种的优势度值Y大于0.02,则认定为优势种[17]。
利用Shannon-Wiener多样性指数(H′)、Margalef丰富度指数(D)和Pielous均匀度指数(J)计算浮游植物群落指标。指数通过以下等式计算[25]:
D=(S-1)/lnN
J=H′/lnS
式中,Pi是物种i的丰度与所有物种丰度(N)的比值,S是物种总数。
利用物种丰度数据进行去趋势对应分析(DCA)来确定是采用线性排序还是单峰排序。DCA四个轴中梯度最大值超过3,选择典范对应分析(CCA),否则选择冗余分析(RDA)。数据分析时,所有物种数据均进行lg(x+1)转化,通过这种转化,降低稀有种对分析结果的影响。此外,除pH外的所有环境变量均进行lg(x+1)转化。DCA是使用CANOCO 5进行的[1]。
数据用STATISTICA统计软件包(verison 10.0)分析。在作进一步统计分析前,用Kolmogorov-Simirnov和Bartlet方法分别检验数据的正态性和方差同质性。Pearson相关分析用于评估浮游植物丰度与环境因子之间的关系,方差分析及后续的多重比较检验相关因子的季节差异,显著性水平设为α=0.05。
2 结果
2.1 环境变量
方差分析结果显示(表1),NH4-N和电导率季节差异不显著。水温季节差异显著,从高到低依次为夏季、秋季、春季和冬季;冬季pH显著低于春季、夏季和秋季,春季、夏季和秋季之间pH差异不显著;春季DO显著高于夏季、秋季和冬季,冬季DO显著高于夏季和秋季,夏季和秋季之间差异不显著;春季、冬季TN显著高于夏季、秋季,春季和冬季之间差异不显著,夏季、秋季之间差异不显著;冬季NO3-N显著高于夏季,春季和秋季NO3-N处于二者之间并无显著差异;春季和夏季高锰酸盐指数显著高于冬季,秋季与其他季节差异不显著;春季、夏季NO2-N显著高于秋季、冬季,春季和夏季之间、秋季和冬季之间差异不显著;秋季TP最高、冬季最低,春季和夏季处于二者之间;冬季透明度最高、春季最低,夏季和秋季处于二者之间。

表1 环境因子季节比较(平均值±标准差)
2.2 浮游植物群落动态
2.2.1浮游植物群落组成
本研究共鉴定出浮游植物9门51种。种类最多的是绿藻门(18种)(35.29%),其次是硅藻门(15种)(29.41%)和蓝藻门(11种)(21.57%),甲藻门、褐藻门、黄藻门、隐藻门、眼虫藻门、金藻门分别各1种(1.96%)。
浮游植物年平均丰度为19.92×106个/L。平均丰度春季最高(35.14×106个/L),夏季和冬季次之(分别为19.13×106个/L,19.67×106个/L),秋季最低(5.74×106个/L)(图2),但差异不显著(P> 0.05)。春季蓝藻门丰度最高(62.96%)、硅藻门次之(18.40%),夏季蓝藻门丰度最高(71.03%)、绿藻门次之(11.93%),秋季硅藻门丰度最高(56.11%)、绿藻门次之(22.47%),冬季硅藻门丰度最高(80.74%)、隐藻门次之(13.69%)(图3)。
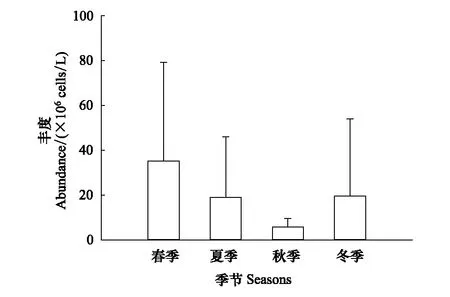
图2 黄村水库流域不同季节浮游植物丰度(平均值±标准差)

图3 黄村水库不同季节各门类浮游藻类相对丰度
2.2.2浮游植物优势种
黄村水库流域4个季节浮游植物优势种及优势度见表2。这些优势种中,尖尾蓝隐藻(Chroomonasacuta)和曲丝藻(Achnanthidiumsp.)在春夏秋冬季节均出现,其中曲丝藻是秋季优势度最高的物种(表2)。除春季外,优势种啮蚀隐藻(Cryptomonaserosa)和小环藻(Cyclotellasp.)在其余3个季节均出现,其中小环藻是冬季优势度最高的物种。春季和夏季,黄村水库流域优势度最高的物种均为伪鱼腥藻(Pseudoanabaenasp.),且丰度最大。漂浮泽丝藻(Limnothrixplanctonica)在春夏季出现,浮游蓝丝藻(Planktothrixsp.)在夏季出现,圆筛藻(Coscinodiscussp.)在秋冬季出现,针杆藻(Synedra)和双对栅藻(Scenedesmusbiguga)在秋季出现,钝脆杆藻(Fragilariacapucina)、异极藻(Gomphonema)和扁圆卵形藻(Cocconeisplacentula)在冬季出现。

表2 黄村水库流域浮游植物优势种及优势度
2.2.3浮游植物多样性指数
不同的生物多样性指标可以以不同的方式表达浮游植物群落或组合的多样性,但综合利用这些指标是评价群落多样性的最佳方法[17](图4)。方差分析结果显示,夏季物种数最多、秋季最低,春季和冬季处于二者之间;Shannon-Wiener指数季节差异不显著;Margalef丰富度指数夏季最高、秋季最低,春季和冬季处于二者之间;Pielous均匀度指数冬季最高、春季最低,夏季和秋季处于二者之间。

图4 不同季节浮游藻类种类数和多样性指数(平均值±标准差)
2.3 浮游植物群落与环境因子的关系
浮游植物丰度与环境因子相关性矩阵见表3。春季浮游植物总丰度与电导率呈显著负相关(P=0.048);夏季浮游植物总丰度与高锰酸盐指数呈显著正相关(P=0.038);秋季浮游植物总丰度与高锰酸盐指数(P=0.001)、pH(P=0.014)和温度(P=0.012)呈显著正相关,与电导率呈显著负相关(P=0.022);冬季浮游植物总丰度与电导率(P=0.002)、NO3-N(P=0.024)呈显著正相关,与温度(P=0.008)呈显著负相关。Pearson相关性表明,影响黄村水库流域浮游植物群落的环境因子较为复杂,电导率、高锰酸盐指数、温度、pH和NO3-N是影响较大的环境因子。

表3 浮游植物丰度与环境因子相关性矩阵
DCA表明,4个季节所有轴的梯度最大值均小于3,为线性排序模型。因此,直接梯度分析采用冗余分析(RDA)。在RDA中,利用蒙特卡罗置换检验方法,检验环境参数对RDA中浮游植物数据解释的显著性。蒙特卡罗检验结果表明,4个季节RDA排序图第一轴与全部轴均呈显著性差异(P< 0.05),表明排序结果是可信的。春季RDA排序图如图5所示,春季环境因子共解释了89.00%的浮游植物群落总变量,轴Ⅰ和轴Ⅱ的特征值分别为0.87和0.02,累积解释了88.93%的物种变化信息。春季RDA显示漂浮泽丝藻、啮蚀隐藻、尖尾蓝隐藻、曲丝藻和衣藻(Chlamydomonas)与pH呈正相关,与氨氮呈负相关;色球藻(Chroococcussp.)和伪鱼腥藻与亚硝酸盐氮呈正相关,与电导率呈负相关。

图5 春季主要浮游植物和环境变量RDA排序图
夏季RDA排序图如图6所示,夏季环境因子共解释了59.50%的浮游植物群落总变量,轴Ⅰ和轴Ⅱ的特征值分别为0.51和0.07,累积解释了58.22%的物种变化信息。与Pearson相关分析结果一致,夏季RDA显示高锰酸盐指数、pH和亚硝酸盐氮是影响浮游植物群落分布的主要环境因子。浮游蓝丝藻、四尾栅藻(Scenedesmusquadricauda)和铜绿微囊藻(Microcystisaeruginosa)等大多数藻类与高锰酸盐指数呈正相关,与总氮呈负相关。

图6 夏季主要浮游植物和环境变量RDA排序图
秋季RDA排序图如图7所示,秋季环境因子共解释了80.10%的浮游植物群落总变量,轴Ⅰ和轴Ⅱ的特征值分别为0.57和0.23,累积解释了79.49%的物种变化信息。与Pearson相关分析结果一致,秋季RDA显示高锰酸盐指数、pH、温度和电导率是影响浮游植物群落分布的主要环境因子。尖尾蓝隐藻、啮蚀隐藻和小环藻与高锰酸盐指数呈显著正相关,与电导率呈负相关;曲丝藻和衣藻与温度和pH呈正相关,与电导率呈负相关。

图7 秋季主要浮游植物和环境变量RDA排序图
冬季RDA排序图如图8所示,选取的环境因子共解释了65.50%的浮游植物群落总变量,轴Ⅰ和轴Ⅱ的特征值分别为0.56和0.08,累积解释了64.36%的物种变化信息。与Pearson相关分析结果一致,冬季RDA显示硝酸盐氮、温度和电导率是影响浮游植物群落分布的主要环境因子。舟形藻(Naviculasp.)、扁圆卵形藻和钝脆杆藻与电导率和硝酸盐氮呈正相关,与温度呈负相关;鼓藻(Cosmarium)和桥弯藻(Cymbellasp.)与DO呈正相关,与温度呈负相关。
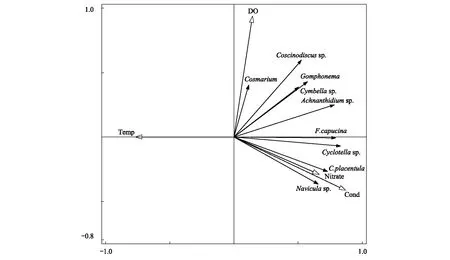
图8 冬季主要浮游植物和环境变量RDA排序图
3 讨论
3.1 环境变量季节变化
本研究发现黄村水库流域水质存在明显的季节性模式,例如亚热带气候导致水温随季节变化显著。pH反映了水中可用于浮游植物光合作用的溶解无机碳的量[26],秋季pH超过8,原因可能是强烈的光合作用减少可以利用的CO2,使水体的pH增加[27]。在11月份和12月份分别测得最大TP和TN浓度,这可能归因于流入的营养盐和水库沉积物释放的营养盐[28]。本研究夏季平均高锰酸盐指数最高,平均溶解氧含量最低,表明研究区内有机负荷较高,这可能与周边居民不良生产生活方式有关[11]。从水的透明度可以很好地预测浅层水库的水清澈度和生态质量[29-30],黄村水库流域春季水透明度最低,可能是由于整个水体的频繁混合和松散沉积物的再悬浮造成的[31]。此外,溶解的有机物质也会对水的透明度产生影响[32]。
3.2 浮游植物群落动态
在黄村水库流域观察到浮游植物群落的季节变化,春季NH4-N、NO2-N和TN平均浓度高导致浮游植物平均丰度春季最高。在群落季节组成上,春季(62.96%)、夏季(71.03%)蓝藻门丰度最高,黄村水库流域在春夏季已出现局部水域蓝藻水华,秋季(56.11%)、冬季(80.74%)硅藻门丰度最高,这与Wang等[33]对盛锦湖浮游植物群落结构变化的研究一致。
黄村水库流域优势种尖尾蓝隐藻在春夏秋冬季节均出现,由于隐藻独特的光合作用和辅助色素,其在低光条件下也能生长和繁殖[34]。此外,隐藻还具有鞭毛,能够调节自身在水体中的位置以获得最佳光照条件[35],因此在本研究期间广泛存在。春夏季优势度较高的优势种伪鱼腥藻、浮游蓝丝藻和漂浮泽丝藻,主要是蓝藻门,由于蓝藻中存在的气泡可以调节细胞的浮力,所以蓝藻比其他浮游植物更耐光[36],如果光线较弱,气泡则可以使蓝藻细胞移到水面,如果光线较强,气泡的作用是让蓝藻细胞移动到水底[2]。这种能力是蓝藻作为一年生优势种在春夏季广泛分布的原因之一。秋冬季优势度较高的圆筛藻、针杆藻、钝脆杆藻、异极藻和扁圆卵形藻,均属于硅藻门,这表明浮游植物优势种从春夏季蓝藻门向秋冬季硅藻门演替,Winder等[37]发现,在秋季水温较低时,在湖泊和水库中存在大量硅藻。
Shannon-Wiener指数、Margalef丰富度指数、Pielous均匀度指数等单变量物种多样性指数被认为是识别浮游植物群落结构和指示生态系统健康的解释参数[38]。物种多样性指数的下降模式可能与某一特异性或多物种浮游植物水华形成有关[3],春季,有益的环境水质促进伪鱼腥藻的增殖(占春季浮游植物总丰度的57.10%),导致物种多样性指数下降。浮游植物多样性指数在夏季表现出较高的值,表明浮游植物群落由更多物种主导,这与我们的观测结果相一致。此外,浮游植物多样性指数也被用来评估湖泊和水库的营养状况[39-40]。高多样性指数表示生态系统健康,而低值表示生态系统不健康或退化[41]。在富营养化湖泊水库中,Shannon-Wiener指数通常在0—1之间,在中-富营养化湖泊水库中,Shannon-Wiener指数通常在1—2之间,在中营养化湖泊水库中,Shannon-Wiener指数通常在2—3之间,在寡营养湖泊水库中,Shannon-Wiener指数通常大于3[1,42]。在该研究中,Shannon-Wiener指数年平均值为2.84,表明水体处于中营养状态,因此,黄村水库可归类为中营养化水库。
3.3 浮游植物群落结构对环境水质的响应
浮游植物的生长和分布很大程度上取决于环境变量的影响[43]。Pearson相关分析显示,温度和营养盐是影响较大的环境因子。温度对不同的浮游植物分类群产生物种特异性影响[44],影响大多数浮游藻类的生长和繁殖速率[45],导致浮游植物群落组成的变化。通常认为较高的温度有利于绿藻门和蓝藻门的生长和繁殖[46-47],当水温升高到25℃以上时,蓝藻达到最大生长速率,当春季和夏季水温大幅上升时,它们的细胞丰度会迅速增加,相反,硅藻喜欢较冷的水[35],秋冬季水温相对较低并伴随着水体热分层的破坏[1],水体混合完全,硅藻通常会兴盛,因为它们沉重的硅质细胞壁会导致它们在热分层过程中下沉[37]。Turner等[48]研究发现,硅藻的丰度与温度呈反比关系,在低于18℃的温度下,硅藻的丰度较高。在本研究中,夏季蓝藻占71.03%,冬季硅藻占80.74%,这与Abirhire等[35]和Turner等[48]的研究结果相一致。
与Pearson相关分析结果一致,RDA结果显示黄村水库流域中的浮游植物群落受水温、DO、pH和高锰酸盐指数的调控。在春季,浮游植物群落中以伪鱼腥藻为主,与NO2-N和pH呈正相关,与NH4-N和电导率呈负相关,表明浮游植物群落受到综合因素的影响。夏季水体出现铜绿微囊藻,本文数据表明与DO呈显著正相关,与TN、TP呈负相关,Varol[1]认为与水温、DO和高锰酸盐指数呈正相关,与TN,NO3-N,DIN和TP呈负相关,该物种也出现在土耳其Arancio湖[49],Charzykowskie湖[50]以及Glebokie湖[51]。除春季外,优势种小环藻在其余2个季节均出现,是冬季优势度最高的物种,与TP和TN呈负相关,表明其在低营养盐浓度下也能快速生长,这与Yuan[10]等人的研究结果一致。
4 结论
在这项研究中,共鉴定出51种浮游植物,分属于9门和41属,其中绿藻门占总物种数的35.29%,硅藻门、蓝藻门分别占29.41%和21.57%。夏季浮游植物种类最多,秋季最少。从浮游植物群落季节组成来看,春季丰度最高,秋季丰度最低,春夏季蓝藻门丰度最高,秋冬季硅藻门丰度最高。黄村水库流域优势种尖尾蓝隐藻和曲丝藻在春夏秋冬季节均出现,春季和夏季伪鱼腥藻优势度最高,秋季曲丝藻优势度最高,冬季小环藻优势度最高。Shannon-Wiener指数年平均值为2.84,表明该流域水体处于中营养状态。Pearson相关分析和冗余分析(RDA)显示,温度、电导率和营养盐是影响浮游植物群落组成最主要的环境因素。
