生物降解农药残留的研究进展
2021-07-11赵小明
王 岩,彭 强,赵小明,尹 恒
(1中国科学院大连化学物理研究所天然产物与糖工程课题组,辽宁大连116023;2西北农林科技大学食品科学与工程学院,陕西杨凌712100)
0 引言
中国是一个农业大国,人口众多,粮食安全和食品安全是保障人民生活的头等大事,中国农作物病虫害是限制农业安全生产的主要因素之一。有关农业部资料显示,中国每年平均发生病虫害约1.80亿~1.87亿hm2,对农作物的产量造成了巨大损失,为了解决病虫害造成的农作物减产,农药的使用成为了保障粮食产量的常用的重要手段。农药的使用为农业的发展做出了巨大的贡献,保障了农作物产量大幅度增长。有报道,中国农药的使用量排世界第一,中国设施蔬菜农药平均施用量是全国农药平均使用量的150倍。农药的大量及不合理使用带来了农药残留毒性,严重威胁着中国农产品质量安全和生态环境安全,对人类健康和生存环境造成了严重危害[1]。另外,农药残留使农产品中存在着多种化学农药污染物,对农产品安全造成了严重的威胁。近年来农药污染造成的中毒事件屡有发生,已经成为中国食品安全隐患中最为突出的问题。因此,研究农药残留降解规律是保障食品安全、保障人民身体健康的内在要求。同时研究农药残留降解规律,为科技创新奠定坚实基础,为科学种植提供保障都具有重要指导意义。
降低农产品农药残留有三条途径,一是减少农药使用量,国际上主要在这方面开展研究工作,中国主要在物理技术、栽培及生物农药使用方面开展研究工作。二是降解农药残留,国内外的研究主要集中在土壤及水体等环境保护领域[2-6],蔬菜等农产品中研究相对薄弱。在此领域,研究最多的是农产品收获后降解农产品表面农药,如浸泡清洗、去皮(根)、日光照射、贮藏、吸附等物理方法和臭氧氧化、双氧水降解等化学方法。三是通过农作物本身,加速农药在植物体内的降解,这是一条新的经济有效途径,这方面的研究鲜有报道。
1 降解农药残留的途径
随着农产品中农药残留问题受到越来越多的关注,人们开始科学的使用农药,禁用各种高毒农药,同时也在着手对农药残留的降解。目前农药降解过程中采用的主要方法有:光解反应、化学降解、生物降解。
1.1 光解
光解包括直接光解和间接降解(光敏化降解、光催化降解)。农药的光降解是指农药吸收光子,由稳定态变成激发态,在此过程中会发生化学键的断裂,从而发生光解反应。自然界存在的农药在太阳光的直接照射下就可以发生自然降解,有机磷类农药是最容易被光解的。光解的机理见图1。
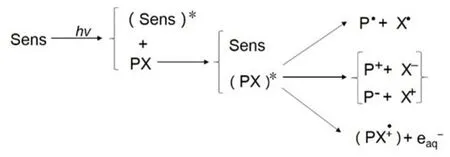
图1 光解机理
光催化降解是农药在光降解的过程中,催化剂不断的自发再生,使得反应不断持续下去,直至所有的反应物都被分解的循环光过程。TiO2作为一种常见的光催化剂,它能够吸收波长小于400 nm的紫外光,在其表面形成羟基自由基-OH,可以加快农药的分解。有研究表明TiO2可显著提高磺草酮的光解速率[7]。TiO2由于晶体结构不同,催化效率也不同,Sojic等[8]发现P25型的催化效率最高。TiO2催化有机磷农药的机理是TiO2在光的作用下,其表面产生电子空穴对,氧气捕获电子形成O2-进而形成H2O2,而空穴氧化H2O2和OH-形成·OH,·OH的强氧化能力能够使P-O键发生断裂。
刘津伶等[9]研究发现在汞灯条件下,灭草隆、阿特拉津、2,4-二氯苯氧乙酸均在60 min内降解率达到99%,异丙隆在120 min内降解率达到99%。光降解在特定的条件下农药的降解效率非常高。还有研究发现在铁离子存在的情况下,农药的光解速率会加快[10]。
1.2 化学降解
化学降解可以对不同的化学官能团采用相对应的化学试剂与其进行反应,从而达到降解农药的目的,主要包括氧化降解和水解。氧化降解研究较多,徐慧等[11]研究发现用臭氧水洗样品处理7 min后,对敌敌畏、甲胺磷、氧乐果、乐果、敌百虫、辛硫磷、氯氰菊酯、溴氰菊酯的降解率分别可达36.6%、41.5%、40.52%、37.1%、40.73%、63%、36.76%和14.2%。臭氧降解农药的机理主要是臭氧溶于水后破坏了农药分子的化学结构中烯炔、炔烃的碳链和化学基团(甲氧基、氨基、硝基)。
水解反应在酸、碱作用下都可发生,因为不同的农药具有不同的结构分子,所以有的农药在酸性条件下水解反应快,有的农药在碱性条件下水解反应快。朴秀英等[12]研究了单嘧磺酯分别在pH 4、pH 7和pH 9条件下的水解率,发现pH 4时水解速率最快。汤涛等[13]研究了异恶唑草酮分别在pH 4、pH 7和pH 9条件下的水解率,发现在pH 9时水解速率最快。
1.3 生物降解
生物降解研究较多的是微生物和植物降解,主要是通过生物产生一些酶类来进行的,断裂某一化学键,把大分子化合物降解为小分子化合物,进而使其失去活性。
1.3.1 微生物降解 张瑞福等[14]分离出一株辛硫磷降解菌,该菌在(pH 7.0,24 h)条件下能够使辛硫磷的降解率达到96%。汤鸣强等[15]发现菌株FDB在(30℃,5天)条件下能够降解69.06%的氰戊菊酯。Bacilluscereus 2D-1菌在(33℃,pH 6.5,8 h)条件下能够使DTTs的降解率达到95.64%,七氯降解菌株Phlebia acanthocystis TMIC34875在(30℃,pH 5.0,1 h)条件下能够使DTTs的降解率达到65%[16]。
微生物降解机理一是微生物产生具有强氧化能力的自由基,攻击农药分子的桥链部分或者功能基团,导致农药分子降解[17],主要有两种:一种是直接作用于农药发生酶促反应,降解农药;另一种是通过改变周围环境而间接影响农药,常见的主要有矿化作用、累积作用、共代谢作用。二是微生物分泌一些解毒酶类通过酶解反应降解农药。这些酶在动物、细菌、真菌中存在,最近研究发现在植物中也存在。有研究发现辣根过氧化物酶和过氧化氢酶也能够对芳香胺类农药进行降解。解毒酶降解农药残留在很多研究中也被证实了。刘绍雄等[18]研究发现农药的降解率随着漆酶的活性增加而增加,并且在培养的第8天达到最高。高熳熳等[19]研究发现有机磷水解酶(OPH)对甲基对硫磷的降解率可达99%;对敌敌畏和喹硫磷的降解率可达82.2%~98.7%;对氧乐果、久效磷和敌百虫的降解率可达28.1%~45.4%。
酶降解农药的研究大都停留在现象阶段,对酶降解农药的机制研究相对较少。Fe和α-酮戊二酸(Fe/αKG)依赖的环氧基烷酸双加氧酶(AADs)被发现能够降解除草剂的有效成分2,4-二氯苯氧乙酸(2,4-D),通过对2,4-D的乙酸酯部分C2位置进行羟基化反应[20],2,4-D在AAD的作用下首先生成一种半缩醛中间体,然后这种半缩醛中间体自发生成2,4-DCP和glyoxylate,下游酶进行环裂解生成最终产物琥珀酸盐,如图2所示。醛酮还原酶Aldo-keto Reductase(AKR)能够降解代谢植物中的草甘膦,大肠埃氏酵母表达的EcAKR4-1可以通过裂解草甘膦的C-N键将草甘膦转化为氨基甲基膦酸(AMPA)和乙醛酸,研究发现EcAKR4-1在25℃或35℃下处理5 h或7 h能够催化草甘膦全部转化为毒性小的化合物AMPA和乙醛酸,乙醛酸在其他氨基转移酶作用下进而转化为甘氨酸[21]。EcAKR4-1作为双氧化酶/还原酶在循环中催化草甘膦氧化和肉桂醛还原,使用相同的NADP分子作为电子的受体和供体。EcAKR4-1通过NADP+作为辅助因子将草甘膦氧化为AMPA和乙醛酸,同时肉桂醛被还原为肉桂醇,从而再生NADP+。由草甘膦氧化产生的乙醛酸进一步通过转氨酶与L-Glu氧化成2-氧戊二酸酯的方式转化为Gly,如图3所示。

图2 AAD催化2,4-D降解的机理

图3 EcAKR4-1降解草甘膦的机理
有报道在含有芳氧基链烷酸酯双加氧酶(aryloxy alkanoate dioxygenase,AAD)的转基因作物中,作物表现出了高水平的2,4-D除草剂耐受性。
农药降解的方法各有优缺点,表1中总结了各方法的优点和缺点。

表1 农药降解方法及其优缺点
1.3.2 植物降解 农药植物在应对外源化学物质时,进化形成了一套解毒机制能够转化、分解残留在作物表面或体内的农药等外源化学物质。迄今为止,大多的研究集中在植物对除草剂的代谢与抗性关系上,已有研究表明,除草剂等农药在植物体内主要的代谢过程包括4个阶段,成为四相代谢[22-26]。Ⅰ相代谢,通过包括细胞色素P450等酶促反应或非酶过程经氧化、还原、水解等反应使其成为易溶于水、毒性低的产物,极性增强、对植物毒性降低;而代谢作用的主要生物化学反应是Ⅱ相代谢,主要是谷胱甘肽-S-转移酶(GST)与尿苷二磷酸糖基转移酶等作用下的轭合过程,农药代谢产物与糖、氨基酸或谷胱甘肽(GSH)进行轭合作用,形成高度水溶性、对植物毒性显著下降或无毒、移动性低的代谢产物,并贮存于细胞器中;Ⅲ相代谢主要是将相代谢产物进一步转变为次生缀合物并转运到细胞质外或质外体,进入下一步的解毒过程即阶段Ⅳ,Ⅳ相代谢指转运到质外体的共轭物与细胞壁表面的物质如木质素结合[27],作为残渣在细胞壁沉积或在液泡中的共轭物通过水解反应进一步加工,随后重新进入细胞质进行再代谢[28],使其对植物的毒性完全丧失。其过程如图4所示。
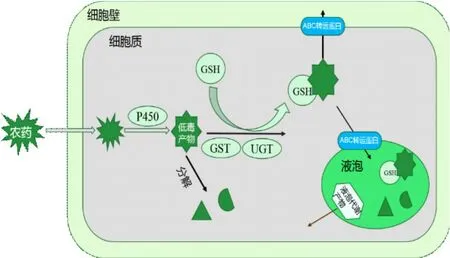
图4 植物体内农药的降解代谢
植物体内的细胞色素P450与植物自身解毒有密切的关系[29-30],P450催化的反应过程分为两步:电子由NADPH/NADH传至黄素蛋白及铁硫蛋白或NADPH依赖的细胞色素P450还原酶,然后再传递至细胞色素P450氧化酶。细胞色素P450的过表达可以提高对除草剂的抗性[31]。研究发现许多植物中的CYP71A11、CYP71AH11、CYP81B1、CYP81B2、CYP73A1 和CYP76B1与绿麦隆的代谢有关。研究还发现了细胞色素调控的除草剂苯基脲的代谢基因,CYP81B2和CYP71A11分别通过环甲基羟基化作用和N-脱甲基化作用催化绿麦隆的代谢。GSH在植物细胞解毒和氧化还原状态方面发挥着重要的作用,可以保护细胞免受活性氧和自由基伤害,以及对亲电子化合物进行解毒代谢。谷胱甘肽过氧化物酶(GPX)是GSH解毒过程的重要酶,主要解毒功能在于将H2O2还原为H2O,使超氧自由基通过中间体H2O2介导生成高活性的膜过氧化剂羟基自由基这个链被打断,从而保护细胞免受氧自由基的伤害。GST也是GSH解毒过程中的重要酶,其解毒功能在于其能够催化还原型的谷胱甘肽与细胞内的多种亲电子基团进行轭合反应。GST催化的GSH轭合反应参与植物体对外源有毒物质的解毒过程,霜霉威处理黄瓜,黄瓜的GST活性明显提高[32]。ABC转运蛋白位于液泡膜,参与细胞内毒素的转运隔离的膜转运蛋白家族,并存在于所有原核和真核生物物种中。在植物基因组中ABCC/MRP家族被认为在GSH轭合物和许多两性大分子跨膜转运中起着重要作用[33]。研究发现GSH的轭合产物在被转运到植物液泡的过程中,激发了液泡膜上ABC转运蛋白。
2 外源物质提高植物降解农药残留的主要机制
近年来,世界各地针对降低农药残留的问题,在如何减少农药施用量以及农药残留降解方面展开了众多的研究,其中微生物降解中农药降解菌的筛选研究最多,但是针对如何促进植物体内的农药降解的研究报道较少。农药残留的减少涉及代谢调节[34]。外源活性物质能够诱导植物的解毒力,加速农药在植物体内的降解代谢。农药安全剂具有加速植物自身对农药在体内的代谢,油菜素内酯(BRs)能够促进植物体内农药的代谢,褪黑素(Mel)能够减轻农药对植物的毒害并促进农药代谢。
2.1 安全剂促进农药降解代谢机制
安全剂是一类能够保护作物免受除草剂伤害,同时又不降低除草剂对杂草活性的化合物[35],其作用机理[36]大致为3方面:(1)安全剂阻碍除草剂的吸收与传导;(2)安全剂与除草剂受体和靶标位点之间的竞争;(3)安全剂影响除草剂靶标酶和解毒酶的活性。大多数的研究表明,安全剂的作用机制是通过促进作物体内多种作用相互结合来实现的,其中包括谷胱甘肽轭合作用和羟基化作用[37]。陶波等[38]通过研究发现安全剂AD-67能够提高水稻幼苗超氧化物歧化酶(SOD)、过氧化物酶(POD)、硝酸还原酶(NR)、谷胱甘肽S-转移酶(GST)的活性。Brazler-Hicks等[39]研究发现安全剂解草啶(Fenclorin)可以通过增强水稻中GST的表达进而提高其对氯乙酰苯胺除草剂的耐受力。除了上调GST的表达,安全剂同时也会通过提高GSH的含量来帮助植物自身加速对除草剂在体内的代谢[40]。安全剂能够提高GST酶的活性和GSH的含量,从而加快除草剂与GSH的轭合作用,加速了除草剂在作物体内的降解代谢。
2.2 油菜素内酯促进农药降解代谢机制
油菜素内酯,是一种新型植物内源激素,具有高效、光谱、无毒特性。BRs可以增强植物对逆境的抵抗力。BRs预处理能有效降低除草剂对作物的伤害,喷施BRs能环节除草剂、杀菌剂和杀虫剂的药害[41]。进一步的研究发现,BRs具有类似农药安全剂的作用,能够减轻丁草胺、丙草胺等农药对水稻的毒害[42]。BRs对植物胁迫响应的调节依赖于H2O2信号[43],许多芯片数据结果表明BR能够调控水稻和拟南芥上P450、GST、UGT等解毒基因的表达,这些基因的上调增加了H2O2的积累[44]。研究发现经过BRs处理后,番茄、水稻、茶叶、西兰花、黄瓜、草莓中有机磷、有机氯、氨基甲酸酯类农药残留减少了30%~70%,表明BRs能够促进植物体内农药的降解[45]。番茄预处理BRs后,GSH含量增加,POD、GST、GR酶活性提高,同时显著提高了CYP724B2、GSH1、GSH2、GST1、GST2、GST3、GR、ABC的表达。实验还发现酶活方面在BRs浓度为0.02 μmol/L时,GST、GR的酶活力最高。但当浓度为1 μmol/L时,GR活力恢复到对照水平。基因表达方面在浓度为0.02 μmol/L时,GST1、GST3、CYP724B2表达量最高,并且都是在低浓度时具有强烈的诱导作用,高浓度时产生了一定程度的抑制。BRs能够诱导RBOH基因的表达,进而调控NADPH氧化酶产生H2O2信号,在此过程中超氧化物歧化酶活性提高促进H2O2信号的产生,H2O2信号进一步激活了植物体解毒代谢相关基因(谷胱甘肽合成酶的基因、谷胱甘肽还原酶的基因、谷胱甘肽S-转移酶的基因、膜转运蛋白的基因)的表达以及相关解毒酶(POD、GST、GR)活力的提高,提高了还原型谷胱甘肽与氧化型谷胱甘肽的比值,从而促进农药在植物体内的降解代谢,如图5所示。

图5 油菜素内酯提高植物体农药降解的机理
2.3 褪黑素促进农药降解代谢机制
褪黑素在植物和动物中是一种有效的抗压力因子。在动物中,Mel能够通过参与抗坏血酸-谷胱甘肽循环和谷胱甘肽S-转移酶活性来减少药物对动物的毒害作用[46-47]。在植物中,Mel能够提高光合作用、碳氮代谢。Mel对应激源的作用主要是清除活性氧和增强了抗氧化系统,包括酶和非酶过程[48-49]。研究发现,Mel的一些生物合成基因的过表达提高了拟南芥、水稻和茄属植物的抗逆性[50-52]。研究发现外源Mel有减轻番茄和其他一些蔬菜中农药的毒性和残留能力,番茄施用Mel后,多菌灵的残留量在不同时间内降低了48%~73%。此外在对大白菜、菠菜、芹菜、黄瓜、甜瓜的实验中也发现施用Mel后,多菌灵的残留量下降了49%~54%[53]。实验表明施用0.5 μmol/L褪黑素时,农药的残留率最低,同时各项指标最好,抗氧化酶、解毒酶活性显著变化,相对应的酶系基因的表达量也显著变化。Mel能够降低农药残留水平和降低农药对植物的毒害主要是通过提高了抗氧化酶活性,激活了抗坏血酸-谷胱甘肽循环,参与了谷胱甘肽S-转移酶介导的农药解毒。Mel提高了抗氧化机制的效率通过刺激一系列抗氧化酶的活性;激活抗坏血酸-谷胱甘肽循环主要是通过改变抗坏血酸(ASA)、单脱氢抗坏血酸(MDHA)和脱氢抗坏血酸(DHA)三者之间的转化关系以及GSH与GSSG之间的转化;参与了谷胱甘肽S-转移酶介导的农药解毒主要是提高了GST的活性从而提高了解毒效率。其机理如图6所示。

图6 褪黑色素促进植物中农药残留降解的过程
近几年研究表明寡糖作为一种植物抗性诱导剂,能够促进植物生长、提高植物的抗病性和抗逆性。据报道,寡糖能够诱导植物体内活性氧的产生以及激发抗性相关基因的表达[54]。寡糖能够激发过氧化物酶、过氧化氢酶、超氧化物歧化酶活性提高[55-56]。孙敏秀等[57]研究发现黄瓜植株喷施100 μg/mL的琼胶寡糖可以提高相关抗氧化酶的活性,上调几丁质酶与病程相关蛋白1基因的表达,并且显著降低了68.29%的啶虫脒残留。壳寡糖对植物体内的GST等解毒酶系基因具有上调作用,结果见表2[58],这些结果显示寡糖可能具有降解农药残留的效果。

表2 壳寡糖上调的作物体内解毒酶基因
3 展望
随着人们对食品安全及环境安全的重视,化学农药的使用量及农残的降低是现代农业的必然趋势,中国提出的到2020年实现化肥和农药使用量零增长目标,并已启动在农业上减施化肥农药的双减科研项目,相信会研究出一系列减施化学农药的技术,但由于中国以前使用农药的量比较大,目前生产上对病虫害防治主要是利用化学农药,农药在农产品上残留不容忽视,利用安全的生物性外源物质提高植物本身降解农药残留技术有重要的实践意义。本文对农药降解的方法、植物自身的解毒途径以及外源物质如何促进植物体农药降解的机理进行了综述,展望了寡糖可能降低农药残留的作用及机理。然而,通过调控植物体本身的解毒系统加速农药降解的研究还是比较有限,其中还有许多科学问题需要进一步的研究。如:
(1)外源化合物在进入植物体后,会因为其含有不同活性的化学结构基团,而被植物体内不同催化活性的靶酶识别。轭合物被运输至液泡内区后,否被液泡内的其他酶类所进一步代谢成更加安全的小分子化合物,因此需要借助更加先进的化学手段去分离和鉴定其代谢产物。
(2)关于GSH如何调控信号转导机制还不明确,可能与信号元件蛋白的谷胱甘肽化和S-亚硝基化有关,还有待于在蛋白等水平上进行深入研究。
(3)寡糖具有降解农药残留的效果,但目前对寡糖提高植物降解农药残留地机制研究较少。需要从整体植株水平出发,从转录调控、蛋白表达、代谢物变化等多角度进行研究。
