不同捕食者暴露对鲫幼鱼行为、运动和形态特征的影响
2021-07-09肖玲韬赵昕雨黄恩梅徐佳佳付世建
付 成,肖玲韬,赵昕雨,黄恩梅,徐佳佳,王 亚,付世建
重庆师范大学 进化生理与行为学实验室 重庆市动物生物学重点实验室,重庆 401331
捕食作为一种重要的自然选择压力,可能导致猎物在行为和生理功能等方面产生表型和(或)遗传层次的改变,因此一直备受关注[1- 3]。已有研究发现,相比直接致命性的捕食,捕食者对猎物所产生的风险效应通常对猎物种群的影响更为显著[1]。猎物应对被捕食风险所做出的行为以及生理功能等方面的调整可以称之为猎物的“反捕食响应”,反捕食响应通常可以有效提高猎物在捕食胁迫下的生存机率[4-5]。
就鱼类而言,其反捕食响应多种多样,例如在被捕食风险较高时,有些鱼类会降低自发运动[6]、减少觅食行为[7]和冒险行为[7],降低勇敢性[8]以及提高隐蔽场所利用率[9],因为这些行为的调整都有利于降低猎物鱼被捕食者发现的机率;在运动能力方面,研究者发现无论是自然生境中长期的捕食压力[10],还是实验室内短期的捕食胁迫处理[5]均可提高猎物鱼的快速启动逃逸能力,较强的快速启动逃逸能力可以保证猎物鱼在被捕食者发现或袭击时能顺利逃脱[11-12]。此外,在形态上部分鱼类会通过增加体高的方式对捕食者形成口裂限制[13],体高的提高也会间接导致鱼类快速启动逃逸能力的提升[11],因此对于鱼类逃避捕食者十分关键。尽管关于鱼类反捕食响应的研究较多,但大多数研究仅集中于某一种反捕食方式,该领域仍缺乏多种反捕食策略的整合性研究,使得我们对鱼类反捕食响应的理解依旧有限。因为鱼类应对捕食胁迫可能是利用多种反捕食策略的综合,以此获得最大的反捕食效果;也可能是当某种或数种反捕食策略足以确保安全时,放弃其他方式的反捕食策略,因为大多数的反捕食响应都是有代价的。例如提高隐蔽场所利用率虽然可以确保安全,但也同时使猎物丧失了获取食物、配偶的机会[14]。
自然水体中鱼类的捕食者种类繁多,这些捕食者从形态特征(如口裂的大小)到捕食方式(如追击或伏击取食),再到觅食频率等均存在着较大的差异[15- 17]。不同类型的捕食者(或者不同类型的捕食者同时出现)给猎物鱼所带来捕食胁迫的程度及其影响方式可能是截然不同的,那么猎物鱼针对这些不同的捕食胁迫是否会做出相异的策略选择呢?组合多种反捕食策略以最大化生存,还是仅维持少数的反捕食策略以保证生长呢?
鲫(Carassiusauratus)属鲤科鱼类,身体呈梭形,体高较高,适应能力强,在我国分布范围极为广泛,以往研究发现其对环境变化具备较高的生理可塑性[18-19]。有研究认为,其能够如此广泛的分布于我国各大水系,可能与其较强的反捕食能力有一定关联[20]。因此本研究选取鲫幼鱼作为猎物鱼。乌鳢(Channaargus)和胡子鲶(Clariasfuscus)这两种鱼类捕食者与鲫的栖息地有较多重叠,为鲫幼鱼在自然界中常见的捕食者[21-22]。这两种捕食者在形态特征及捕食习性等方面存在较大差异:乌鳢为鲈形目,口裂很大,常静待猎物靠近时突然发动袭击[15];胡子鲶为鲇形目,口裂较小,觅食行为活跃,频繁尾随和追击猎物,待接近猎物时发动袭击[21, 23]。本研究选择鲫幼鱼为猎物鱼,乌鳢和胡子鲶为捕食者,将鲫幼鱼分别暴露于空白(对照)、乌鳢、胡子鲶和双捕食者(同时存在乌鳢和胡子鲶)环境中持续2个月,随后通过考查和对比不同组鲫幼鱼的生长、行为特征、形态和运动能力等指标来探讨鲫幼鱼是否会针对不同的捕食者做出截然不同的反捕食策略选择。
1 材料与方法
1.1 实验鱼来源与驯养
实验用鲫幼鱼、乌鳢和胡子鲶购置于当地渔场,分别放入本实验室规格为2m×1m×0.5m的水槽内驯养一个月。驯养期间,每天上午9:00,鲫幼鱼以商业颗粒饲料饱足投喂一次,乌鳢和胡子鲶每隔两天投喂一次鲢鱼肉片搭配商业饵料至饱足。所有实验鱼均在每次投喂30min后使用虹吸管将未被吃完的食物以及粪便清理干净。实验用水为曝气除氯后的自来水,日换水量约为水槽总水体体积的20%,驯化温度为(20.0±1)℃。用充气泵不断向水体充入空气使其溶氧量接近饱和,自然光周期(正式实验于8—11月完成)。
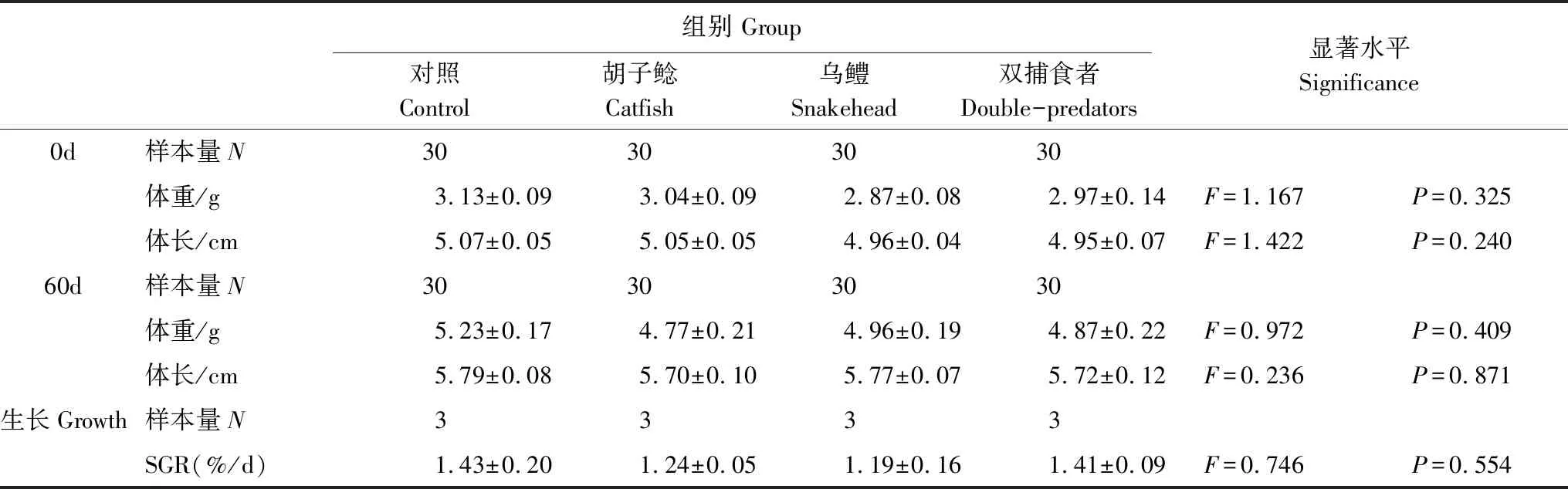
表1 不同捕食者暴露对鲫幼鱼生长的影响 (Mean±SE)
1.2 实验设计
驯养结束后,挑选身体健康、大小接近的鲫幼鱼随机分成四组(表1),即一个对照组和胡子鲶暴露组、乌鳢暴露组、双捕食者(乌鳢和胡子鲶同时存在)暴露组三个捕食者处理组,每组30尾,分别放入规格相同的水槽(图1;1m×0.6m×0.5m)中饲养,每个水槽10尾鲫幼鱼。水槽内水深约30cm,光照强度约300lx。挑选大小接近的胡子鲇(200—300g;口裂宽1.5—2.0cm;口裂深0.5—1cm)和乌鳢(200—300g;口裂宽3—3.8cm;口裂深2.8—3.7cm)作为捕食者,分别加入对应的捕食处理组的水槽之中(N=2,双捕食者暴露组中为1尾胡子鲶和1尾乌鳢),但将捕食者与鲫幼鱼用铁丝网分隔开,并在捕食者的一侧(铁丝网外侧)投放数尾不用于实验测定的鲫幼鱼作为饵料鱼,使得铁丝网内侧的鲫幼鱼虽然不会被捕食,但可以通过视觉和嗅觉的方式感受捕食信息。对照组铁丝网外侧不放置捕食者,其它环境条件与处理组完全相同。另外每个水槽中鲫幼鱼一侧均放置有一不透明的PVC管(长20cm,直径10cm),用以给鲫幼鱼提供隐蔽场所。处理期间其他养殖条件与驯养期间保持一致,连续处理60d后,测定鲫幼鱼的体重、体长(表1)。随后挑选身体健康、大小接近的鲫幼鱼分别进行行为、快速启动游泳能力、临界游泳速度和形态的测定(表2)。

表2 不同实验测定(行为、快速启动游泳能力、临界游泳速度和形态)中所使用鲫幼鱼的样本量、体重和体长 (Mean±SE)

图1 捕食者暴露处理水槽示意图(俯视)Fig.1 A experimental tank was used for predator exposure (top view)图中A为铁丝网;B为隐蔽场所(不透明PVC管;长度20 cm,直径10 cm);C为不用于实验测定的饵料鱼;根据组别的不同,铁丝网外侧分别饲养不同的捕食者;对照组:无捕食者;胡子鲶暴露组:两尾胡子鲇;乌鳢暴露组:两尾乌鳢;双捕食者暴露组:一尾胡子鲇和一尾乌鳢
1.3 实验参数的测定
1.3.1生长能力的测定
鲫幼鱼分组完成后开始生长实验。每天上午9:00,鲫幼鱼以商业颗粒饲料饱足投喂一次,乌鳢和胡子鲶每隔两天投喂一次鲢鱼肉片搭配商业饵料至饱足。分别在第0d和第60d测定4组鲫幼鱼的体重、体长用以计算生长能力(表1)。称重前,实验鱼禁食24h。生长能力使用下列公式进行计算:特殊生长率(special growth rate, SGR; %/d)=(lnM2-lnM1)/T×100。式中M1和M2分别为第0d和第60d每个水槽中10尾实验鱼体重的平均值(g);T为生长时间60d。
1.3.2行为特征的测定
鲫幼鱼禁食24h后,首先进行自发运动的测定。将单尾实验鱼转移至圆形的行为观察装置[14](120 L)中驯化1h。观察装置水深12 cm,用以降低实验鱼的垂直移动[24],装置正上方安装有摄像头(罗技,Pro 9000),用于实验鱼的行为拍摄。1h后对实验鱼进行20 min的自发运动拍摄。所有的视频均使用行为学软件EthoVision(EthoVision XT 9,荷兰Nodus公司)进行分析。分析过程中,使用“zones”工具将圆形的观察水面(直径38 cm)划分为两个不同的区域:中间的圆形区域(直径26 cm)和周围的环形区域(宽度6 cm,约1倍实验鱼体长)。中间的圆形区域作为开放水体定义为风险区域,周围的环形区域靠近观察装置的侧壁,可能会给实验鱼提供隐蔽[9],因此本研究中将其定义为安全区域[14]。自发运动评价指标包括:实验鱼在风险区域停留时间百分比(%),风险区域停留频次百分比(%),运动时间比(实验鱼处于运动状态的累计时间占总时间的百分比,%)和平均游泳速度(cm/s)。
自发运动测定完成后,在观察装置中放入一根PVC管(与驯化期间规格相同)作为隐蔽场所。2min后对实验鱼进行20 min的隐匿行为拍摄。所有的视频均使用行为学软件EthoVision进行分析。实验鱼在隐蔽场所中停留的累计时间百分比即为隐蔽场所利用率(%)。
鲫幼鱼的隐匿行为测定完成后,将单尾实验鱼转移至勇敢性测定装置[14]中进行勇敢性的测定。测定装置(60 cm × 20 cm × 20 cm)由透明的有机玻璃构成。四周贴有不透明的白纸用以降低外界对实验鱼的干扰。由一块带有小门的白板将整个区域分为隐蔽场所(上方有盖板,可提供隐蔽;20 cm × 20 cm × 20 cm)和开放水域(40 cm × 20 cm × 20 cm),小门为实验鱼进出隐蔽场所的通道。水深保持在12 cm。将单尾实验鱼转移置至开放区域中适应1h,1h后轻轻拉开小门,随后将一个小型抄网快速下坠至开放水域中(模拟一次捕食者袭击),将实验鱼赶入隐蔽场所之中,随后使用连接电脑的摄像头纪录实验鱼首次从隐蔽场所游出的时间[20, 25]。实验鱼遭遇一次捕食者袭击(模拟)后首次从安全的隐蔽场所游出进入开放环境的时间即勇敢性(s)[25]。
1.3.3快速启动游泳能力的测定
实验鱼禁食24h后,采用实验室自行研制的快速启动测定系统对实验鱼进行快速启动游泳能力的测定[26]。将一小颗白色的泡沫球(直径约1mm,质量< 0.001g)用少量胶粘附在实验鱼背部的质心位置。随后将实验鱼转移至快速启动测定水槽(40 × 40 × 15 cm)中进行1h的恢复和适应。测定水槽水深10cm,水槽底部为刻有方形网格的白色有机玻璃板,用于后续图像分析过程中的距离校正。水槽四周不透明,用以减少外界对实验鱼的干扰。适应结束后待实验鱼游至水槽中央时,打开高速相机(A504K,德国Basler公司;500帧/s),同时给予实验鱼一次电刺激(电场强度0.55 V/cm,持续时间50 ms)[27],电刺激装置连接有发光二极管作为指示灯。高速相机纪录下电刺激引起的实验鱼逃逸反应的全过程,拍摄的序列照片随后使用TpsUtil和TpsDig软件来分析整个逃逸过程中实验鱼质心的移动轨迹。实验鱼质心的原始轨迹进行5点3次平滑化处理[2]。后续快速启动参数计算:最大线速度(Vmax, m/s), 最大线加速度(Amax,m/s2),120ms内的移动距离(S120 ms,cm)和反应时滞(T,ms)。其中Vmax和Amax分别为实验鱼逃逸过程中质心移动的最大线性速度和加速度。S120 ms为实验鱼逃逸过程中电刺激开始后前120ms实验鱼质心的移动总路程。参数T是实验鱼从电刺激开始(LED灯亮)到逃逸反应开始的时间间隔[28]。
雪萤一怔:“江老师这不是带给你了吗?”狗子说:“他今天才给我的。以前那么久,他都没给我。你一定是才买的。”雪萤哭笑不得,说:“是是是,阿姨太忙,忘了,对不起。”
1.3.4临界游泳速度和代谢率的测定
将实验鱼禁食24h后转移至实验室自行研制的Blazka式游泳代谢测定仪[29]中进行临界游泳速度Ucrit和代谢率的测定,仪器的原理结构详见已发表论文[26]。实验鱼转移至游泳管之后进行2 h 的适应,适应期间游泳管密封盖打开用于换水,水流速度为6 cm/s。适应结束后,以6 cm/s作为起始流速,每隔20 min 水流速度增加6 cm/s,直至实验鱼力竭。随后取出实验鱼测量体重、体长。实验鱼力竭的判断标准为实验鱼不能在游泳管中保持位置而被冲到筛板上持续20 s[30]。Ucrit的计算使用以下公式[31]:
Ucrit=V+(t/T)ΔV
其中V是实验鱼完整游完的最大速度(力竭前一档速度,cm/s);ΔV为每一档的水流速度增量(6 cm/s);T是每一档的设定游泳时间(20 min);t是实验鱼在最大速度档(最后一档)的实际游泳时间(min)。
游泳管分开放和封闭两种模式,开放模式用于换水,封闭模式用于测定实验鱼的代谢率。封闭模式状态下,每2 min纪录一次管中溶氧水平,用于计算实验鱼的代谢率,计算公式如下[32]:
Mo2=60(St-S0)v/m
其中Mo2为实验鱼的运动代谢率(mgO2kg-1h-1);St和S0(斜率,mgO2L-1min-1)分别为游泳管内有鱼和无鱼时溶氧水平的下降率(用以扣除细菌耗氧),通过氧含量(mg/L)与时间(min)的线性回归计算而来;v是游泳管的总体积(3L);m为实验鱼的体重(kg)。测定过程中的最大Mo2定义为活跃代谢率MO2active,作为实验鱼代谢能力的指标。
1.3.5形态的测定
从每组中分别选取13尾大小接近的实验鱼,使用过量MS- 222麻醉致死,随后测量相关形态学参数(表3)。测定时将实验鱼的背鳍、尾鳍、臀鳍等依次展开后固定在放有刻度尺的泡沫板上,采用数码相机拍摄左侧照片[33]。参照闫冠杰等人[33-34]的形态学分析方法,使用TpsDig2软件对实验鱼照片进行处理,得到包含16个特征点的图像。通过上述每尾实验鱼16个特征点的坐标计算相关形态学参数,包括叉长、腹鳍前长、头长、头高、体高、尾柄高1和尾柄高2。另外通过TpsDig 2软件计算尾柄侧面积和尾鳍表面积。上述参数的单位均通过图像距离与实际距离(从照片中的刻度尺获得)之间的转换关系换算为mm或mm2。

表3 不同捕食者暴露对鲫幼鱼形态特征的影响
1.4 数据统计与分析
实验数据采用Excel 2016进行常规计算,使用统计学软件SPSS 17.0进行统计分析。不同组之间生长、行为、游泳能力和形态参数之间的差异使用单因素方差分析。所有数据均以平均值±标准误(Mean±SE)表示,显著性水平为P<0.05。
2 结果
2.1 不同捕食者暴露对鲫幼鱼生长的影响
经过60d的生长,相比初始值,所有组实验鱼的体重、体长均显著提高(P<0.05;表1)。然而无论是在捕食暴露前、后,相比对照组,三个捕食者暴露组的鲫幼鱼的体重、体长均未表现出显著差异(表1)。此外,不同组之间生长能力SGR也未表现出显著差异(F=0.746,P=0.554;表1)。
2.2 不同捕食者暴露对鲫幼鱼形态的影响
经过60d的捕食者暴露,乌鳢暴露组的鲫幼鱼体高(BD)显著高于对照组(P<0.001)和鲶鱼暴露组(P<0.001),但与双捕食者暴露组无显著差异(P=0.561;表3)。其他所有形态学参数在捕食暴露组与对照组之间均未表现出显著性差异(表3)。
2.3 不同捕食者暴露对鲫幼鱼行为特征的影响
经过60d的捕食者暴露,鲫幼鱼自发运动的四个指标,风险区域停留时间百分比(F=0.512,P=0.676)、风险区域停留频次百分比(F=0.747,P=0.529)、运动时间比(F=1.119,P=0.348)和平均速度(F=1.034,P=0.384)在四个组之间均未表现出显著性差异(图2)。

图2 不同捕食者暴露对鲫幼鱼自发运动的影响Fig.2 The effects of different predator exposure on spontaneous activity in juvenile crucian carp
此外,鲫幼鱼的隐蔽场所利用率(F=1.083,P=0.363)以及勇敢性(F=0.851,P=0.473)在四个组之间同样未表现出显著性差异(图3)。

图3 不同捕食者暴露对鲫幼鱼隐蔽场所利用率和勇敢性的影响Fig.3 The effects of different predator exposure on percent time spent in shelter and boldness in juvenile crucian carp
2.4 不同捕食者暴露对鲫幼鱼快速启动游泳能力的影响
经过捕食者暴露,鲫幼鱼的快速启动最大速度(F=1.415,P=0.253)和最大加速度(F=0.647,P=0.590)在四个组之间未表现出显著差异(图4);而快速启动120ms移动距离乌鳢暴露组显著高于对照组(P=0.016;图4);另外反应时滞胡子鲶暴露组(P=0.047)、乌鳢暴露组(P=0.035)和双捕食者暴露组(P=0.023)均显著低于对照组(图4)。

图4 不同捕食者暴露对鲫幼鱼快速启动游泳能力的影响Fig.4 The effects of different predator exposure on fast-start swimming performance in juvenile crucian carp
2.5 不同捕食者暴露对鲫幼鱼临界游泳速度的影响
经过60d的捕食者暴露,鲫幼鱼的临界游泳速度(F=0.280,P=0.840)和活跃代谢率(F=1.269,P=0.302)在四个组之间均未表现出显著差异(图5)。

图5 不同捕食者暴露对鲫幼鱼临界游泳速度和活跃代谢率的影响Fig.5 The effects of different predator exposure on critical swimming speed and active metabolic rate in juvenile crucian carp
3 讨论
3.1 不同捕食者暴露对鲫幼鱼行为特征的影响
鱼类的行为特征中自发运动、隐蔽场所利用率以及勇敢性等均与其逃避捕食者密切相关[14]。鱼类的自发运动越低,其在水中留下的化学以及水动力学的信号就越少,那么其被捕食者发现的概率就越低[35]。此外,较低的自发运动也能降低猎物鱼与捕食者直接相遇的几率。因此多数研究者认为,在有捕食胁迫的情况下鱼类可能会降低其自发运动[7, 36-37]。另外增加隐蔽场所的使用,以及降低勇敢性同样使得猎物鱼更难被捕食者发现,而隐蔽场所的使用使得猎物鱼即使被捕食者发现,仍能藏身于隐蔽场所内拒止大型的捕食者[9, 37]。
然而,在本研究中,鲫幼鱼自发运动的4个指标在不同组之间均未表现出显著性差异。另外,不同组鲫幼鱼的隐蔽场所利用率以及勇敢性也未表现出显著性差异。这可能像本研究之前预期的那样,当一种或几种反捕食策略足够应对捕食胁迫时,其他的反捕食策略可能会趋于保守,因为绝大多数的反捕食策略都是有代价的[38-39]。相比运动能力与形态,鱼类反捕食行为的代价可能更为严重:降低自发运动、提高隐蔽场所利用率以及降低勇敢性均会使其获取食物、占有领地的几率大大降低[14],这对其长期生存是非常不利的。此外,在本研究中,捕食者与猎物鱼是通过铁丝网隔开的,捕食者对鲫幼鱼而言并非致命性的威胁,可能正是因为这个原因,鲫幼鱼的反捕食行为未出现显著变化。对应的,经过2个月的处理,不同组之间鲫幼鱼的体重、体长和SGR均未表现出显著性差异也进一步佐证了这一点。
3.2 不同捕食者暴露对鲫幼鱼形态和运动能力的影响
鱼类的形态特征与运动能力密切关联[12, 40]。例如较高的身体高度,较大的尾鳍面积有利于鱼类在运动过程中产生更大的推进力,进而提高快速启动逃逸能力[2, 41]。本研究中,经过2个月的处理,与对照组相比,仅乌鳢暴露组的鲫幼鱼体高表现出显著性提高。在运动能力方面,与对照组相比,鲫幼鱼快速启动参数中S120ms仅乌鳢暴露组显著提高,这与形态学的变化基本上是一致的,进一步证明了鱼类形态与运动能力之间的紧密关系:提高的体高有利于提高鱼类的快速启动逃逸能力。此外提高的体高也使猎物鱼更容易对捕食者形成口裂限制[42],这些运动能力与形态特征的变化均有利于猎物鱼提高生存几率[43]。另外,相比对照组,胡子鲶暴露组、乌鳢暴露组和双捕食者暴露组实验鱼的快速启动T均显著缩短。这种在捕食胁迫下缩短快速启动T的策略在近期研究中已有发现[26, 44-45],本研究进一步证实了T对捕食胁迫的高敏感性。尽管这种策略对于猎物逃避捕食非常关键[26, 44],但T在捕食胁迫下缩短的内在机理仍有待于进一步研究。
本研究对鲫幼鱼的Ucrit和MO2active也进行了测定,旨在验证鱼类的临界游泳能力对于其逃避捕食者是否同样较为关键[45],尤其是在应对捕食者连续尾随和追击的情况下是否更为重要。然而本研究发现相比对照组,三个捕食者暴露组的Ucrit和MO2active均未表现出显著差异。这也表明:至少对于胡子鲶和乌鳢,在应对这两种捕食者胁迫时快速启动游泳能力依然扮演着更为重要的角色。
3.3 不同捕食者暴露与多捕食者效应对鲫幼鱼的整体影响
在自然界中,动物的捕食者多种多样,因此动物常常需要分别或同时应对不同捕食者所带来的风险[46-47]。对此,猎物鱼所做出的反捕食响应可能是截然不同的[48]。这一观点在蝌蚪(Ranatemporaria)[49]、蜻蜓(Pachydiplaxlongipennis)幼虫[50]、沙鼠(Gerbillusandersoni)[51]和淡水蜗牛(Physagyrina;Physaheterostropha)[46]等动物中已得到验证,但鱼类的相关研究非常有限。本研究中,相比胡子鲶,鲫幼鱼对乌鳢暴露的反应更为敏感,可能由于相比胡子鲶,乌鳢口裂更大,对鲫幼鱼的威胁更为严重。胡子鲶虽然觅食行为非常活跃,但其口裂较小,而鲫自身体高较高。在本研究中鲫的体高与胡子鲇口裂非常接近,因此胡子鲶对其胁迫相对有限[2]。可见,本研究中鲫幼鱼针对不同捕食者做出不同的反捕食响应。另外值得注意的是,综合鲫幼鱼的多种反捕食策略,该种鱼的确存在仅体现形态和快速启动逃逸能力的可塑性响应以确保安全,而放弃反捕食行为以保障生长的现象,这种现象从长远看对于其提高生存适合度是有帮助的。因为对于鱼类而已,通过持续生长获得的更大的体型会使其在应对种内、种间竞争,以及各种环境胁迫(包括捕食胁迫)时更为有利[52- 54]。
有研究者认为,当多种捕食胁迫同时存在时,多重捕食者对猎物带来的风险效应可能有以下4种:(1)重叠(Additive,捕食者A与B同时存在时的风险与A或B单独存在时相同)、(2)风险增强(Risk enhancement,捕食者A和B同时存在时的风险大于A或B单独存在的情况)、(3)风险削弱(Risk reduction,捕食者A和B同时存在时风险小于A或B单独存在的情况)、(4)替换(Substitutable,捕食者A+A与捕食者B+B、捕食者A+B的风险相同)[17]。本研究中,双捕食者暴露组所体现的风险效应甚至低于乌鳢暴露组,如果参照上述观点,本研究中的多捕食者效应体现为第三种情况:风险削弱。这可能是由于胡子鲶和乌鳢相互干扰所致。这两种捕食者大小接近,均不能吃掉对方,但在实验过程中经常可以观察到两种鱼之间的相互追逐,这就反而降低了两种捕食者对鲫幼鱼的捕食胁迫。
综上所述,本研究中鲫幼鱼表现出对乌鳢的反应最为明显,可能与乌鳢口裂较大,给鲫幼鱼带来的威胁更大有关。另外,应对捕食胁迫,鲫幼鱼仅在形态和快速启动逃逸能力上表现出反捕食响应,其反捕食行为的丧失可能是对生长的妥协,这对于其适应生境中长期存在的捕食胁迫可能至关重要。
